PCR-测序法对啮齿类动物汉坦病毒的检测和基因分型
2014-07-25戴方伟宋晓明卢领群周莎桑萨晓婴吕宇应华忠
戴方伟,宋晓明,卢领群,周莎桑,萨晓婴,吕宇,应华忠
(1浙江省医学科学院实验动物中心,杭州 310013;2杭州师范大学实验动物中心,杭州 310036)
汉坦病毒(Hantavirus,HV)属布尼亚病毒科,是一种有包膜分节段的负链RNA病毒,包括引起汉坦病毒肾综合征出血热(HFRS)的汉坦型、汉城型、普马拉型等,以及引起汉坦病毒肺综合征(HPS)的纽约型、无名型等,在我国以汉坦型和汉城型为主要流行株[1]。自然宿主以小型啮齿动物为主,并经由啮齿类动物传染给人类,引起HFRS或HPS等[2],因此从事实验动物生产及科学研究人员存在接触携带HV的宿主动物及其排泄物、污染的尘埃等而被感染的风险。由于HV引发疾病的类型及其严重程度取决于病毒的型别,对汉坦病毒株的分型,以及阐明病毒之间的关系对HV病原防治具有重要的意义[3-4]。
实验动物汉坦病毒的检测有血清检测和基因检测两种,目前血清检测是汉坦病毒检测的主要方法。该法虽能用于汉坦病毒分型,但存在实验周期长、工作量大等问题。已有研究表明,依据M基因片段上部分核苷酸序列构建系统发生树,分型结果与血清学分型结果一致[5]。基于病毒基因序列数据分析不但能对病毒进行基因分型,而且也能较好地反映病毒间的系统发生关系。本研究根据GenBank中部分有代表性的毒株基因S片段序列设计引物,采用邻位相连法进行系统进化分析,以此方法对浙江省近年从野生啮齿类动物中临床分离的汉坦病毒毒株进行分型鉴定,旨在探讨适合实验动物汉坦病毒基因分型和种系发生重建的分子生物学方法。
1 材料与方法
1.1 主要试剂
RNA提取试剂盒RNeasy Mini Kit购自美国Qiagen公司;克隆载体、T4连接酶、M-MLV逆转录酶、DNA Taq酶、聚合酶链反应(PCR)相关试剂、琼脂糖凝胶纯化试剂盒及质粒DNA纯化试剂盒购自日本TaKaRa中国分公司。引物合成由上海生工生物工程公司完成。HV直接荧光抗血清和HV单克隆荧光抗体均由浙江省肾综合征出血热重点实验室提供。
1.2 分析用汉坦病毒株
24株HV代表株序列下载自Genbank数据库,包括7种血清亚型,详细信息见表1[5]。

表1 24株HV代表株的信息Tab.1 The information of 24 representative hantavirus strains
本研究选取11株HV实验毒株进行系统分析, 这11株HV实验毒株分别为:天77-2、游10-31、泉547、龙泉、游 10-30、R88、N1、N2、N3 以及 1 株汉城病毒标准株N4(UR,SEO血清型)和1株HV标准株T8(76-118,HTN血清型)。上述实验毒株中,N4和 T8为阳性对照,同时采用了肺440、肺473、471、97这4个临床检测阴性样本的DNA作为阴性对照。所有病毒DNA样本及血清学鉴定信息均由浙江省肾综合征出血热重点实验室提供。毒株信息详见表2。

表2 研究中用于系统发生分析的HV株鉴定及其来源信息Tab.2 Identification and sources of hantavirus used for the phylogenetic analysis in the present study
1.3 引物设计
S片段的扩增引物参考已知HV株的核苷酸序列,本实验室自行设计并由上海生物工程公司合成,引物序列为上游引物:ATTAGCCCWGTCATGAGTGT,下游引物:CTTTGACTCYTTTGKYTCCA,扩增产物长度201 bp。
1.4 RT-PCR扩增
利用引物对上述病毒株进行RT-PCR扩增,PCR产物的克隆及筛选方法见文献[6]。具体步骤如下:
1.4.1 提取病毒总RNA
根据Qiagen的RNA提取试剂盒说明书操作。
1.4.2 反转录
以提取的RNA为模板进行反转录,反转录体系为:模板 RNA(约 500 ng)1 μL,Random primers(25 μmol/L)1 μL,DEPC 水4 μL;70℃保温10 min,迅速置冰浴2 min;再加入:5× MMLV buffer 2 μL,dNTP mix(10 mmol/L)0.5 μL,RNase inhibitor(40 U/μL)0.25 μL,RTase MMLV(200 U/μL)0.5 μL,DEPC 水 0.75 μL;总体积为 10 μL。反应条件为:30℃保温10 min,42℃ 1 h,70℃ 15 min。反应结束后,迅速置于冰上冷却,-20℃保存备用(以上所有操作均在冰上进行),获得cDNA。

图1 24株HV代表株S片段引物设计区基因的分型结果Fig.1 Genotyping results of S segments of 24 representative strains of hantavirus
1.4.3 PCR扩增
以反转录获得的cDNA为模板,利用上述设计的引物进行PCR扩增,反应体系为:模板0.5 μL,10× PCR buffer(含 Mg2+)2 μL,MgCl2(终浓度 2.5 mmol/L)2 μL,dNTP(终浓度 75 μmol/L)0.15 μL,Taq酶(0.75 U)0.15 μL,正反向引物(终浓度0.25 μmol/L)各0.5 μL,DEPC 水补足至20 μL 体系。反应条件为:94℃预变性5 min后,94℃变性30 s,52℃退火30 s,72℃延伸30 s,扩增30个循环。PCR产物电泳验证后,回收目的片段。
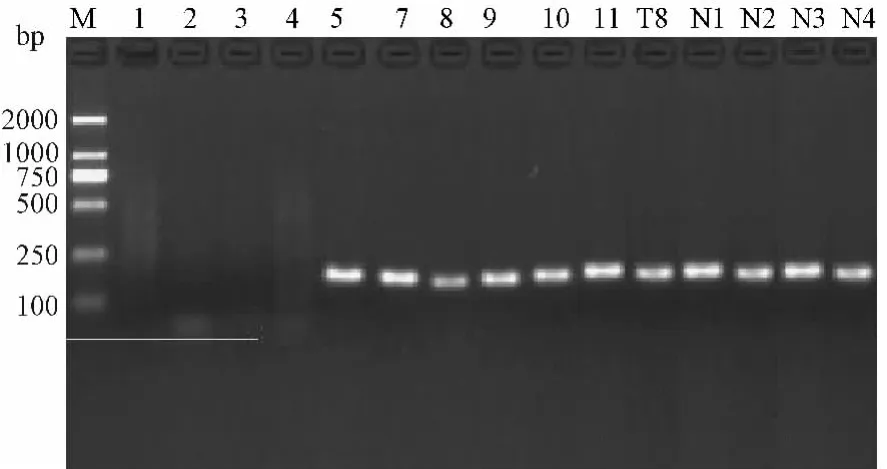
图2 各病毒样本的PCR产物电泳图Fig.2 Electrophoresis map of PCR products from virus samples isolated from wild rodents in Zhejiang Province
1.5 核苷酸序列测定和分析
核苷酸序列测定由上海生物工程公司完成,将测定的序列结果应用DNA STAR软件(SeqMan)进行拼接,应用CLUSTALW软件进行多序列联配,并MEGA 4.0软件包进行系统发生分析,以邻位相连法(neighbor-joining,NJ)构建系统发生树。
2 结果
2.1 利用目标序列构建代表株的系统发育树

图3 24株HV代表株和11株实验毒株S片段引物设计区基因的分型结果Fig.3 Genotyping results of S segments of 24 representative strains and 11 wild-isolated strains of hantavirus
24株HV代表株的S片段序列均来自Gen-bank,通过BLASTN确定目标序列区域,经多序列联配后,通过MEGA软件构建系统发育树(NJ法)。该系统发育树将所分析的毒株分为5个区域,即引起肾综合征出血热HTN、SEO、DOB、PUU血清型、以及引起汉坦病毒肺综合征的Sin Nombre血清族(AND,BAY,SNV)(图1)。引起HFRS的四种血清型具有较稳定的拓扑结构,且能与引起HPS的血清型进行区分。其中PUU血清型的毒株与引起HPS的HV具有更近的进化距离。引起HPS的三种血清型亲缘关系较近,其中AND血清型与BAY和SNV的差异较大,而后二者虽然形成较独立的分区,但自展值较小(<50)。
2.2 实验毒株的检测和系统发育分析
利用本文设计的引物对实验毒株进行PCR扩增。结果发现该引物在11株实验毒株(含阳性对照T8和N4)中扩增结果均为阳性,且产物大小与目标区域一致,而阴性对照组中没有条带(图2)。由此表明本引物对HV的检测具有很好的敏感性和特异性。PCR产物随后进行测序和拼接,并加入24株代表株的序列进行系统发育树的构建(图3)。结果表明系统发育分析将已知血清型的T8毒株分为HTN分支,N4毒株分为SEO血清型,另外9株血清型不明的毒株分为4个血清型,其中天77-2、游10-31和龙泉为HTN血清型,N1为SEO血清型;而其余5个毒株则形成较为独立的两个分支,即(N2,N3)和(泉547,游10-30,R88),这两个分支之间亲缘关系较近,且与本文选取的5个代表性血清型具有较大的差异。
3 讨论
PCR技术具有周期短,耗费少且敏感性、特异性高等优点,在临床检验和生物安全等领域的应用越来越广泛。国外大型实验动物机构在实施实验动物质量监测和病原体诊断中,均将基于PCR的分子生物学检测方法作为首选手段。在HV的检测中,PCR方法可比血清学抗体方法早5~15 d检测到阳性结果[7]。本文报道了针对HV S片段进行检测的引物,系统发育分析表明该引物的目标区域可对已知的代表株进行准确的分型。此前的研究报道S片段构建的进化树不能准确区分SEO和DOB两种血清型[5]。本文的分析观察到SEO和DOB血清型有更近的亲缘关系,但目标片段的系统发育分析能对其进行较好的分类。
本文同时利用所设计引物对浙江省现有的11株HV进行了分型检测,结果表明该引物具有高度的敏感性和特异性,提示其具有用以临床检测HV的价值。由于HV的自然宿主主要是小型啮齿类动物,经由排泄物、唾液、直接接触或虫媒等传染人,因此对啮齿类动物的HV进行快速检测和分型将有助于HV流行病学调查和感染控制等后续处置工作。本研究所使用毒株均为浙江省各地近几年从野生啮齿类动物上分离的临床毒株,具有一定的地域代表性。对其中9株啮齿类动物分离获得的血清型未知毒株的系统发育分析发现其包含引起HFRS的HTN(3株)和SEO(1株)血清型,其他5株HV属于两种未知血清型。下一步我们将对这5株病毒株进行全基因组的分型测序,以探讨说明是否存在毒株变异的情况。
[1]Kramski M,Meisel H,Klempa B,et al.Detection and typing of human pathogenic hantaviruses by real-time reverse transcription-PCR and pyrosequencing[J].Clin Chem,2007,53(11):1899-1905.
[2]Ramsden C,Melo FL,Figueiredo LM,et al.High rates of molecular evolution in hantaviruses[J].Molec Biol Evol,2008,25(7):488-492.
[3]Jonsson CB,Figueiredo LTM,Vapalahti O.A global perspective on hantavirus ecology,epidemiology,and disease[J].Clin Microbiol Rev,2010,23(2):412-441.
[4]Escadafal C,Avši?倣 -Županc T,Vapalahti O,et al.Second external quality assurance study for the serological diagnosis of hantaviruses in Europe[J].Plos Negl Trop Dis,2012,6(4):e1607.
[5]张永振,屈勇刚,杨东明,等.汉坦病毒系统分析及其基因分型的研究[J].中国人兽共患病学报,2006,22(3):193-197.
[6]姚苹苹,徐芳,朱函坪,等.浙江省丽水地区2株汉坦病毒分离株的型别鉴定和基因差异研究[J].中华流行病学杂志,2009,30(2):175-178.
[7]Vaheri A,Vapalahti O,Plyusnin A.How to diagnose hantavirus infections and detect them in rodents and insectivores[J].Rev Med Virol,2008,18(4):277-288.
