螺旋藻γ-亚麻酸的提取优化及体外抗氧化活性的研究
2014-07-25佘星星孙冰洁杜嘉琛张家玮任迪峰
王 菲,佘星星,孙冰洁,杜嘉琛,张家玮,任迪峰,* ,鲁 军
(1.北京林业大学生物科学与技术学院,北京市林业食品加工与安全重点实验室,北京 100083;2.中国食品发酵工业研究院,北京市蛋白功能肽工程技术研究中心,北京 100015)
钝顶螺旋藻(Spirulina platensis,SP)属蓝藻门(Cyanophyta),颤藻科(Oscillatoriales),螺旋藻属或节旋藻属(Arthrospira)[1]。螺旋藻富含人体必需氨基酸、维生素、矿物质、微量元素、不饱和脂肪酸等多种营养物质,具有抗氧化、抗辐射、抗肿瘤等多种生物功效[2-3],被联合国粮农组织及联合国世界食品协会推荐为“二十一世纪最理想食品”。螺旋藻中GLA含量占其总脂肪酸含量 80~250g·kg-1[4],高于螺旋藻常见提取来源月见草(80g·kg-1)和琉璃苣(210g·kg-1)。螺旋藻生产厂家遍布云南、内蒙古等10多个省份,年产量高达1000t[5],但目前市场螺旋藻产品多为藻粉和片剂,螺旋藻粉直接应用于食品中因其溶解性质的局限性,不利于人体吸收,因而螺旋藻应用受到一定限制。
γ-亚麻酸是人体代谢过程中不可或缺的多不饱和脂肪酸,是合成前列腺素E1的前体物质。GLA还能够衍生成如二高-γ-亚麻酸(DHGLA)以及花生四烯酸(AA)等物质[6]。GLA及其衍生物具有多种有益的药理作用。许多研究证明,GLA具有多种生物活性,如抗肿瘤,减肥,抗血栓,降低低密度脂蛋白等活性[7-10]。
目前,有研究采用超临界CO2萃取法(SCE),以乙醇为夹带剂,从极大螺旋藻中提取GLA,回收率为4.4g·kg-1(GLA/干 量)[11]。Sajilata 等 人[12]优 化 了SCE提取方法,从钝顶螺旋藻中提取得到5.1g·kg-1GLA。但是SCE高成本,产率低的特点限制了其在大规模工业化提取GLA中的应用。此外,对于GLA的体外抗氧化活性鲜有报道。因此,本研究目的为建立一种经济的从螺旋藻中提取GLA的有机溶剂提取方案,并对螺旋藻GLA的抗氧化活性进行研究,为开发利用我国丰富螺旋藻资源以及开发新型医疗保健食品提供依据。
1 材料与方法
1.1 材料与仪器
螺旋藻粉 内蒙古再回首生物工程限公司(中国内蒙古,鄂尔多斯);人正常肝细胞HL-7702细胞系 中国科学院上海细胞库,培养于含有10%胎牛血清以及1%青霉素链霉素的RPMI1640培养基中;γ-亚麻酸甲酯标准品 美国AccuStandard公司;乙醇、丙酮、石油醚(分析纯)等试剂 北京化学试剂公司。
7890A气相色谱 安捷伦,配有火焰离子检测器和 INNOMAX 极性柱(30m ×250μm ×0.25μm);SHZ-88水浴恒温振荡器 金坛市国旺实验仪器厂;SHB-III真空泵 郑州长城科工贸有限公司;RE-5203旋转蒸发仪 上海亚荣生化仪器厂;752紫外可见分光光度计 上海美谱达仪器有限公司。
1.2 实验方法
1.2.1 提取方案设计 采用单因素实验方法对螺旋藻中GLA进行提取,探讨提取溶剂、提取料溶比、提取温度、提取时间对提取得率的影响。
将60g螺旋藻粉放入避光烧瓶中,加入60mL提取溶剂,于60℃恒温水浴120min后,转移到旋转蒸发仪。在压力175MPa温度40℃条件下蒸去大部分溶剂后,产物冷冻干燥并进行GLA定量。将螺旋藻粉与提取效果最好溶剂乙醇分别以不同料溶比(w/v):1∶8、1∶10、1∶12、1∶15、1∶18 混合,其余操作步骤同上所述。将螺旋藻粉与乙醇以从上步实验获得最佳料溶比混合,分别在60℃水浴加热30、60、90、120、150min,其余步骤如上所述。按照之前实验所得最佳料溶比、最佳提取时间,分别在30~80℃水浴温度条件下,每10℃一组,进行提取实验,后续步骤如前所述。
1.2.2 GLA含量测定 将真空冷冻干燥后的提取物用正己烷溶于10mL的烧瓶中,加入1mL H2SO4-CH3OH(1∶9,v/v)混合液后在70℃条件下恒温水浴10min进行甲酯化。甲酯化后样品置于室温下冷却后加入1mL正己烷后,再加入去离子水定容至10mL。取上层液体1μL用于气相色谱定量。定量时流速30mL·min-1,程序升温,190℃保持 3min 进而以8℃·min-1速度升高至230℃并保持8min。注射器和检测器的温度分别是220℃和250℃。
将γ-亚麻酸甲酯标准品溶于正己烷配制不同浓度 0.025、0.050、0.075、0.100、0.125g·L-1的溶液,GC定量分析后,以浓度为横坐标,峰面积为纵坐标绘制标准曲线。标准曲线显示良好线性关系(R2=0.9941)。将提取得到螺旋藻GLA样品甲酯化后,GC色谱进样定量,得到峰面积带入公式(1)纵坐标,得到γ-亚麻酸甲酯浓度后换算为GLA浓度。

最终螺旋藻GLA提取产量由下式计算:
GLA产量=(提取所得GLA浓度×1mL×10)/藻粉质量×100
1.2.3 实验参数正交优化及螺旋藻GLA纯化 基于料溶比 (1∶10、1∶12、1∶15)、提取时间 (60、90、120min)、提取温度(60、70、80℃)三个单因素实验结果,进行了L9(34)三因素三水平正交实验优化实验参数,实验设计如表1所示。采用文献[12]方法对螺旋藻GLA进行纯化,纯化后螺旋藻GLA提取物纯度由58.9%提高到90%,进一步应用于抗氧化活性分析。

表1 L9(34)正交实验的各个因素和水平Table 1 Factors and levels of the L9(34)orthogonal test
1.2.4 DPPH自由基清除能力 DPPH自由基清除能力采用Burits等人[13]的方法进行测定。
1.2.5 羟自由基清除能力 参照周波等人[14]方法进行测定。
1.2.6 脂质抗氧化能力 脂质过氧化抑制能力评价采用文献[15]的方法,利用不饱和脂肪酸氧化产物与硫代巴比妥酸(TBA)反应生成有色化合物在535nm有最大吸收值。此法基于卵磷脂能够创造一层脂质层用于反应并且Fe2+能够诱导氧化反应。
1.2.7 对双氧水氧化损伤HL-7702细胞保护作用 将生长良好的HL-7702细胞以1×105mL-1密度接种于96孔板,每孔100μL,于37℃ CO2培养箱中孵育24h。细胞贴壁后以含50μmol·L-1GLA提取物培养基预先孵育24h,再以不同浓度双氧水染毒HL-7702细胞18h,并设置对照组及调零孔,每组三个复孔。处理后的细胞采用MTT比色法进行细胞活率检测,每孔加入 20μL 0.5%MTT(5mg·mL-1)避光37℃孵育4h后吸弃上清液,加入100μL的DMSO,避光振荡10min,使结晶物充分溶解后,酶标仪492nm处测定吸光值。结果表示为同对照组相比的百分值。

表2 单因素实验结果Table 2 Results of single factor test
2 结果与分析
2.1 各个提取条件对提取结果影响
本实验分别控制提取溶剂、提取温度、料溶比、提取时间等因素的变化来研究各个因素对提取结果的影响,实验结果如表2所示。
从表2中看出,乙醇提取效果明显优于其它两种有机溶剂。乙醇溶剂提取产率近于丙酮提取产率的2倍,并且将近石油醚提取产量的12倍。此外,由于丙酮作为提取溶剂时可能会转化为有害的丙酸[16],而乙醇常被用于从植物材料中提取天然产物[17],因而选用乙醇作为从SP中提取GLA的提取溶剂。乙醇在提取SP中的油脂时其夹带效果与其自身氢键和离子力共同作用,从而增加了油脂在乙醇中的溶解度,因而GLA产量得到提高[18]。
随着料溶比由1∶8降低至1∶12时,GLA产量显著增加,当料溶比继续降低时,产量仍略有升高,但不显著。此结果与之前研究表现出相同的趋势,表明了随着料溶比降低,螺旋藻中油脂产量升高[19]。
GLA产量随着时间变化趋势与料溶比相似,提取时间90min及150min时均出现增长,从成本节约角度考虑,90min为较适宜提取时间。同样随着提取温度升高,GLA与乙醇的扩散率进一步加剧,GLA产量大幅度升高。
随着提取温度升高至60℃时,GLA产量显著升高,温度继续上升至70℃时GLA产量达到最大。这是由于溶剂和溶质(脂质成分)扩散性加剧所致。但当提取温度高于乙醇沸点70℃时,大量乙醇溶剂沸腾而挥发至空气中,提取溶剂急剧减少,导致提取效率急剧下降[19]。
2.2 正交实验优化
L9(34)正交实验结果如表3所示,三个因素对GLA产量的影响顺序从高到低分别为提取温度、料溶比、提取时间(C>A>B)。最优组合为A2B2C2即料溶比1∶12,提取时间90min,提取温度70℃。采用最优条件从SP中提取GLA 得到了(8.3±0.17)g·kg-1,与之前研究中采用SCE 方法得到的产率4.4g·kg-1和5.1g·kg-1相比,产量至少提高了 62.7%[11-12]。
2.3 螺旋藻GLA抗氧化活性
以广泛公认的抗氧化剂VC为阳性对照,螺旋藻GLA提取物DPPH自由基抑制活性结果如表4所示:
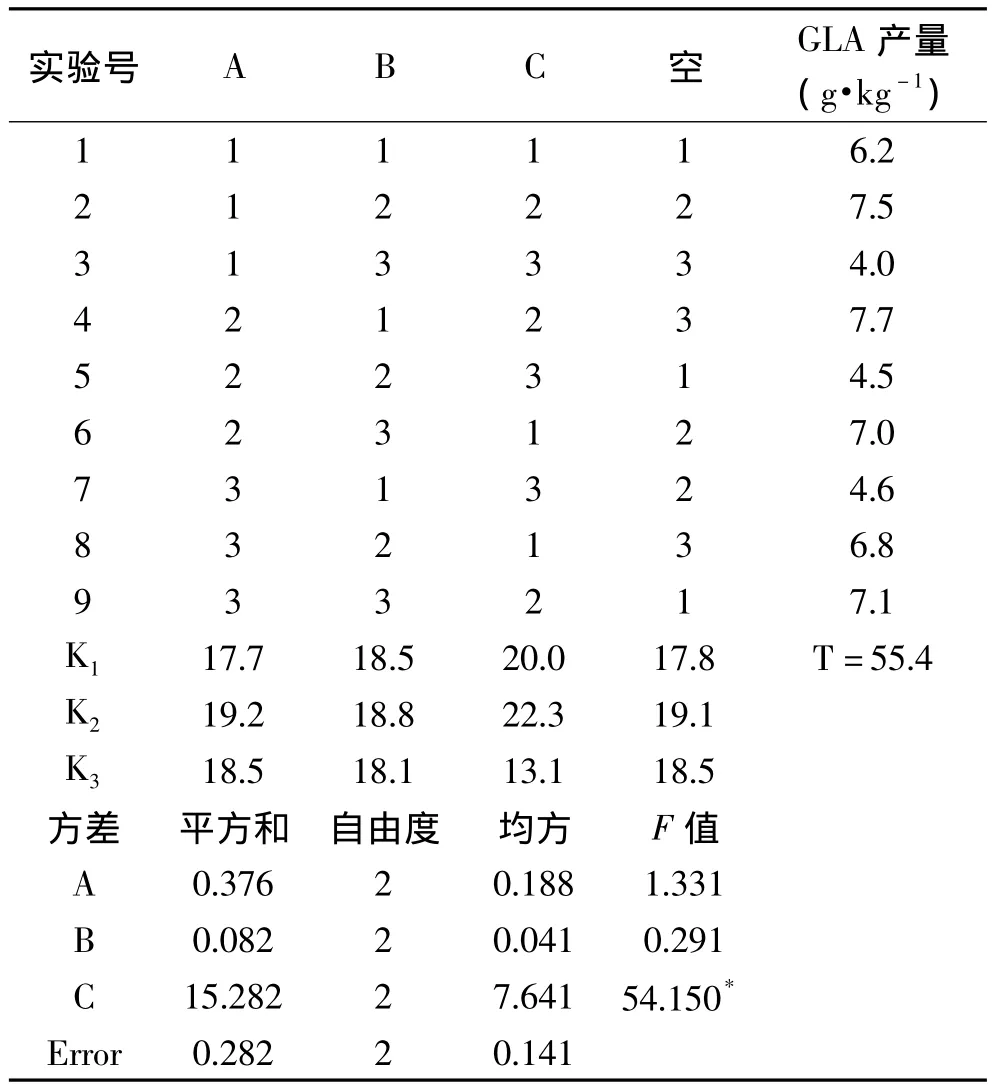
表3 L9(34)正交实验结果及方差分析Table 3 Results and variance analysis of the L9(34)orthogonal test

表4 GLA提取物对DPPH自由基清除效果Table 4 Inhibitory activity of the γ-linolenic acid extract on 1,1-diphenyl-2-picrylhydrazyl radicals
随着 VC浓度升高(100~800mg·L-1),其对DPPH自由基抑制率呈线性升高(y=112.59x+4.6648,R2=0.9735),展现了良好的DPPH自由基清除效果。但与之相反,尽管GLA浓度呈指数升高,其抑制效果仍然较低。
同样的,VC展现出明显的羟基自由基清除效果,如表5所示,尽管随着GLA提取物浓度升高,抑制百分率相应小幅度升高,在一定浓度范围内展现出了羟基自由基清除效果,但不足以充分体现其抗氧化活性。

表5 不同浓度VC/GLA的羟基自由基清除能力Table 5 Inhibitory activity of the γ-linolenic acid extract on hydroxyl radicals
GLA提取物脂质抗氧化能力如表6所示,螺旋藻GLA与VC均展现出良好的脂质抗氧化能力,并呈浓度依赖性。10mg·L-1的GLA提取物的自由基抑制率(47.67% ± 0.40%)甚至高于 100mg·L-1的 VC,展现出了极强的脂质抗氧化能力。实验证明以大鼠尾模型,饲喂添加GLA饲料后其体内总抗氧化能力及抗脂质过氧化能力得到增强[20]。

表6 不同浓度GLA提取物的脂质抗氧化能力Table 6 Inhibitory activity of the γ-linolenic acid extract on Fe2+induced lipid peroxidation
2.4 螺旋藻GLA对双氧水所致HL-7702细胞氧化损伤的保护作用
较早实验结果显示 250μmol·L-1浓度以下的螺旋藻亚麻酸对HL-7702细胞无损伤作用(数据未显示)。图 1显示,不同浓度双氧水处理均会对HL-7702细胞造成损伤,且呈现出浓度依赖性,700μmol·L-1双氧水处理导致细胞活率下降为对照组的60%。50μmol·L-1螺旋藻 GLA 预先孵育处理能够有效抑制各个浓度双氧水导致的细胞活率下降,尤其对 700μmol·L-1损伤细胞具有显著保护作用。这可能与其较强的脂质抗氧化能力有关,通过自身氧化抑制HL-7702细胞膜脂质过氧化发生,避免细胞因细胞膜受损所致细胞活率下降。
3 讨论

图1 GLA提取物对H2O2所致氧化损伤HL-7702细胞保护作用Fig.1 Protective effect of GLA on H2O2-induced HL-7702 cells
DPPH自由基被广泛用于测定多种天然物质的体外抗氧化活性,这是因为其能够排除葡萄糖干扰而具有很好的稳定性[21]。但最近有争论称其不存在于体内,因而不能反映真实的代谢情况[22]。Fenton反应是最常见的产生羟基自由基的化学反应,邻菲罗啉-Fe2+是一种常见的氧化还原指示剂,能够根据系统的氧化还原状态的变化改变它的颜色。此外,GLA具有高不饱和度而极易被氧化,DPPH和羟基自由基清除法为水相环境,可能会导致水包油型乳状液的氧化,因而影响GLA提取物的稳定性以及自由基清除能力[23]。因此,GLA提取物在水相环境中没有展现出明显的抗氧化活性,其抗氧化能力受到了限制。
亚铁离子能够诱导脂质产生自由基,并引发链反应,最终导致脂质过氧化作用。而具有抗氧化能力的物质能够与脂质过氧化的中间产物发生反应,例如脂质自由基,终止链反应并最终抑制脂质过氧化。这种机制可以用来建立一种不饱和脂肪酸(UFA)的氧化模型,用来评估样品的抗氧化性。螺旋藻GLA清除DPPH自由基和羟基自由基活性实验提示虽然螺旋藻GLA提取物本身容易被氧化,但难以在水相环境中发挥其抗氧化活性。与之相反,脂质抗氧化能力能够成功模拟体内的脂质环境,因而螺旋藻GLA提取物表现出较强的脂质抗氧化能力。
H2O2常用于制造氧化应激引起的细胞损伤模型,氧化损伤细胞中由H2O2介导的自由基ROS大量产生[24]。在人体内,不饱和脂肪酸是细胞膜的组成成分,容易受到自由基的攻击,从而导致不可控的链反应发生脂质过氧化并最终导致生物损伤。GLA提取物可能先通过自身被氧化保护细胞或者细胞膜免受自由基攻击,并保护细胞免受脂质过氧化的威胁,最终降低由自由基带来的损伤,对氧化损伤HL-7702细胞起到保护作用。关于螺旋藻GLA提取物的抗氧化护肝效果的详细作用机制有待进一步深入研究。
4 结论
4.1 同丙酮和石油醚相比,乙醇更适合作为从SP中提取GLA的提取溶剂。
4.2 以乙醇为溶剂,1∶12(V/V)料溶比70℃恒温条件下提取90min能够得到最高GLA产量8.3±0.17g·kg-1(GLA/干物质量)。
4.3 螺旋藻GLA提取物具有较强的抑制Fe2+诱导的脂质过氧化效果。
4.4 螺旋藻GLA提取物能够保护人正常肝细胞免受双氧水所致氧化损伤,其体外抗氧化生物活性具有潜在功能应用价值。
[1]王继平,任景,武爱民.螺旋藻营养和保健功效概述[J].包头医学,2012,36(3):145-147.
[2]张成武,曾昭琪,张媛贞,等.钝顶螺旋藻藻蓝蛋白对小鼠急性放射病的防护作用[J].营养学报,1996,18(3):327-331.
[3]王勇,钱峰,钱凯先,等.藻蓝蛋白抗癌活性研究[J].浙江大学学报,2001,35(6):672-675.
[4]Cohen Z,Reungjitchachawali M,Siangdung W,et al.Production and partial purification of gamma-linolenic acid and some pigments from Spirulina platensis[J].J Appl Phycol,1993,5(1):109-115.
[5]胡鸿钧.螺旋藻生物学及生物技术原理[M].北京:科学出版社,2003.
[6]Fan YY,Chapkin RS.Importance of dietary gamma-linolenic acid in human health and nutrition[J].J Nutr,1998,128(9):1411-1414.
[7]Naidu MR,Das UN,Kishan A.Intratumoral gamma-linolenic acid therapy of human gliomas[J].Prostag Leukotr Ess,1992,45(3):181-184.
[8]Cameron NE,Cotter MA.Comparison of the effects of ascorbyl gamma-linolenic acid and gamma-linolenic acid in the correction of neurovascular deficits in diabetic rats[J].Diabetologia,1996,39(9):1047-1054.
[9]Kernoff PB,Willis AL,Stone KJ,et al.Antithrombotic potential of dihomo-gamma-linolenic acid in man[J].Br Med J,1997,2(6100):1441-1444.
[10]Ishikawa T,Fujiyama Y,Igarashi O.Effects of gammalinolenic acid on plasma lipoproteins and apolipoproteins[J].Atherosclerosis,1989,75:95-104.
[11]Mendes RL,Reis AD,Palavra AF.Supercritical CO2extraction of γ-linolenic acid(GLA)and other lipids from Arthrospira(Spirulina)maxima:Comparison with organic solvent extraction[J].Food Chem,2006,99(1):57-63.
[12]Sajilata MG,Singhal RS,Kamat MY.Supercritical CO2extraction of gamma-linolenic acid from Spirulina platensis ARM 740 using response surface methodology[J].J Food Eng,2008,84(2):321-326.
[13]Burits M,Asres K,Bucar F.The antioxidant activity of the essential oils of Artemisia afra,Artemisia byssinica and Juniperus procera[J].Phytother Res,2001,15(2):103-108.
[14]周波,王晓红,陈丽丽,等.玉米紫色植株色素体外抗氧化活性实验研究[J].现代食品科技,2006,23(4):23-25.
[15]Yamini D,Anand K.Antioxidative activity of some vegetable peels determinedin vitroby inducing liver lipid peroxidation[J].Food Res Int,2009,42(9):1351-1354.
[16]Singh HB,O ′Hara D,Herlth D,et al.Acetone in the atmosphere:Distribution,sources,and sinks[J].J Geophys Res,1994,99(D1):1805-1819.
[17]da Costa Rodrigues C E,Ramon O.Response surface methodology applied to the analysis of rice bran oil extraction process with ethanol[J].Int J Food Sci Tech,2010,45(4):813-820.
[18]Certik M,Andrasi P,Sajbidor J.Effect of extraction methods on lipid yield and fatty acid composition of lipid classes containing gamma-linolenic acid extracted from fungi[J].J Am Oil Chem Soc,1996,73(3):357-365.
[19]Chaiklahana R,Chirasuwana N,Lohab V,et al.Lipid and fatty acids extraction from the cyanobacterium Spirulina[J].Sci Asia,2008,34:299-305.
[20] Frenoux JMR,ProstED,Belleville JL,etal.A polyunsaturated fatty acid diet lowers blood pressure and improves antioxidant status in spontaneously hypertensive rats[J].J Nutr,2001,131(1):39-45.
[21]Blois MS.Antioxidant determinations by the use of a stable free radical[J].Nature,1958,181(26):1199-1200.
[22]Wolfe KL,Kang XM,He XJ,et al.Cellular antioxidant activity of common fruits[J].J Agric Food Chem,2008,56(18):8418-8426.
[23]Nijveldt RJ,Tan AM,Prins HA,et al.Use of mixture of medium-chain triglycerides and long-chain triglycerides versus long-chain triglycerides in critically ill surgical patients-a randomized prospective double blind study[J].Clin Nutr,1998,17(1):23-29.
[24]Bak MJ,JunM,Jeong WS.Antioxidant and Hepatoprotective Effects of the Red Ginseng Essential Oil in H2O2-Treated HepG2 Cells and CCl4- Treated Mice[J].Int J Mol Sci,2012,13(2):2314-2330.
