基于SIRT1轴探讨不同强度有氧运动对NAFLD大鼠脂肪性肝炎的影响
2014-07-19赵美琴史长征陈红辉
赵 军,赵美琴,史长征,陈红辉
基于SIRT1轴探讨不同强度有氧运动对NAFLD大鼠脂肪性肝炎的影响
赵 军1,2,赵美琴3,史长征4,陈红辉2
目的:研究不同强度的有氧运动对NAFLD大鼠肝脏炎性病变的影响。方法:雄性SD大鼠50只,随机分为普通安静组(ND)、高脂安静组(C)、高脂小强度运动组(LE)、高脂中等强度运动组(ME)、高脂较大强度运动组(IE)。普通组和高脂组分别以普通或高脂饲料喂养,共计16周,运动组进行6周跑台运动。实验结束时,进行肝HE染色组织学分析,PI/PO MRI对肝脂质进行半定量分析,腹主动脉血测定血清肝功能酶和血脂含量,肝组织匀浆测定SOD、MDA水平,荧光定量PCR和Western Blot,分别测定SIRT1、MCP1、NCF2、PPARα mRNA表达以及SIRT1、核NF-κBp65蛋白表达。结果:高脂喂养16周后,高脂安静组大鼠发生脂肪肝炎和纤维化变,6周有氧运动可减少运动组大鼠肝脂质沉积,改善肝组织氧化应激;与小强度运动相比,中等及较高强度运动促进HMW脂联素分泌、增加肝细胞SIRT1基因和蛋白表达,抑制核NF-κBp65蛋白和减少下游MCP1、NCF2等炎性细胞因子的表达,显著抑制肝小叶性炎症。结论:不同强度有氧运动可抑制大鼠体重的增加,从而减少因高脂饮食导致的大鼠肝脏脂质沉积;较大强度有氧运动可显著性抑制大鼠NAFLD向NASH方向转化,其机制与促进肝细胞SIRT1信号转导有关,小强度有氧运动抑制大鼠NASH效果不显著。
有氧运动;非酒精性脂肪肝炎;脂联素;SIRT1;NF-κB
非酒精性脂肪肝炎(nonalcoholic steatohepatitis,NASH)是单纯性脂肪肝进一步发展的结果,其病理表现为脂质沉积、炎性细胞浸润、肝组织坏死和纤维化病变[13]。随着世界范围内NASH的发病率日益升高,NASH已成为颇受关注的公共健康问题之一。目前,非酒精性脂肪肝病(NAFLD)向NASH转化的具体机制尚不清楚,但肝细胞氧化应激和促炎因子的生成被认为是导致NASH的重要因素[13]。转录因子NF-κB[20](核转录因子κB)是促炎因子生成的关键调控因子,激活后导致下游相关炎性因子如MCP1(单核细胞化学趋化因子1)、NCF2(嗜中性粒细胞胞质因子2)等的表达,从而募集肝内Kupffer细胞、血循环的单核细胞和中性粒细胞等炎性细胞聚集和释放炎性因子,形成恶性循环,导致肝实质细胞损伤和肝小叶性炎症。组蛋白去乙酰化酶I(SIRT1)是NF-κB的上游蛋白,通过去乙酰化作用而抑制NF-κB的活性,抑制炎性反应的生成,而研究表明[38],NASH肝组织SIRT1表达下调,导致或促进脂肪性肝炎的发生[17]。
有氧运动能抑制或改善NAFLD病理进展,降低血清谷丙转氨酶(ALT)和减少肝脏脂质沉积[41,47]。目前,有关运动对NASH肝内炎性信号通路的影响尚不清楚,不同强度的有氧运动对NASH大鼠肝炎的影响也未见报道。所以,本研究探讨不同强度有氧运动对NASH大鼠肝细胞内炎性因子调控通路的影响。研究假设中等强度、较大强度有氧运动通过增加高分子量脂联素(HMW脂联素)的分泌,促进肝细胞内SIRT1的表达和活性,抑制NF-κB炎性通路,缓解肝小叶脂质性炎症的进展。
1 实验材料与方法
1.1 实验对象与运动方案
健康雄性SPF级6周龄SD大鼠50只(购自广东中医药大学动物中心),体重150~160 g。按照随机数字表法分为5组:普通安静组(Normal Diet Group,ND)、高脂安静对照组(High Fat Diet Control Group,C)、高脂小强度运动组(High Fat Diet with Low Intensity Exercise Group,LE)、高脂中等强度运动组(High Fat Diet with Middle Intensity Exercise Group,ME)和高脂递增负荷运动组(High Fat Diet with Incremental Intensity Exercise Group,IE),每组各10只。各组分笼饲养于动物室中,每笼4~5只。动物室环境温度22℃~26℃,明暗周期为12 h(7:00~19:00)。实验期间,ND组给予普通饲料,高脂组给予高脂饲料,共计16周。大鼠的普通饲料和高脂饲料均购于广东省医学实验动物中心,其中,普通饲料采用美国营养学会推荐的AIN 93G配方(适合生长期),营养成份按能量比例计算,碳水化合物占64%、脂肪16.7%、蛋白质19.3%;高脂饲料的总热量约为506 kcal/100 g,营养成份按能量比例计算,脂肪占59.5%、蛋白质19.7%、碳水化合物20.8%。建模期间隔周取鼠尾静脉血2 ml左右测定血脂(TC、TG、LDL-C)和血ALT,监测建模进展,于第10周末随机抽取高脂组大鼠两只,麻醉后取完整肝称重,剪下肝左叶部分组织行常规固定、脱水和石蜡包埋,切片后HE染色,病理诊断结合高脂组大鼠正常的血ALT水平,确认此时高脂组大鼠已发生非酒精性单纯性脂肪肝(Nonalcoholic simple fatty liver,NAFL),尚未进入NASH阶段。
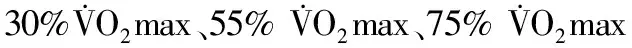
1.2 实验取材
第16周完成最后一次跑台运动后取材。无菌操作下,腹腔注射7%水合氯醛麻醉,沿大鼠腹部正中线剪开腹腔,充分暴露腹膜后腹主动脉,采血置于分离胶采血管内,于室温下静置数分钟。放置高速冷冻离心机内4 ℃、3 500 rpm离心15 min,取血清,一部分用于测试血脂、ALT、总脂联素、高分子量脂联素(HMW脂联素)等;另一部分血清各组分别等比例混合,0.22 μm滤过除菌,分装,用于BRL-3A肝细胞培养,所取血清均于-80 ℃保存。完整取出肝脏,冰生理盐水冲洗,滤纸吸湿后,于肝脏中叶的中间部位切取1 cm×1 cm×1 cm大小的肝组织,用滤纸拭干血迹后于10%甲醛溶液中固定保存,用于HE染色切片;另取部分肝中叶切块分装于冻存管,置于液氮罐备用。
1.3 BRL-3A肝细胞培养和处理
大鼠BRL-3A肝细胞购自中国科学院细胞生物研究所,用10%胎牛血清DMEM培养液,添加100 U/ml青霉素、100 μg/ml链霉素,于37 ℃、5% CO2环境孵育,每毫升培养液中含1×106个肝细胞,接种于6孔培养板中,每孔加2 ml细胞悬液。第2天待细胞贴壁后换用无血清的DMEM培养液,24 h后加入10%的ND、C、LE、ME、IE组大鼠血清,继续培养24 h后收获,提取总RNA。
1.4 检测指标及方法
1.4.1 血清生化指标的测定
大鼠血甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)、谷丙转氨酶(ALT)通过全自动生化分析仪测定(7020全自动生化分析仪,HITACH公司);血清总脂联素和HMW脂联素通过ELISA试剂盒检测(试剂盒分别购于Bluegene和Shibayaji公司)。
1.4.2 肝组织匀浆测定SOD活性、MDA水平
于0℃~4℃冰浴中,将1 g左右肝组织加入适量生理盐水捣碎,用电动搅伴器带动的玻璃匀浆器制成10%组织匀浆;1 000 g离心10 min,取上清液备用。采用考马斯亮蓝法,于722分光光度计上按照试剂盒说明书要求测定肝组织匀浆的蛋白含量。制备肝组织匀浆后,用黄嘌呤氧化酶法测定SOD活性、硫代巴比妥酸法测定MDA水平(两者试剂盒均购于南京建成生物公司)。
1.4.3 肝组织HE染色切片病理学检查
取部分肝左叶,常规固定脱水,石蜡包埋、切片后HE染色;采用双盲法,对光镜下肝脂肪变性、气球样变、小叶性炎症、活动度积分(NAFLD activity score,NAS)进行评估,并对肝纤维化进行分期。
1.4.4 Real Time PCR测定大鼠肝组织SIRT1、PPARα、MCP1和NCF2mRNA以及BRL-3A肝细胞SIRT1和Adipnectin R2mRNA的表达
Trizol一步法提取肝脏、BRL-3A肝细胞总RNA,并对总RNA进行浓度、纯度和完整性的检测。反转录后,在CFX96 realtime PCR仪(Bio-Rad公司)上进行荧光定量PCR反应。SIRT1、PPARα、脂联素受体2(AdipoR2)、MCP1、NCF2的cDNA扩增引物见表1。PCR反应条件,扩增曲线阶段: 95 ℃,30 s;95 ℃,5 s;60 ℃,30 s;70 ℃,30 s,40个循环;融解曲线阶段:融解温度区间为55 ℃~95 ℃,读数间隔为0.5 ℃,每次持续时间为2 s。反应结束后,PCR仪给出各反应孔的Ct值,以β-actin为内参基因,根据公式2-ΔΔCt计算各样品目的基因的相对表达量。
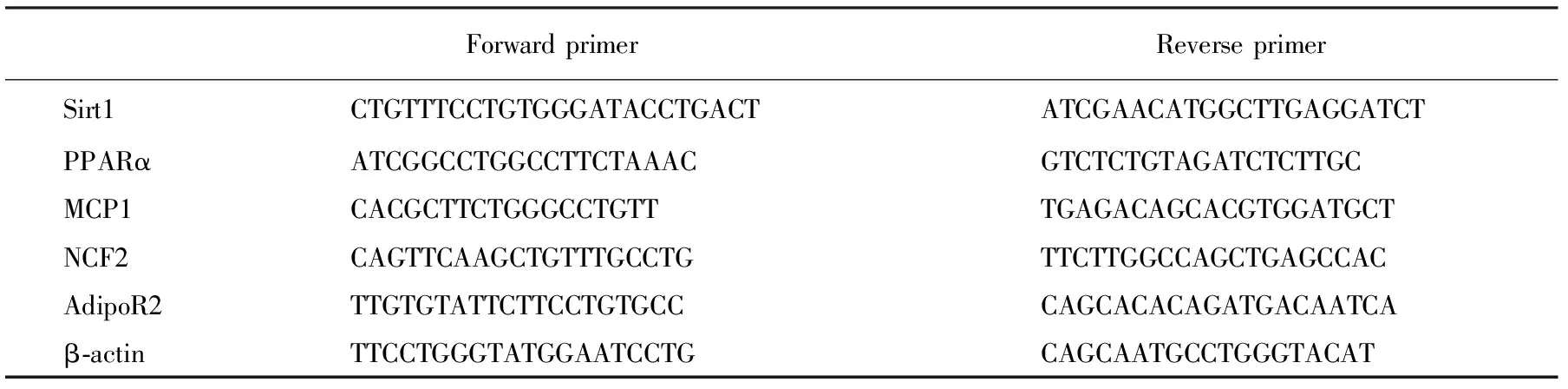
表 1 本研究引物合成序列一览表
1.4.5 Western Blot法测定肝组织SIRT1、核NF-κBp65蛋白表达
分别提取总蛋白和核蛋白后测定蛋白浓度,根据测定的蛋白浓度和上样蛋白40 μg计算上样量。用12%丙烯酰胺凝胶电泳分离目的蛋白及内参蛋白(测定总蛋白的内参蛋白为 GADPH,测定核蛋白的内参蛋白为Histone-1,分别购于江苏碧云天公司和上海艾博抗公司)。将平行胶一块用于考马斯蓝染色,确定电泳效果,另一块进行电转移。将转印槽阴极平放工作台上,在上面加3张电转印液浸透的1 mm厚的滤纸,将用电转印液预浸透15 min的0.45 μm硝酸纤维素膜(NC膜)放在滤纸上,再将凝胶平放在NC膜上,最后在凝胶上加盖3层电转印液浸透约1 mm厚的滤纸,接通电源,100 V、1 h电转印。转移结束后,卸下电泳装置,把硝酸纤维素转移膜放入盛有10%脱脂奶粉封闭液中,封闭2 h。封闭完毕后用PBST洗膜5 min×5。加一抗(SIRT1 1∶1 000、NF-κBp65 1∶500稀释,均购于江苏碧云天公司),室温1 h,摇床。PBST洗膜5 min×5,加1∶1 000的辣根过氧化物酶标记的二抗(购于江苏碧云天公司),室温孵育1 h,摇床。PBST洗膜5 min×5,将NC膜浸泡于增强化学发光试剂,室温孵育3~5 min;用滤纸将NC膜表面液体擦干,置于暗室,用X光底片覆盖,曝光1 min,常规方法显影定影,Gel软件进行图像分析。1.4.6 核磁共振正反相位技术(IP/OP MRI)对肝脂质含量进行半定量检测
实验结束前2天,每组随机选取任意6只大鼠进行IP/OP MRI检查,禁食、禁水12 h,无菌操作下腹腔内注射7%水合氯醛(0.2 ml /100 g weight)对大鼠进行麻醉,以仰卧位将大鼠放置于专用体线圈内,肝脏置于线圈中心位置。采用GE Sigma 3.0T HD磁共振扫描仪,常规T1W、T2W平扫作为后续序列的定位。梯度回波双回波 T1W In Phase/Out Phase序列主要扫描参数:TR70ms,TE 4.6ms(IP)/6.9ms(OP),Nex:12.0,b:0.0,扫描时间120 s。同一大鼠一次扫描同时获取同、反相位信号。在中心体素的左、中、右3个位置选取10 mm2图像为感兴趣区(Region of interest,ROI)进行信号分析,分别测量3个ROI在In Phase和Out Phase上的信号强度(Signal intensity,SI),通过二者之间的差值(SIin-SIout)计算出肝脏脂肪变异指数(fat index,FI)(FI=SIin-SIout/SIin)[12],取3个ROI的FI平均值作为整个肝脏脂肪变异程度的量化指标。
1.5 统计学分析
2 实验结果
2.1 不同强度有氧运动对大鼠体重、血脂、血ALT和血脂联素的影响
实验结束时,各组大鼠体重均有不同程度的增长,C组体重显著性高于运动各组和普通对照组(P<0.01),而运动各组之间体重无显著性差异;运动组血脂、ALT较C组显著性下降,且IE组ALT显著性低于LE组(P<0.05);运动各组血脂之间无显著性差异;C组血清总脂联素和HMW脂联素较ND组显著性减少(P<0.01),而运动各组总脂联素较C组显著性增加,ME、IE组HMW脂联素较C组和LE组显著性增加(P<0.05),并且IE组HMW脂联素显著性高于ME组(P<0.05)。
房产行业是当今社会的热门行业,随着房价的持续走高,人们对房子的质量及建设标准的要求越来越高。而在房产企业的运营中,房产测绘工作有十分重要的现实意义。测绘人员在进行房产测绘工作的过程中,通常会使用一些测绘工具或高科技仪器,从而保证测绘工作的顺利进行以及测绘成果的质量。房产测绘工作完成后,技术人员通过对所得数据信息的处理及分析,明确该处房产的管理权限,税收标准及产权拥有等情况[2]。另外,房产测绘工作还能为当地政府部门进行土地规划提供有效的数据参考。
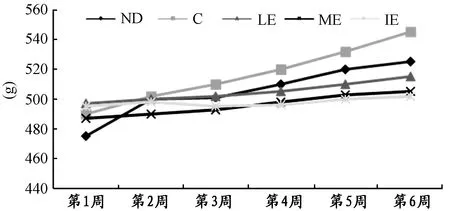
图 1 本研究实验后6周各组大鼠体重变化趋势示意图
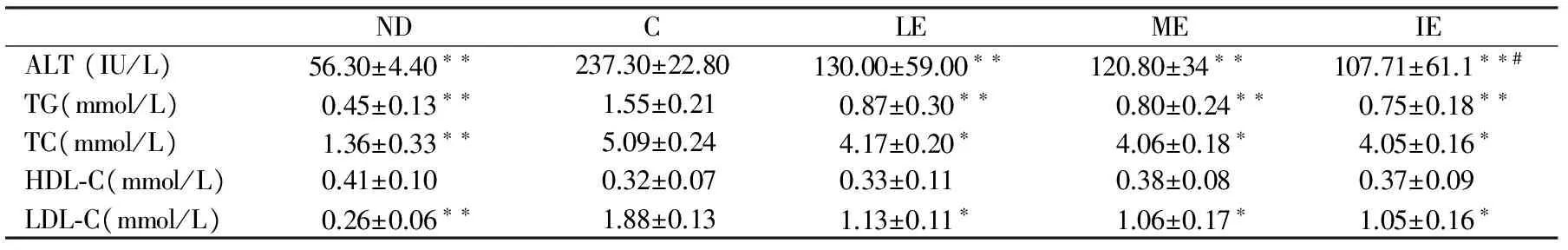
表 2 本研究大鼠血清转氨酶和脂质的变化一览表

表 3 本研究血清总脂联素和高分子量脂联素变化一览表
2.2 不同强度有氧运动对肝SOD、MDA含量的影响
C组肝组织MDA较ND组显著性增加,SOD显著性减少(P<0.05);而运动各组肝组织MDA较C组显著性减少(P<0.05),而SOD显著性增加;随着运动强度的增加,运动组肝组织SOD有升高的趋势,且IE较LE组肝组织SOD活性显著性升高(P<0.05);运动各组之间肝组织MDA水平无显著性差异。

表 4 本研究肝组织氧化应激指标比较一览表
2.3 不同强度有氧运动对肝SIRT1、PPARα、MCP1、NCF2mRNA表达的影响
Real Time PCR结果显示,与ND组比较,C组MCP1、NCF2mRNA表达显著性升高(P<0.01),而PPARα、SIRT1mRNA表达显著性减少(P<0.01);与C组相比,运动各组PPARα、SIRT1mRNA表达均显著性增加;ME和IE组MCP1、NCF2mRNA表达较C组显著性下降,而LE组MCP1、NCF2mRNA表达与C组无显著性差异;运动各组之间,IE组SIRT1、PPARαmRNA表达显著性高于LE和ME组,MCP1mRNA表达显著性低于LE和ME组(P<0.01,P<0.05),并且NCF2mRNA表达显著性低于LE组(P<0.05);ME组SIRT1、PPARαmRNA表达显著性高于LE组(P<0.01)。
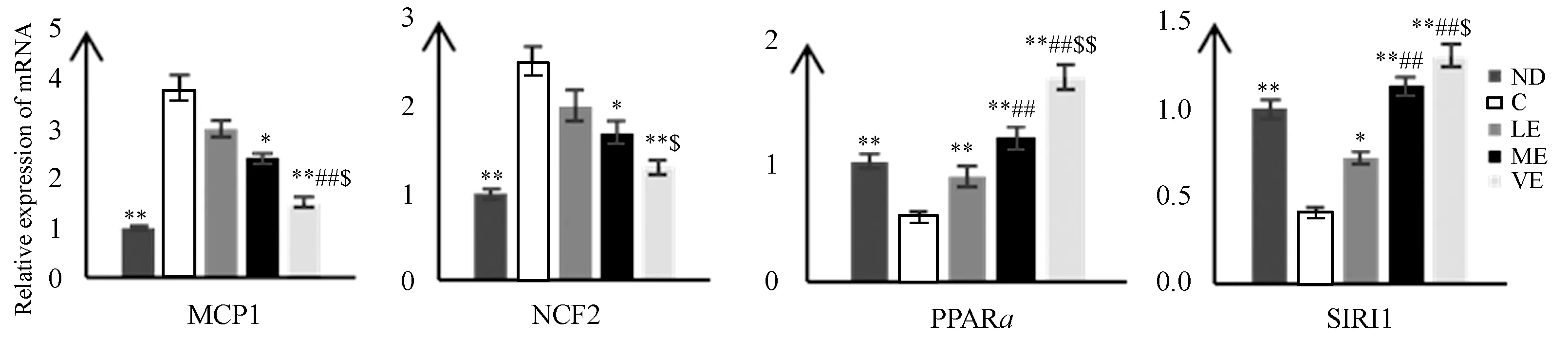
图 2 本研究不同强度有氧运动对肝组织SIRT1、PPARα、NCF2、MCP1mRNA表达的影响示意图
2.4 不同强度有氧运动对肝SIRT1、NF-κB蛋白表达的影响
Western Blot结果表明,C组SIRT1蛋白表达较ND组显著性减少(P<0.01),而核NF-κB蛋白表达较ND组显著性升高(P<0.01);运动各组肝SIRT1蛋白表达均不同程度的升高,核NF-κB蛋白表达均不同程度地受抑制,其中LE组的SIRT1蛋白表达与C组之间无显著性差异;ME和IE组SIRT1和核NF-κB蛋白表达与C组、LE组相比有显著性差异; IE组在SIRT1蛋白表达较LE、ME组显著性增加(P<0.01,P<0.05),而核NF-κB蛋白表达较LE、ME组显著性减少(P<0.01,P<0.05)。
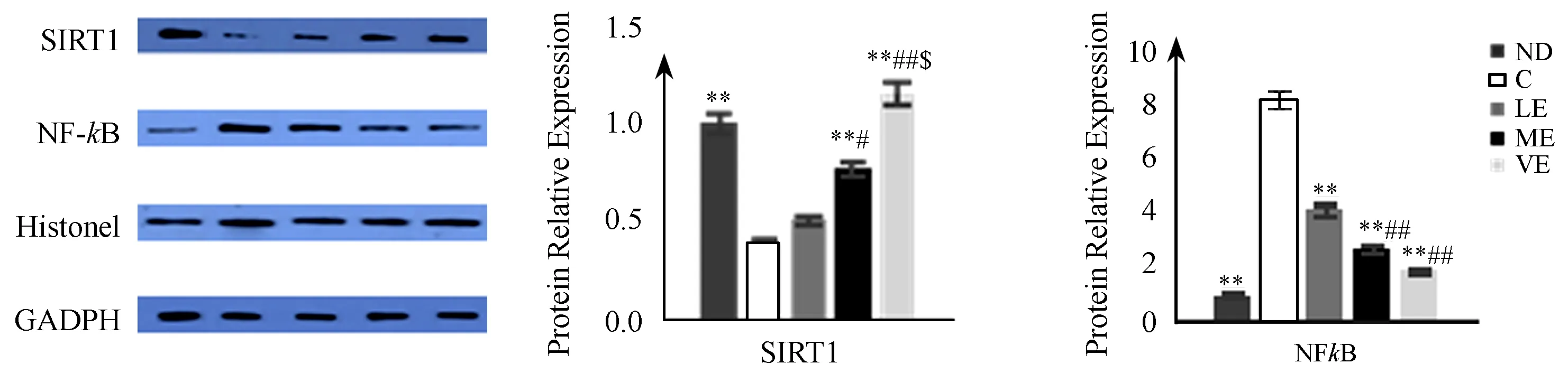
图 3 本研究不同强度有氧运动对肝组织SIRT1、核NF-κB蛋白表达的影响示意图
注:与C组相比,* P<0.05,** P<0.01;与LE组相比 # P<0.05;与ME组相比 $ P<0.05。
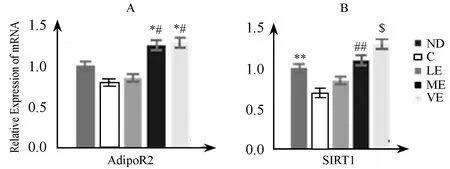
为初步确定不同强度有氧运动对NASH大鼠肝脏SIRT1轴影响的分子机制,本研究用大鼠血清孵育BRL-3A肝细胞48 h,观察对细胞SIRT1、AdipoR2mRNA表达的影响。结果显示,肝细胞AdipoR2mRNA表达上,LE血清孵育后BRL-3A细胞AdipoR2mRNA表达较C组血清孵育无显著性变化,而ME和IE血清孵育后AdipoR2mRNA表达较C和LE血清孵育有显著性增加(P<0.05);肝细胞SIRT1 mRNA表达上,C组血清孵育后BRL-3A肝细胞SIRT1 mRNA表达较ND组显著性减少(P<0.01),LE血清孵育与C组血清孵育比较无显著性差异,而ME和IE组血清孵育较C组和LE组血清孵育显著性增加(P<0.01),且IE组显著性高于ME组(P<0.05)。
2.6 肝组织石蜡切片HE染色结果
参照美国国立卫生研究院NASH临床研究网病理工作组指南,对实验各组大鼠进行常规NAS和肝纤维化分期[23,24],指南规定NAS(0~8分)包括3个方面:即肝细胞脂肪变性、小叶内炎症、肝细胞气球样变性。其中,肝细胞脂肪变性分为0分(<5%)、1分(5%~33%)、2分(34%~66%)、3分(>66%);小叶内炎症分为0分(无坏死灶)、1分(坏死灶个数<2个)、2分(坏死灶个数2~4个)、3分(坏死灶个数>4个);肝细胞气球样变性分为0分(无)、1分(少见)、2分(多见)。NAS<3分可排除NASH,为非酒精性脂肪肝(NAFL)阶段;NAS>4分即可诊断NASH;介于两者之间为NASH可疑。此外,肝纤维化分为5期,0期:无纤维化;1a期:肝腺泡3区轻度窦周纤维化,1b期:肝腺泡3区中度窦周纤维化,1c期:仅有门脉周围纤维化;2期:腺泡3区窦周纤维化合并门脉周围纤维化;3期:桥接纤维化;4期:高度可疑或确认肝硬化。光镜下,C组大鼠肝小叶内肝细胞索境界不清,弥漫性脂质空泡,且大小不等,肝细胞气球样变多见,大囊泡广泛分布,且肝小叶内坏死性灶较多,部分具有1a纤维化变,平均NAS为8分,结果说明,该组全部大鼠已进展至NASH阶段。光镜下,运动各组肝脂肪变性较C组减轻,且未见纤维化变。LE组肝细胞气球样变仍多见,5只大鼠肝小叶内有< 2个的坏死灶,2只大鼠肝小叶内有>4个的坏死灶,组平均NAS为5.4分,结果表明,LE组中7只大鼠已进展至NASH阶段,2只处于NASH可疑阶段;ME组肝细胞气球样变较C组和LE组显著性减少(P<0.05),仅3只大鼠肝小叶内可见<2个的坏死灶,组平均NAS为3.4分,结果显示,ME组中1只大鼠处于NAFL阶段,6只大鼠处于NASH可疑阶段,1只大鼠进展至NASH阶段;IE组肝细胞气球样变较C组和LE组显著性减少(P<0.01),仅2只大鼠肝小叶内可见< 2个的坏死灶,余者肝小叶内未见坏死灶,组平均NAS为2.8分,结果表明,该组有4只大鼠处于NAFL阶段,5只大鼠处于NASH可疑阶段。

图 5 本研究HE染色肝组织切片镜下图像图
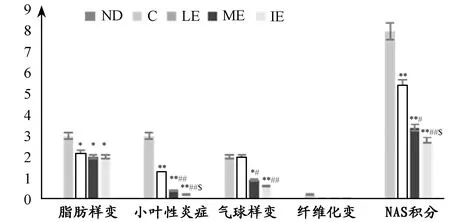
图 6 本研究实验各组肝组织病理学诊断示意图
2.7 IP/OP MRI对实验各组肝脂质含量的半定量检测结果
IP/OP MRI可对NAFLD大鼠肝脂质含量进行半定量分析[12],与肝组织HE染色切片的病理诊断相配合,能对肝脂质含量进行更为准确的半定量判断[6,8]。IP/OP MRI结果显示,运动各组FI系数较C组均显著性减少,ME、IE组FI系数显著性低于LE组(P<0.05);IE组低于ME组但无显著性差异。
3 讨论
有氧运动能减少肥胖小鼠血清ALT和肝组织脂肪沉积[37],并具有其他多种健康效应,如减体重、改善机体胰岛素抵抗等,故现在已将有氧运动作为治疗脂肪肝的主要手段之一。运动除通过减少体重而间接影响肝脏物质代谢外,也能直接影响肝细胞的生物学功能,如在OLETF大鼠实验中[44],运动可增加大鼠肝细胞脂肪酸氧化、减少细胞内新生的脂肪酸、抑制肝脏脂质沉积,改善细胞对胰岛素的敏感性。目前有关有氧运动是否能抑制NAFLD向NASH转化的研究较少[18],具体机制也不清楚。本研究中高脂各组经过10周60%高脂饲料喂养后,根据随机抽取的大鼠肝组织病理学诊断以及动态监测血ALT正常水平,综合判断高脂各组发生不同程度的单纯性肝脂肪变性,但尚未进入NASH阶段。实验结束时,根据各组HE切片的病理学诊断(确诊NASH的最主要手段)、异常的血ALT水平以及IP/OP MRI对肝脂质的半定量分析,确认C组已进入NASH阶段;而运动各组与C组相比较表明,6周不同强度有氧运动均显著抑制肝脂质沉积,减少大鼠NAS,并且ME、IE组与LE组相比,肝小叶性炎症和气球样变不同程度减轻,血ALT水平显著性减少,并且IE组表现更显著。结合运动各组体重无显著性差异的现象,研究者认为中等及较大强度有氧运动可抑制NAFLD大鼠肝炎性信号通路的转导,减轻肝小叶性炎症表现。

图 7 本研究实验各组肝脏IP/OP MRI影像图
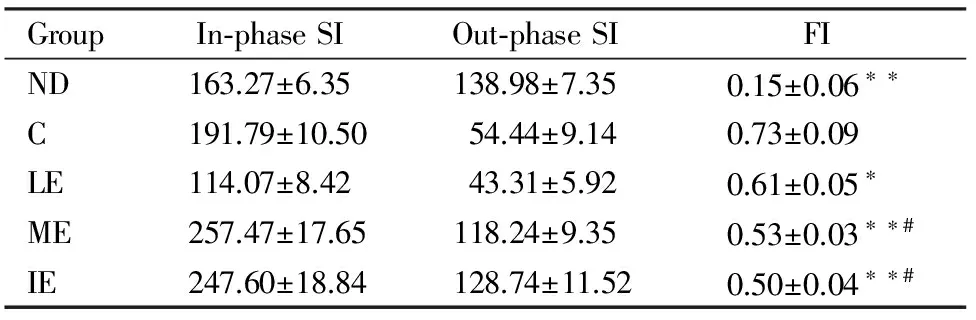
表 5 本研究IP/OP MRI正反相位信号强度及FI系数一览表

国外流行病学资料[30,31]表明,较大强度的有氧运动和疾病的致死率之间呈现显著的负相关性,如心血管疾病、结肠癌等,但目前国内尚未见相关报道。资料显示[50],有氧运动强度和临床心血管疾病的实验室数据之间呈现良好的一致性,而且男性较女性更明显,男性进行较大强度有氧运动可以比中等强度有氧运动更显著地减少心血管疾病的发生率,如冠心病[48]。临床病历的专家随访研究中[51],发现仅仅只有较大强度的有氧运动可以预防和减少心肌梗塞的发病率,而中等强度的有氧运动却没有预防效应。除了心血管疾病外,针对男性患者的长期追踪研究[33,34,58]表明,较大强度有氧运动可以减少多种病因所导致的致死率;现在针对女性患者的运动方案往往采用的是中等强度有氧运动,采用较大强度的研究报道[36]目前仍较少。所以,针对我国的目标人群来说,当前运动处方中经常采用的中等强度是否是最佳的选择?被认为可能有危险性的较大强度有氧运动,是否可以应用于相关疾病的辅助治疗的运动方案中,值得进一步深入研究。
通过评价不同强度有氧运动对脂肪肝细胞内SIRT1轴的影响,探讨小、中、较大强度有氧运动对脂肪肝细胞炎性状态以及炎性信号通路的影响,发现不同强度有氧运动对大鼠HWM脂联素影响的差异可能是导致有氧运动干预效果差异的重要原因之一,中等及较大强度有氧运动能促进HWM脂联素的分泌,促进肝细胞SIRT1表达和活性,SIRT1的去乙酰化作用抑制核NF-κB蛋白活性,从而改善肝组织氧化应激,减少炎性因子NCF1、MCP的生成,缓解大鼠脂肪肝炎的进展。本研究首次发现,较大强度运动可显著性抑制NAFLD大鼠肝组织转录因子NF-κB介导的炎性信号通路。
3.1 不同强度有氧运动对SIRT1-NF-κB-炎性因子信号通路的影响
本研究结果表明,中等以及较大强度运动能显著增加HMW脂联素水平、促进肝细胞SIRT1基因和蛋白表达,抑制核NF-κB活性及其下游炎性细胞因子生成,抑制大鼠脂肪性肝炎的发展。
各种动物模型NASH研究表明[11,14,20],在脂质沉积和氧化应激的“二次打击”作用下,肝实质细胞和非实质细胞的NF-κB激活和炎性因子的生成是炎性细胞聚集、诱导组织损伤的主要原因之一,NF-κB[25]被认为是NASH生成的关键调控因子。本研究中肝组织HE切片及活动度评分表明,C组大鼠发生了NASH,并且核NF-κB蛋白表达、炎性细胞因子MCP1、NCF2基因表达显著增加,表明肝组织内炎性信号NF-κB和炎性细胞因子通路的激活。研究表明[25],肝实质细胞内NF-κB激活是脂肪肝炎重要的始动因素;而非实质性细胞如Kupffer细胞NF-κB的激活对脂肪肝炎起放大作用。因此,抑制肝实质细胞内NF-κB激活,有利于阻止NAFLD向NASH转化。有研究[20]利用腺病毒转染IκBα来抑制大鼠NF-κB的表达,可显著阻止MCD饮食导致的脂肪性肝炎的生成,降低血清ALT、减轻肝小叶炎症。
肝细胞内SIRT1是NF-κB的上游调节因子,可去乙酰化NF-κB p65 Lys310残基,从而抑制NF-κB的反式激活能力[28,56,57];敲除SIRT1基因可导致非酒精性脂肪肝和肝炎的发生[42],而SIRT1的过表达可以抑制NF-κB转录因子及其下游炎性细胞因子的表达,抑制脂肪肝炎的生成[40],所以SIRT1已成为NAFLD和NASH重要的治疗靶点[17]。与众多研究相一致[3,16,21,42,54],本研究中高脂饮食下,C组大鼠肝细胞SIRT1表达显著性减少,核NF-κB 表达显著性增加。有氧运动可以促进肝组织SIRT1的表达[22],但本研究结果表明,小强度运动组肝细胞SIRT1基因表达虽较C组增加,但SIRT1蛋白表达与C组无显著性差异,并且核NF-κB蛋白表达以及NFR2、MCP1表达较C组无显著性减少,说明小强度有氧运动对NASH大鼠肝细胞SIRT1-NF-κB-炎性因子轴无显著性影响;ME、IE组肝细胞SIRT1基因和蛋白表达较C组均显著性增加,尤以IE组SIRT1蛋白和基因的表达最显著,SIRT1蛋白表达与运动强度之间表现为剂量依赖关系。所以,中等和较大强度有氧运动能显著激活肝细胞SIRT1轴,抑制肝细胞内NF-κB蛋白介导的炎性信号转导。
脂联素是脂肪细胞因子,骨骼肌也能参与分泌,它具有促进机体糖脂代谢、提高组织胰岛素敏感性等重要作用。哺乳动物血清脂联素一般以3种聚合形式存在,即三聚体(LMW)、六聚体(MMW)和多聚体(HMW)。研究表明[9,39],HMW脂联素水平可较好反映非酒精性脂肪肝程度,HMW脂联素对肝组织具有特异性作用[26]。Waki H等[55]发现,当脂联素分子氨基端Cys被Ser取代,分子内二硫键的形成被破坏,球形脂联素和全长形脂联素不能聚合成HMW脂联素,而缺少HMW的脂联素激活肝细胞SIRT1的能力被显著性抑制。运动能促进骨骼肌、脂肪组织分泌脂联素,增加组织脂联素受体的表达[19,43,45]。研究发现,NAFLD大鼠具有较低的血脂联素水平[38],而肝细胞SIRT1是脂联素受体的下游蛋白[49]。本研究结果表明,中等强度及以上的有氧运动可以促进NAFLD大鼠血HMW脂联素的增加,而较大强度的递增负荷运动效果最显著,也有研究报道,血清脂联素以及HMW脂联素与运动强度之间呈现剂量依赖关系[29,43]。综上所述,3组不同强度有氧运动下,大鼠脂肪肝细胞SIRT1表达和活性的差异和HMW脂联素水平密切有关。此外,如同饥饿和禁食[15,46],有氧运动导致肝组织内SIRT1活性的变化也与血糖水平等其他因素相关。
本研究细胞实验初步证明了有氧运动能促进大鼠肝细胞脂联素/SIRT1信号传导的作用。利用运动后ME和IE组大鼠血清孵育BRL-3A大鼠肝细胞后,AdipoR2和SIRT1mRNA表达增加,这与文献报道[49]相一致,说明:1)HMW脂联素与肝细胞SIRT1基因表达密切相关;2)HMW脂联素、AdipoR2、SIRT1之间可能存在着正反馈现象,促进肝细胞AdipoR2基因的表达[35]。此外,不同组别血清孵育BRL-3A细胞导致细胞AdipoR2、SIRT1mRNA表达的显著性差异可能也与血乳酸、瘦素等[27]其他因素的水平变化有关。图8总结了中等及较高强度有氧运动可能通过HMW脂联素-SIRT1轴抑制NF-κB介导的炎性信号转导、抑制脂肪性肝炎进展的机制。
3.2 不同强度有氧运动对肝细胞氧化应激的影响
目前有关不同强度的有氧运动对肝脏氧化应激的影响报道不尽一致,有的认为,运动强度的加大会增加肝细胞的凋亡百分率,袁海平等[7]发现不同强度运动后即刻大鼠肝细胞凋亡增加,而且大强度运动后肝细胞凋亡的百分率显著增大;陈伟等[1]发现大强度力竭运动后12 h肝细胞凋亡增加显著,且中等以上强度的力竭运动更易引起肝细胞凋亡;刘文峰等[4]发现,模拟4 000 m的高住低练对大鼠肝细胞凋亡的影响比单纯低氧暴露和常氧运动大,但同时也发现肝细胞增殖也呈增加趋势。也有相反的研究报道认为较大强度有氧运动能改善肝细胞的氧化应激水平,减少肝细胞凋亡水平。程丽彩等[2]研究发现,长期耐力运动可显著性减少大鼠肝细胞氧化应激水平,降低肝细胞凋亡率,认为长期的体育运动后肝脏出现了代偿性的适应;罗艳蕊等[5]研究6周的高脂饲料喂养后,大鼠肝Bax/Bcl-2显著性升高,大鼠肝细胞凋亡指数显著性增加,而6周无负重游泳运动可显著性降低大鼠肝细胞凋亡指数,中等强度游泳运动降低肝细胞凋亡率更显著。本研究也发现,6周有氧运动后,运动各组肝组织MDA显著性减少,SOD显著性增加,血ALT较C组均显著性减少,表明不同强度有氧运动均能改善脂肪肝组织氧化应激;各组之间肝功能酶ALT水平的差异表明,中等、较大强度运动比小强度运动在缓解氧化应激导致的肝功能损伤方面作用更显著。研究者认为,一次大强度或力竭性运动会促进肝组织的急性氧化应激,导致肝细胞凋亡增加;而长期适应性的中等或较大强度有氧运动可降低肝组织的氧化应激水平,减少肝细胞凋亡。
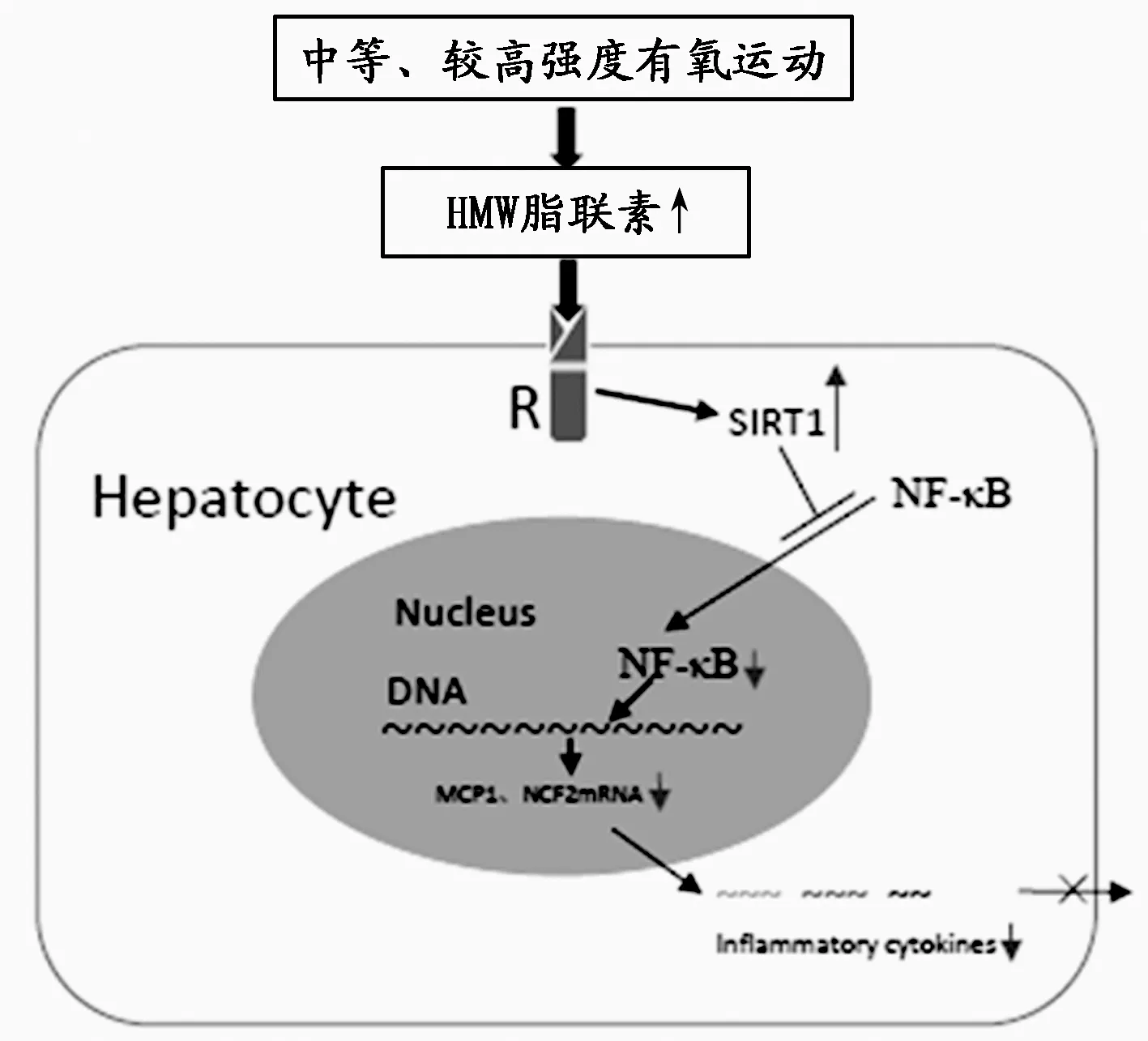
图 8 有氧运动抑制NAFLD大鼠肝细胞内NF-κB介导的炎性信号通路示意图
研究表明[52]转录因子PPARα促进SOD、过氧化物酶等抗氧化酶基因的表达,提高肝实质细胞抗氧化应激的能力。本研究中不同强度有氧运动均能显著增加PPARα基因表达,并且与运动强度之间有剂量依赖现象;SIRT1能去乙酰化PPARα,促进其活性增加[15],本研究中SIRT1与运动强度之间的剂量依赖现象,表明有氧运动也可能通过肝SIRT1轴调节NASH大鼠肝的抗氧化应激水平。由于小强度有氧运动对大鼠肝内SIRT1蛋白表达无显著性影响,所以小强度有氧运动可能通过其他通路调节肝抗氧化能力。有关不同强度有氧运动对NAFLD大鼠肝抗氧化能力的影响值得后续进一步深入研究。
4 小结
有氧运动能抑制因高脂饮食所导致的大鼠肝脂质沉积,降低NAFLD活动度评分,对NAFLD起着辅助治疗作用;较大强度有氧运动在抑制大鼠单纯性脂肪肝向脂肪肝炎转化的效果方面作用显著,其机制与激活肝细胞HMW脂联素/SIRT1/NF-κB信号通路,抑制炎性细胞因子的分泌,减少炎性细胞在肝组织的聚集,减轻炎性反应有关。
5 结论
本次动物实验说明,有氧运动的运动强度与NASH发病机制之间有着密切的联系,小强度有氧运动对抑制NASH形成的作用并不显著,而适应性的较大强度有氧运动可激活肝细胞SIRT1信号通路,从而抑制大鼠非酒精性脂肪肝炎的形成。本研究提示,针对不同性别、年龄、身体状况NAFLD患者的运动处方的制定中,较大运动强度的选择问题值得进一步深入研究。
[1]陈伟,樊新生,张廷妍,等.不同强度力竭运动大鼠运动后12 h肝细胞凋亡的研究[J].北京体育大学学报,2010,33(2):59-63.
[2]程丽彩,何玉秀.长期耐力运动对大鼠肝细胞自由基代谢、线粒体膜电位及细胞凋亡的影响[J].中国运动医学杂志,2008,(4):486-487,494.
[3]邓向群.SIRT1表达对大鼠胰岛β细胞凋亡及非酒精性脂肪肝病形成的影响[M].武汉:华中科技大学,2007.
[4]刘文锋,瞿树林,汤长发.模拟4 000 m高住低练对大鼠肝细胞凋亡与增殖的影响[J].体育科学,2008,28(5):50-55,73.
[5]罗艳蕊,王建设,梅涛,等.茶多酚及耐力运动对高脂膳食大鼠肝细胞凋亡的影响[J].体育科学,2011,31(8):46-52,71.
[6]阳宁静,宋彬,唐鹤菡,等.1H-MRS和MR双回波技术活体半定量评价酒精性与非酒精性脂肪肝大鼠模型[J].磁共振成像,2010,(3):208-213.
[7]袁海平,孙蓉,史仍飞,等.大鼠不同强度运动对肝细胞凋亡的影响[J].上海体育学院学报,2001,25(4):31-33,39.
[8]张平平.MRI定量诊断非酒精性脂肪肝的实验研究[M].广州:暨南大学,2013.
[9]ASO Y,YAMAMOTO R,WAKABAYASHI S,etal.Comparison of serum high-molecular weight (HMW) adiponectin with total adiponectin concentrations in type 2 diabetic patients with coronary artery disease using a novel enzyme-linked immunosorbent assay to detect HMW adiponectin[J].Diabetes,2006,55(7):1954-1960.
[10]BEDFORD T G,TIPTON C M,WILSON N C,etal.Maximum oxygen consumption of rats and its changes with various experimental procedures[J].J Appl Physiol,1979,47(6):1278-1283.
[11]BODEN G,SHE P,MOZZOLI M,etal.Free fatty acids produce insulin resistance and activate the proinflammatory nuclear factor-kappaB pathway in rat liver[J].Diabetes,2005,54(12):3458-3465.
[12]BORRA R J,SALO S,DEAN K,etal.Nonalcoholic fatty liver disease:Rapid evaluation of liver fat content with in-phase and out-of-phase MR imaging[J].Radiol,2009,250(1):130-136.
[13]BROWNING J D,HORTON J D.Molecular mediators of hepatic steatosis and liver injury[J].J Clin Invest,2004,114(2):147-152.
[14]CAI D,YUAN M,FRANTZ D F,etal.Local and systemic insulin resistance resulting from hepatic activation of IKK-β and NF-κB[J].Nat Med,2005,11(2):183-190.
[15]CHALKIADAKI A,GUARENTE L.Sirtuins mediate mammalian metabolic responses to nutrient availability[J].Nature Rev Endocrinol,2012,8(5):287-296.
[16]CHATURVEDI R K,CALINGASAN N Y,YANG L C,etal.Impairment of PGC-1α expression,neuropathology and hepatic steatosis in a transgenic mouse model of Huntington's disease following chronic energy deprivation[J].Hum Mol Genet,2010,19(16):3190-3205.
[17]COLAK Y,OZTURK O,SENATES E,etal.Sirt1 as a potential therapeutic target for treatment of nonalcoholic fatty liver disease[J].Med Sci Monit:Int Med J Experiment Clin Res,2011,17(5):HY5-9.
[18]CONJEEVARAM H S,TINIAKOS D G.Editorial:exercise for NAFLD:Does intensity matter[J].Am J Gastroenterol,2011,106(3):470-475.
[19]DAI Y,PANG J,GONG H,etal.Roles and tissue source of adiponectin involved in lifestyle modifications[J].J Gerontol Series A,Biologic Sci Med Sci,2013,68(2):117-128.
[20]DELA PENA A,LECLERCQ I,FIELD J,etal.NF-κB activation,rather than TNF,mediates hepatic inflammation in a murine dietary model of steatohepatitis[J].Gastroenterol,2005,129(5):1663-1674.
[21]DENG X Q,CHEN L L,LI N X.The expression of SIRT1 in nonalcoholic fatty liver disease induced by high-fat diet in rats[J].Liver Int:Official J Int Associat Study Liver,2007,27(5):708-715.
[22]E L,LU J,BURNS J M,etal.Effect of exercise on mouse liver and brain bioenergetic infrastructures[J].Exp Physiol,2013,98(1):207-219.
[23]FAN J G,JIA J D,LI Y M,etal.Guidelines for the diagnosis and management of nonalcoholic fatty liver disease:Update 2010[J].J Digest Diseases,2011,12(1):38-44.
[24]FARRELL G C,CHITTURI S,LAU G K,etal.Guidelines for the assessment and management of non-alcoholic fatty liver disease in the Asia-Pacific region:Executive summary[J].J Gastroenterol Hepatol,2007,22(6):775-777.
[25]FARRELL G C,VAN ROOYEN D,GAN L,etal.NASH is an inflammatory disorder:Pathogenic,prognostic and therapeutic implications[J].Gut Liver,2012,6(2):149-171.
[26]FINELLI C,TARANTINO G.What is the role of adiponectin in obesity related non-alcoholic fatty liver disease[J].World J Gastroenterol,2013,19(6):802-812.
[27]FUKUWATARI T,SHIBATA K,ISHIHARA K,etal.Elevation of blood NAD level after moderate exercise in young women and mice[J].J Nutr Sci Vitaminol (Tokyo),2001,47(2):177-179.
[28]GAO F,CHENG J,SHI T,etal.Neddylation of a breast cancer-associated protein recruits a class III histone deacetylase that represses NF-kappaB-dependent transcription[J].Nat Cell Biol,2006,8(10):1171-1177.
[29]GAREKANI E T,MOHEBBI H,KRAEMER R R,etal.Exercise training intensity/volume affects plasma and tissue adiponectin concentrations in the male rat[J].Peptides,2011,32(5):1008-1012.
[30]HASKELL W L,LEE I M,PATE R R,etal.Physical activity and public health:Updated recommendation for adults from the American college of sports medicine and the American heart association[J].Med Sci Sports Exe,2007,39(8):1423-1434.
[31]KESANIEMI Y K,DANFORTH E J R,JENSEN M D,etal.Dose-response issues concerning physical activity and health:An evidence-based symposium[J].Med Sci Sports Exe,2001,33(6 Suppl):S351-358.
[32]KRASNOFF J B,PAINTER P L,WALLACE J P,etal.Health-related fitness and physical activity in patients with nonalcoholic fatty liver disease[J].Hepatol,2008,47(4):1158-1166.
[33]LEE I M,HSIEH C C,PAFFENBARGER R S JR.Exercise intensity and longevity in men.The Harvard alumni health study[J].J Am Med Associat,1995,273(15):1179-1184.
[34]LEE I M,PAFFENBARGER R S JR.Associations of light,moderate,and vigorous intensity physical activity with longevity.The Harvard alumni health study[J].Am J Epidem,2000,151(3):293-299.
[35]LIANG X,HU M,ROGERS C Q,etal.Role of SIRT1-FOXO1 signaling in dietary saturated fat-dependent upregulation of liver adiponectin receptor 2 in ethanol-administered mice[J].Antioxidants Redox Signal,2011,15(2):425-435.
[36]MANSON J E,HU F B,RICH-EDWARDS J W,etal.A prospective study of walking as compared with vigorous exercise in the prevention of coronary heart disease in women[J].New England J Med,1999,341(9):650-658.
[37]MARQUES C M,MOTTA V F,TORRES T S,etal.Beneficial effects of exercise training (treadmill) on insulin resistance and nonalcoholic fatty liver disease in high-fat fed C57Bl/6 mice[J].Braz J Med Biol Res,2010,43(5):467-475.
[38]MOSCHEN A R,WIESER V,TILG H.Adiponectin:Key player in the adipose tissue-liver crosstalk[J].Curr Med Chem,2012,19(32):5467-5473.
[39]PAJVANI U B,HAWKINS M,COMBS T P,etal.Complex distribution,not absolute amount of adiponectin,correlates with thiazolidinedione-mediated improvement in insulin sensitivity[J].J Biol Chem,2004,279(13):12152-12162.
[40]PFLUGER P T,HERRANZ D,VELASCO-MIGUEL S,etal.SIRT1 protects against high-fat-diet induced metabolic damage[J].Proc Natl Acad Sci USA,2008,105(28):9793-9798.
[41]PROMRAT K,KLEINER D E,NIEMEIER H M,etal.Randomized controlled trial testing the effects of weight loss on nonalcoholic steatohepatitis[J].Hepatology,2010,51(1):121-129.
[42]PURUSHOTHAM A,SCHUG T T,XU Q,etal.Hepatocyte-specific deletion of SIRT1 alters fatty acid metabolism and results in hepatic steatosis and inflammation[J].Cell Metab,2009,9(4):327-338.
[43]RACIL G,BEN OUNIS O,HAMMOUDA O,etal.Effects of high vs.moderate exercise intensity during interval training on lipids and adiponectin levels in obese young females[J].Eur J Appl Physiol,2013,113(10):2531-2540.
[44]RECTOR R S,UPTERGROVE G M,MORRIS E M,etal.Daily exercise vs.caloric restriction for prevention of nonalcoholic fatty liver disease in the OLETF rat model[J].Am J Physiol-gastr L,2011,300(5):G874-G883.
[45]RING-DIMITRIOU S,PAULWEBER B,VON DUVILLARD S P,etal.The effect of physical activity and physical fitness on plasma adiponectin in adults with predisposition to metabolic syndrome[J].Eur J Appl Physiol,2006,98(5):472-481.
[46]RODGERS J T,LERIN C,HAAS W,etal.Nutrient control of glucose homeostasis through a complex of PGC-1α and SIRT1[J].Nature,2005,434(7029):113-118.
[47]SCHULTZ A,MENDONCA L S,AGUILA M B,etal.Swimming training beneficial effects in a mice model of nonalcoholic fatty liver disease[J].Exp Toxicol Pathol,2012,64(4):273-282.
[48]SESSO H D,PAFFENBARGER R S,JR.,LEE I M.Physical activity and coronary heart disease in men:The Harvard alumni health study[J].Circulat,2000,102(9):975-980.
[49]SHEN Z,LIANG X,ROGERS C Q,etal.Involvement of adiponectin-SIRT1-AMPK signaling in the protective action of rosiglitazone against alcoholic fatty liver in mice[J].Am J Physiol Gastrointestinal Liver Physiol,2010,298(3):G364-374.
[50]SWAIN D P,FRANKLIN B A.Comparison of cardioprotective benefits of vigorous versus moderate intensity aerobic exercise[J].Am J Cardiol,2006,97(1):141-147.
[51]TANASESCU M,LEITZMANN M F,RIMM E B,etal.Exercise type and intensity in relation to coronary heart disease in men[J].J Am Med Associa,2002,288(16):1994-2000.
[52]TOYAMA T,NAKAMURA H,HARANO Y,etal.PPARα ligands activate antioxidant enzymes and suppress hepatic fibrosis in rats[J].Biochem Biophys Res Commun,2004,324(2):697-704.
[53]US Department of Health and Human Services.Physical activity guidelines for Americans midcourse report:Strategies to increase physical activity among youth[EB/OL].[2014-05-30].http://www.health.gov/paguidelines/.html.
[54]VIOLLET B,FORETZ M,GUIGAS B,etal.Activation of AMP-activated protein kinase in the liver:A new strategy for the management of metabolic hepatic disorders[J].J Physiol,2006,574(Pt 1):41-53.
[55]WAKI H,YAMAUCHI T,KAMON J,etal.Impaired multimerization of human adiponectin mutants associated with diabetes.Molecular structure and multimer formation of adiponectin[J].J Biol Chem,2003,278(41):40352-40363.
[56]YANG S R,WRIGHT J,BAUTER M,etal.Sirtuin regulates cigarette smoke-induced proinflammatory mediator release via Rela/p65 NF-κB in macrophages in vitro and in rat lungs in vivo:Implications for chronic inflammation and aging[J].Am J Physiol Lung Cellular Molecul Physiol,2007,292(2):L567-576.
[57]YEUNG F,HOBERG J E,RAMSEY C S,etal.Modulation of NF-κB-dependent transcription and cell survival by the SIRT1 deacetylase[J].Embo J,2004,23(12):2369-2380.
[58]YU S,YARNELL J W,SWEETNAM P M,etal.What level of physical activity protects against premature cardiovascular death? The caerphilly study[J].Heart,2003,89(5):502-506.
DiscussiononEffectsofDifferentAerobicExerciseIntensitiesontheHepatitisofNAFLDRatsBasedontheSIRT1Axis
ZHAO Jun1,2,ZHAO Mei-qin3,SHI Chang-zheng4,CHEN Hong-hui2
Objective:To study how the aerobic exercise of different intensity has therapy effect on nonalcoholic steatohepatitis of rats model.Methods:Randomly divide the fifty Sprague Dawley rats into Normal Diets group (ND),High Fat Diet Control group (C),High Fat Diet Low Intensity Exercise group (LE),High Fat Diet Middle Intensity Exercise group (ME) and High Fat Diet Incremental intensity Exercise group (IE),10 rats in each group.The ND group is feed normal diet and the other groups are high fat diet for 16 weeks.Every exercise groups start to run on the animal treadmill since the 11th week during the experiment for 6 weeks.At the end of test,the rat’s abdominal aortic blood was to measure the level of ALT,blood fat and adiponectin,morphology of hepatic tissue was observed,the level of SOD,MDA in hepatocytes was assayed and the mRNA of SIRT1,MCP1,NCF2 was measured,and the fat content in liver was observed by PI/OP MRI,as well as the protein expression of SIRT1 and nuclear NF-κB in hepatocyte.Results:The nonalcoholic steatosis hepatitis and hepatic fibrosis was occured in the C group after 16 weeks high-fat feeding.However,three types of exercise intensity could ameliorate the lipid deposition and the state of oxidative stress in liver.Compared to the low intensity exercise,middle and incremental intensity exercise could significantly increase the level of serum HWM adiponectin and the protein expression of SIRT1 in hepatocyte,supress the protein expression of NF-κB in nucleus and its downstream such as MCP1 and NCF2mRNA expression in hepatocyte,so impede the occur of lobuler hepatitis.Conclusion:All three different intensities of aerobic exercise could supress the lipid accumulation in rats liver through weight reduction mechnism.Vigorous aerobic exercise profoundly restrain the transition of NAFLD to NASH of rats through SIRT1 signal transduction axis in hepatocyte,but low intensity of aerobic exercise couldn’t.
aerobicexercise;nonalcoholicsteatohepatitis;adiponectin;SIRT1;NF-κB
1000-677X(2014)11-0050-10
2014-06-01;
:2014-10-16
湖南省体育科学学会资助项目(KT13-011)。
赵军(1971-),男,湖北宜昌人,副教授,博士,主要研究方向为营养与运动生物化学,Tel:(020)85220282,E-mail:870835676@qq.com。
1.暨南大学 生物医学工程博士后流动站,广东 广州 310630;2.暨南大学 体育部,广东 广州 310630;3.武汉西藏中学,湖北 武汉 430083;4.暨南大学 第一附属医院,广东 广州 310630 1.Biology Medical Engineering Postdoctoral Research Station,Jinan University,Guangzhou 510630,China;2.Jinan University,Guangzhou 510630,China;3.Tibet Middle School,Wuhan 430083,China;4.The First Affiliated Hospital of Jinan University,Guangzhou 510630,China.
G804.7
:A
