螺内酯诱导人急性白血病细胞Jurkat凋亡的作用研究
2014-07-18韩莲花朱华亭夏永洁邱玉华
韩莲花,蔡 磊,朱 莹,朱华亭,夏永洁,邱玉华
螺内酯诱导人急性白血病细胞Jurkat凋亡的作用研究
韩莲花,蔡 磊,朱 莹,朱华亭,夏永洁,邱玉华*
目的 研究螺内酯对人急性白血病细胞Jurkat体外增殖的抑制及诱导凋亡的作用。方法 将终浓度分别是10、50及100 μmol/L的螺内酯加入Jurkat细胞的培养体系中,24 h内每隔4 h通过 MTT法分析Jurkat细胞的增殖抑制率,Annexin V/PI流式细胞术法分析Jurkat细胞的早期凋亡率。结果 螺内酯与Jurkat细胞共同培养12 h后,螺内酯能显著增加对细胞的增殖抑制作用,并且与药物浓度成正相关,各浓度组的抑制率随着培养时间的延长而升高,与药物干预时间成正相关;螺内酯处理Jurkat细胞24 h,各浓度组诱导细胞凋亡率分别为:10 μmol/L组(11.2±0.35)%、50 μmol/L组(29.8±1.27)%及100 μmol/L(56.5±1.41)%,各个浓度组诱导细胞凋亡率与药物浓度成正相关。结论 螺内酯对人T淋巴细胞白血病Jurkat细胞具有抑制增殖和诱导凋亡的作用,提示该药可能具有潜在抑瘤作用。
螺内酯;Jurkat;增殖抑制;细胞凋亡
0 引言
螺内酯(Spironolactone)是一种临床上常用的醛固酮拮抗剂,主要用于治疗与醛固酮升高有关的顽固性水肿、高血压及原发性醛固酮增多症等疾病。它通过结合胞浆内的盐皮质激素受体而作为醛固酮的拮抗剂发挥药理作用[1]。主要作用于肾脏远曲小管和集合管,通过阻断Na+-K+和Na+-H+的交换,使Na+、Cl-和水排泄增多,K+、Mg2+和H+排泄减少,有较强的利尿作用,故该药在心力衰竭患者的治疗中也起着重要的作用[2]。
近年来随着研究的不断深入,研究者发现了螺内酯新的作用。Mikkelsen等[3]报道螺内酯能诱导人体外周血单个核细胞凋亡,并且影响其细胞因子的分泌。这为肿瘤的治疗提供了新的思路。本研究以人T淋巴细胞白血病细胞株Jurkat为对象,分析螺内酯对肿瘤细胞生长与增殖的影响,以期为临床治疗提供参考。
1 材料与方法
1.1 主要试剂与仪器 Jurkat细胞由本实验室保存;螺内酯购自Sigma公司;Annexin V-FITC/PI试剂盒(invitrogen公司);RPMI 1640(GIBCO公司);胎牛血清(GIBCO公司);MTT、DMSO(Sigma公司);550型酶联免疫检测仪(Bio-Rad公司);流式细胞仪(Beckman公司)。
1.2 方法
1.2.1 细胞株的培养 取本实验室保存的Jurkat细胞株,常规复苏后,RPMI 1640培养液添加10%胎牛血清,于37 ℃、5% CO2、饱和适度的培养箱培养,2~3 d传代1次。观察细胞生长情况,取对数生长期细胞用于实验。
1.2.2 螺内酯对Jurkat细胞增殖抑制作用的分析 取生长状态良好的Jurkat细胞,调整细胞浓度至2×106/mL,接种于96孔板,200 μL/孔,设置3个复孔。各实验组加入螺内酯溶液,使其终浓度分别为10、50及100 μmol/L。另设不加药的对照组,分别于37 ℃、5% CO2培养箱中培养。培养时间为4、8、12、16、20及24 h。培养终止前4 h,加入20 μL MTT溶液(5 mg/mL),继续孵育4 h,离心后吸弃孔板内培养上清液。加入DMSO 150 μL,微量振荡器上振荡摇匀,使结晶充分溶解。酶标仪检测吸光度值(A570),并计算增殖抑制率[4]。
细胞增殖抑制率=(A对照组-A实验组)/A对照组×100%
1.2.3 螺内酯对Jurkat细胞诱导凋亡作用的分析 用含10%胎牛血清RPMI 1640调整细胞浓度至2×105/mL,接种于6孔板,2 mL/孔。加入螺内酯溶液,使终浓度分别为10、50及100 μmol/L,并设不加药的对照组,于37 ℃、5% CO2培养箱中培养24 h。收集细胞,用冷PBS洗涤2次后,将细胞重悬于100 μL缓冲液,转移至流式管中。加入Annexin V-FITC 5 μL和PI 1μL,室温避光孵育15 min,孵育过后,加入400 μL缓冲液,流式细胞仪检测细胞早期凋亡率[5]。
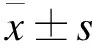
2 结果
2.1 螺内酯对Jurkat细胞增殖抑制作用 螺内酯与Jurkat细胞共同培养4 h和8 h时,各浓度组对细胞的增殖抑制作用并不显著,各浓度组之间差异无统计学意义(P>0.05)。共同培养12、16、20及24 h时,各浓度组对细胞增殖均呈现明显的抑制作用,且同一个时间点各浓度组间抑制率差异均有统计学意义(P<0.05)(见表1)。螺内酯与Jurkat细胞共同培养12 h后,对细胞的增殖抑制作用呈现明显的对药物浓度和干预时间的依赖性(见图1)。
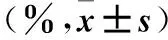
表1 螺内酯对Jurkat细胞增殖抑制率的影响
注:与对照组比较,*P<0.05
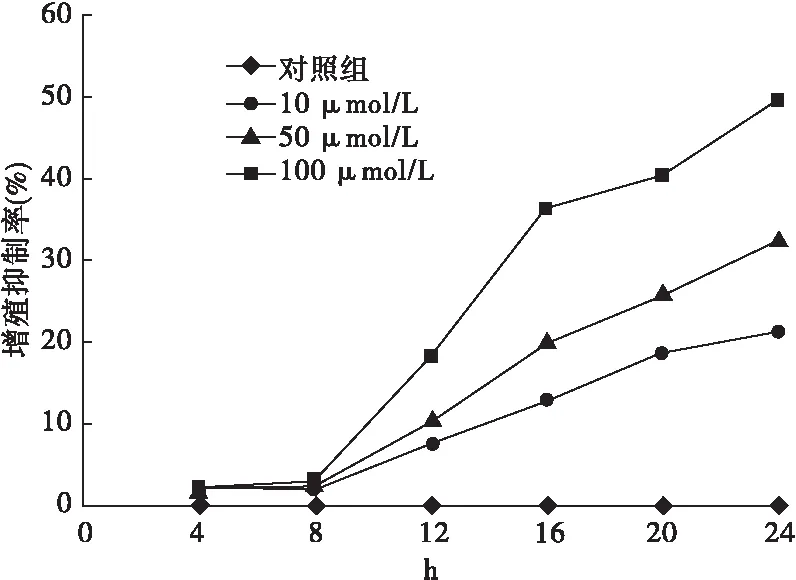
图1 不同浓度螺内酯在各干预时间点对Jurkat细胞的增殖抑制作用
2.2 螺内酯对Jurkat细胞诱导凋亡作用 螺内酯处理细胞24 h,对照组与10、50及100 μmol/L各浓度组诱导Jurkat细胞早期凋亡率分别为(2.9±0.23)%、(11.2±0.35)%、(29.8±1.27)%及(56.5±1.41)%,凋亡率呈现明显的药物浓度依赖性(见图2)。
3 讨论
螺内酯与盐皮质激素受体结合而作为醛固酮的拮抗剂发挥药理作用,对抗高血压、醛固酮增多症等,在临床上已经使用了近40年,对其药理作用机制已较清晰[6]。近年来临床与基础方面的研究又发现了一些关于螺内酯与盐皮质激素受体结合之外的其他作用。临床研究报道,螺内酯还具有提高充血性心衰患者的生存期,改善内皮功能等作用[7-8]。基础研究方面,有研究发现,螺内酯诱导人体外周血单个核细胞凋亡,并且影响其细胞因子的生成。人体外周血单个核细胞与100 μmol/L的螺内酯共培养后,抑制了细胞因子TNF-α的生成,却增加了IL-1β的生成,并初步猜测凋亡的发生可能与IL-1β的增多有关。Soren等发现,螺内酯诱导人体外周血单个核细胞凋亡的机制可能是通过抑制NF-кB这个转录因子而起作用,并且这种作用不依赖于盐皮质激素受体[9-10]。他们在实验中发现,螺内酯影响很多与炎症因子和凋亡过程的相关基因,当人体外周血单个核细胞和不同浓度螺内酯共同培养后,caspase-3的活性增强,而NF-кB的活性降低,初步认为螺内酯可能是通过抑制NF-кB的活性而诱导人体外周血单个核细胞凋亡[10]。
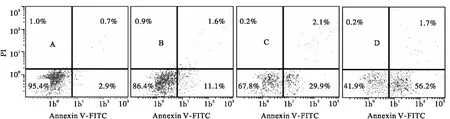
A:对照组,B:10 μmol/L组,C:50 μmol/L组,D:100 μmol/L组
为了探讨螺内酯对某些肿瘤细胞是否也有诱导凋亡的作用,本研究选择了Jurkat细胞作为研究对象,通过两种方法来分析不同浓度螺内酯和Jurkat细胞共同培养后对该细胞的作用。首先通过MTT法分析不同浓度螺内酯在各个时间点对Jurkat细胞的增殖抑制作用。在4 h和8 h的培养时间点,螺内酯对Jurkat细胞的增殖抑制作用并不显著,从12 h开始,不同浓度的螺内酯对Jurkat细胞产生了显著的增殖抑制作用,并且其作用呈现药物浓度和干预时间的依赖性。其次,通过Annexin V/PI流式细胞术法分析螺内酯诱导Jurkat细胞凋亡的作用。根据MTT的结果,我们选择了24 h作为研究早期凋亡的时间点,分析不同浓度螺内酯诱导Jurkat细胞凋亡的作用。发现最小浓度10 μmol/L螺内酯对Jurkat细胞就已经有诱导凋亡的作用,并且药物干预浓度越高,其诱导凋亡的作用越强,存在明显的浓度依赖性。在研究中由于螺内酯的溶解度问题,我们没能选择更高浓度来分析。
本研究通过观察螺内酯诱导Jurkat细胞的调亡情况,说明螺内酯可能对某些血液肿瘤细胞也有诱导凋亡的作用,接下来我们还会选择其他的肿瘤细胞作为研究对象,更深入地研究螺内酯诱导凋亡的作用。而本实验中诱导Jurkat细胞凋亡的具体机制,我们也将从NF-кB途径开始作下一步研究。
总之,螺内酯对人T淋巴细胞白血病Jurkat细胞有诱导凋亡作用,体外诱导凋亡的剂量亦较低,提示该药可能存在潜在的抑瘤作用,对于我们寻求改善淋巴细胞白血病的方法也具有潜在的价值。
[1] Jankowski A,Skorek-Jankowska A,Lamparczyk H.Simultaneous determination of spironolatone and its metabolites in human plasma[J].J Pharm Biomed Anal,1996,14(8-10):1359-1365.
[2] 程远植.醛固酮拮抗剂螺内酯在慢性心力衰竭治疗中的作用机制和应用进展[J].中华心血管病杂志,2003,31(1):69-71.
[3] Mikkelsen M,Sφnder SU,Nersting J,et al.Spironolactone induces apoptosis in human mononuclear cells.Association between apoptosis and cytokine suppression[J].Apoptosis,2006,11(4):573-579.
[4] 王艳茹,马泓冰,陈永井,等.CD80人-鼠嵌合抗体对B淋巴瘤细胞株Raji与Daudi的生长抑制及杀伤作用[J].细胞与分子免疫学杂志,2009,25(7):615-618.
[5] 刘玉华,孙杰,陈明心,等.B7-2基因工程抗体的制备及体内外抗B淋巴瘤作用研究[J].中山大学学报(自然科学版),2010,49(3):108-112.
[6] Garthwaite SM,McMahon EG.The evolution of aldosterone antagonists[J].Mol Cell Endocrinol,2004,217(1-2):27-31.
[7] Pitt B,Zannad F,Remme WJ,et al.The effect of spironolactone on morbidity and mortality in patients with severe heart failure.Randomized Aldactone Evaluation Study Investigators[J].N Engl J Med,1999,341(10):709-17.
[8] 惠丽超,邱刚.螺内酯治疗慢性心力衰竭的临床观察[J].中国实用医药,2010,5(2):156-157.
[9] S∅nder SU,Woetmann A,Odum N,et al.Spironolactone induces apoptosis and inhibits NF-kappaB independent of the mineralocorticoid receptor[J].Apoptosis,2006,11(12):2159-2165.
[10]S∅nder SU,Mikkelsen M,Rieneck K,et al.Effects of spironolactone on human blood mononuclear cells:mineralocorticoid receptor independent effects on gene expression and late apoptosis induction[J].Br J Pharmacol,2006,148(1):46-53.
Study on apoptosis of human T-acute lymphoblastic leukemia cells lines Jurkat treated with spironolactone
HAN Lian-hua,CAI Lei,ZHU Ying,ZHU Hua-ting,XIA Yong-jie,QIU Yu-hua
(Department of Immunology,Medical College,Soochow University,Suzhou 215123,China)
Objective To study the proliferated inhibition and apoptosis of human T-acute lymphoblastic leukemia cells lines Jurkat treated with spironolactone.Methods Jurkat cells were treated with different concentrations of spironolactone (10,50,100 μmol/L) in culture.MTT assay was used to observe the proliferated inhibition rate of Jurkat at 4 hours interval and the flow cytometry was applied to analyze Annexin V/PI apoptosis rate of Jurkat.Results 12 hours after treatment,spironolactone could obviously inhibit the proliferation of Jurkat and the effect had dose and treated time dependence.24 hours after treatment,apoptosis of these concentrations were(11.2±0.35)%,(29.8±1.27)%,(56.5±1.41)%,and the apoptosis rate increased in dose dependence.Conclusion Spironolactone can inhibit the proliferation and induce apoptosis of Jurkat,it suggests that this medicine may have the effect of tumor inhibition.
Spironolactone;Jurkat;Proliferated inhibition;Cell apoptosis
2013-10-25
苏州大学医学部免疫学系,苏州 215123
江苏省普通高校研究生科研创新计划(CXLX12_0821)
*通信作者
