灵芝孢子粉对帕金森病大鼠氧化应激反应和神经炎症反应的影响
2014-07-18鲍琛
鲍 琛
灵芝孢子粉对帕金森病大鼠氧化应激反应和神经炎症反应的影响
鲍 琛
目的 研究灵芝孢子粉对帕金森病(PD)模型大鼠的氧化应激反应和神经炎症反应的影响,探讨灵芝孢子粉治疗帕金森病的潜在作用机制。方法 采用脑内定位注射6-羟基多巴胺(6-OHDA)建立PD大鼠模型,在模型建立成功后给予灵芝孢子粉治疗(25 g/kg)。给药30 d后,测定大鼠脑组织中丙二醛(MDA)、谷胱甘肽(GSH)、一氧化氮(NO)和α-肿瘤坏死因子(TNF-α)的含量,以及超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活力。结果 灵芝孢子粉治疗组可明显降低PD模型大鼠脑组织中MDA、NO和TNF-α含量,增加GSH 含量,提高SOD、GSH-PX的活性。结论 灵芝孢子粉对PD模型大鼠具有保护作用,其机制可能与灵芝孢子粉减轻6-OHDA 所致的氧化应激损伤和神经炎症反应有关。
灵芝孢子粉;帕金森病;大鼠;氧化应激;神经炎症
0 引言
灵芝孢子(Ganodermalucidiumspore)是灵芝生长成熟期从菌盖弹射出来极其细小的孢子,为灵芝的生殖细胞,具有灵芝的全部遗传活性物质,其药用价值日益受到重视。现代药理研究表明,灵芝孢子粉具有许多药理作用,包括抗肿瘤、增加免疫调节、抗病毒、抗炎、清除自由基等[1-2]。帕金森病(Parkinson′s disease,PD)是一种以黑质纹状体通路的退变为主要特征的神经系统变性疾病。迄今为止,PD的治疗仍为对症治疗,无法阻止疾病进展[3-5]。以往的研究发现,灵芝孢子粉对PD模型大鼠具有一定的脑保护作用[6-9]。本实验我们观察了灵芝孢子粉对PD大鼠的氧化应激反应和神经炎症反应的影响,旨在揭示灵芝孢子粉治疗PD的潜在作用机制。
1 材料与方法
1.1 材料
1.1.1 试药 灵芝孢子粉(元芝堂灵芝科技有限公司);盐酸氯胺酮注射液(北京双鹤药业股份有限公司,0.1 g:2 mL);6-羟基多巴胺(6-OHDA)购自美国Sigma公司;丙二醛(MDA)、谷胱甘肽(GSH)、谷胱甘肽过氧化物酶(GSH-Px)和超氧化物歧化酶(SOD)试剂盒均由南京建成生物工程研究所提供;一氧化氮(NO)及α-肿瘤坏死因子(TNF-α)试剂盒由北京中杉生物技术有限公司提供。
1.1.2 动物 健康Wistar雄性大鼠40只,体重195~210 g,由浙江省医学科学院动物中心提供,动物合格证号:SCXK(浙)2003-0001。实验室环境:温度,25 ℃,相对湿度,40%~70%;动物照度:15~20 LUX;垫料为消毒垫料,笼具用过氧乙酸消毒后使用,饮用纯净水。
1.2 方法
1.2.1 帕金森病大鼠模型的制备 30只大鼠用盐酸氯胺酮(80 mg/kg)腹腔注射麻醉。然后将大鼠固定于脑立体定位仪上,头部去毛,用活力碘常规消毒。无菌条件,沿正中线切开大鼠颅顶皮肤,剥离骨膜,暴露前囟。以前囟为准,根据大鼠脑立体定位图谱确定右侧黑质纹状体区坐标:(1)前囟后5.2 mm,正中线右侧1.0 mm,硬膜下9.0 mm。(2)前囟后5.2 mm,正中线右侧2.5 mm,硬膜下8.5 mm[10]。用颅骨钻小心钻开颅骨,微量进样器缓慢注入4 μL的6-OHDA(溶于含0.02%的抗坏血酸生理盐水,浓度为2 μg/μL),注射速度为0.8 μL/min,术毕留针5 min,退针速度1 mm/min,手术完成后取医用海绵填塞颅骨孔,缝合切口皮肤,活力碘消毒。术后2周用盐酸去水吗啡(0.5 mg/kg)诱导大鼠对侧旋转行为,计数30 min内大鼠向左侧旋转的圈数,总旋转圈数大于210圈为造模成功。
1.2.2 实验动物分组及处理 挑选造模成功的20只PD大鼠随机分为2组,记为模型组(6-OHDA,10只)和灵芝孢子粉治疗组(25 g/kg,10只),另纳入10只正常大鼠为正常对照组。以灌胃的方式给予治疗组大鼠灵芝孢子粉,每天1次,给药体积2 mL,连续30 d,同时正常组和模型组灌胃给予等量生理盐水。各组大鼠在给药30 d后,腹腔注射盐酸去水吗啡(0.5 mg/kg),诱发大鼠向左侧旋转,记录30 min内的旋转次数。
1.2.3 大鼠脑组织匀浆的制备 在给药30 d行为学检测结束后,所有动物麻醉并快速断头处死,在冰皿上迅速分离双侧脑组织,取脑组织块约0.3~0.4 g,在4 ℃的生理盐水中漂洗,除去血液,滤纸拭干,电子天平称重,再加入4 ℃生理盐水后匀浆。将匀浆液以4 000 r/min离心15 min。将上清液置-80 ℃冰箱中备用。
1.2.4 脑组织氧化应激水平测定 取适量上清液进行MDA、GSH、GSH-Px和SOD的检测,具体方法按南京建成生物工程研究所试剂盒说明书步骤进行测试。
1.2.5 脑组织炎症因子水平测定 取适量上清液进行NO及TNF-α的检测,具体方法按北京中杉生物技术有限公司试剂盒说明书步骤进行测试。

2 结果
2.1 对大鼠旋转行为的影响 正常对照组在治疗前后均未出现旋转行为。模型对照组在治疗前后30 min的旋转圈数分别为(297.33±28.45)次和(300.78±34.28)次,差异无统计学意义。灵芝孢子粉治疗组在治疗前后30 min的旋转圈数分别为(298.26±31.67)次和(233.16±17.45)次,经过治疗后旋转圈数明显减少(P<0.05)。
2.2 灵芝孢子粉对PD大鼠脑组织氧化应激水平的影响 与正常对照组相比,模型组大鼠大脑皮质MDA含量显著增加(P<0.01),GSH、GSH-Px、SOD的含量显著减少(P<0.01)。与模型组相比,灵芝孢子粉给药组MDA的含量显著减少(P<0.01),GSH,GSH-Px和SOD水平均显著增加(P<0.05或0.01)。见表1。
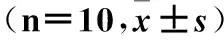
表1 灵芝孢子粉对PD大鼠脑组织MDA、GSH、GSH-Px和SOD的影响
注:与正常组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01
2.3 灵芝孢子粉对PD大鼠脑组织炎症因子水平的影响 与正常对照组相比,模型组大鼠大脑皮质NO和TNF-α含量显著增加(P<0.01)。与模型组相比,灵芝孢子粉给药组NO和TNF-α含量显著减少(P<0.01)。见表2。
3 讨论
6-OHDA是儿茶酚胺的羟基化衍生物,其结构与儿茶酚胺类似,内源性6-OHDA可能由过量Fe3+诱发产生,外源性给予6-OHDA被多巴胺(DA)能神经元摄入后,可产生大量自由基,抑制线粒体呼吸链的功能,最终导致DA能神经元死亡[11]。作为一种有效导致DA能神经元变性的神经毒剂,6-OHDA PD模型是目前常用的方法,已广泛应用于PD发病机制和治疗方法的研究[12]。
以往的研究发现,灵芝孢子粉对脂多糖(LPS)所致的多巴胺能神经元变性起到一定的神经保护作用[6],能够提高PD模型大鼠脑黑质酪氨酸羟化酶(TH)的表达[7],逆转PD模型大鼠黑质、纹状体神经递质DA、3,4-双羟苯乙酸(DOPAC)、高香草酸(HAV)、5-羟色胺(5-TH)、去甲肾上腺素(NE)含量的下降[8],降低caspase-3的表达[9],对PD大鼠有脑保护作用。本实验我们采用6-OHDA制备PD大鼠模型,观察灵芝孢子粉对PD大鼠的氧化应激反应和神经炎症反应的影响。
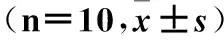
表2 灵芝孢子粉对PD大鼠脑组织NO和TNF-α的影响
注:正常组比较,*P<0.01;与模型组比较,#P<0.01
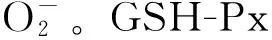
虽然PD的发病原因尚未完全清楚,但已有多项研究认为免疫炎性机制可能参与了PD神经变性的发病过程[14]。中枢神经系统中的小胶质细胞是脑内免疫反应的抗原递呈细胞和主要的免疫效应细胞,正常情况下,脑内的小胶质细胞处于静止状态。在PD发病过程中,小胶质细胞被异常激活,它的作用除了吞噬清除变性死亡的神经元外,还分泌促炎因子和神经营养因子,如NO和TNF-α。NO是一种具有广泛生物学效应的小分子化合物,在脑内几乎所有的神经细胞都具有合成NO的能力,但过量的NO会表现出其神经毒性,引起细胞损伤。TNF-α是目前公认的在免疫反应与细胞凋亡中发挥重要作用的一种细胞因子。研究发现,PD患者及其动物模型中TNF-α的含量升高,另外在对PD中TNF-α抗体和受体以及干预性应用TNF-α对DA能神经元影响的研究发现,TNF-α在PD发病中起到破坏性作用[15]。本实验研究结果表明,灵芝孢子粉对PD大鼠治疗后,大鼠脑组织中NO和TNF-α的含量明显降低,提示灵芝孢子粉可能通过降低脑内NO及细胞因子TNF-α水平,以保护神经元免受损伤而有效治疗PD。
[1] 王培珍.灵芝的药理作用与临床应用进展[J].上海医药,2012,33(9):28-30.
[2] 陈宝田,龙亚秋,李华,等.灵芝孢子粉的药理作用研究进展[J].中国药房,2010,21(15):1439-1440.
[3] 田明秀,张志清,解洪荣,等.帕金森病发病机制的研究进展[J].中国老年学杂志,2012,32(16):3597-3601.
[4] 熊珮,陈忻,张楠.帕金森病病理机制及中药防治帕金森病实验研究进展[J].中国中药杂志,2012,37(5):686-691.
[5] 李佳青,李文妍,银金兰.治疗帕金森病药物的研究进展[J].中国临床医生,2012,40(12):24-26.
[6] 杨海华,徐评议,刘焯霖,等.灵芝孢子粉对脂多糖诱导多巴胺能神经元变性的影响[J].中国神经精神疾病杂志,2006,32(3):262-264.
[7] 谢安木,刘焯霖,朱蔚文,等.灵芝孢子粉对帕金森病模型鼠黑质酪氨酸羟化酶的影响[J].中华神经科杂志,2005,38(6):355-358.
[8] 谢安木,薛莉,刘敏.灵芝孢子粉对帕金森病黑质神经递质影响的实验研究[J].热带医学杂志,2007,7(11):1091-1093.
[9] 谢安木,薛莉,刘焯霖.灵芝孢子粉对帕金森病黑质神经细胞caspase-3影响的实验研究[J].中国临床神经科学,2008,16(6):601-605.
[10]包新民,舒思云.大鼠脑立体定位图谱[M].北京:人民卫生出版社,1991:53.
[11]闫明俞,陈虹.不同脑区注射6-羟基多巴胺制备帕金森病动物模型的方法[J].药学实践杂志,2009,27(1):1-3.
[12]徐焱,郑祝剑,于海胜,等.6-OHDA诱导帕金森病模型的作用机制研究进展[J].中外健康文摘,2010,7(1):73-74.
[13]刘俊鹏.帕金森病氧化应激发病机制研究新进展[J].新疆医科大学学报,2013,36(3):292-295.
[14]张丽,董靖德,鲁明,等.炎症反应在帕金森病中的研究进展[J].中国临床神经科学,2013,21(2):223-225.
[15]冯飞阳,陈施艳,张志坚,等.TNF-α、IL-6在6-OHDA诱导帕金森病大鼠脑中的改变[J].福建医科大学学报,2012,46(5):315-318.
Effect ofGanodermalucidiumsporeon oxidative stress and inflammatory responses in rats with parkinson′s disease
BAO Chen
(The First Hospital of Ninghai,Zhejiang 315600,China)
Objective To observe the effects ofGanodermalucidiumsporeon oxidative stress and inflammatory responses in rats with Parkinson′s disease (PD).Methods The PD model rats were induced by injecting 6-hydroxydopamine (6-OHDA) into the right striatum.Ganodermalucidiumspore(25 g/kg) was given orally once daily for 30 days.The contents of malondialdehyde (MDA),glutathione (GSH),nitric oxide (NO),tumor necrosis factor-α (TNF-α),and the activity of superoxide dismutase (SOD),glutathione-peroxidase (GSH-PX) in the brain tissues were detected respectively.Results After treatment,Ganodermalucidiumsporecan decrease the levels of MDA,NO and TNF-α obviously,and increase significantly the activity of SOD,GSH-PX and the content of GSH (P<0.05 or 0.01).Conclusion The protective effect ofGanodermalucidiumsporeagainst 6-OHDA-induced brain injury of PD model rats may rely on its ability to reduce oxidative stress and suppress inflammatory responses.
Ganodermalucidiumspore;Parkinson′s disease;Rats;Oxidative stress;Inflammatory responses
2013-06-26
宁海县第一医院,浙江 宁海315600
