偏头痛发生机制的神经影像学研究进展
2014-07-18于生元陈小燕
于生元,陈小燕
专家论坛
偏头痛发生机制的神经影像学研究进展
于生元,陈小燕
偏头痛;功能神经影像学
偏头痛是最常见的神经内科疾病之一,我国患病率为9.3%[1]。由于偏头痛具有疼痛程度较重、易导致失能、有慢性化趋势的特点,因而严重影响患者生活和工作质量,造成极大的心理负担。神经影像学的发展在深入了解偏头痛的发生和发展机制中发挥了巨大作用,它不仅能发现偏头痛存在某些脑区功能的异常,还存在灰质和白质结构的改变及神经化学的变化,甚至可能对诊断和治疗评估有指导作用。为此,笔者主要探讨偏头痛先兆和发作期的功能神经影像学表现,从而为揭示偏头痛的发生机制提供参考。
1 偏头痛先兆期
大约1/4偏头痛患者头痛发作前有先兆症状,持续5~60 min,先兆症状主要有视觉症状、偏身感觉障碍、构音障碍及运动障碍等。一直以来,皮质扩布抑制(cortical spreading depression,CSD)学说被认为是偏头痛先兆的主要发生机制。CSD是神经元和胶质细胞去极化及紧随的超极化形成的速度为3~5 mm/min的扩布性慢波,实验显示CSD可能通过基质金属蛋白酶激活三叉神经血管系统,导致血管渗透性增加,血流改变,短暂血流减慢后出现持续数分钟的高灌注,随后是更久的低灌注[3,4]。
先兆期的功能影像学高度支持CSD假说的理论。Cutrer等[4]对4例患者在自发视觉先兆发作45 min内,采用磁共振灌注成像显示,视野缺损对侧的枕叶皮质局部血流量减少16%~53%,血容量减少6%~33%。Hadjikhani等[5]使用fMRI对3例视觉先兆偏头痛患者在先兆症状刚发作或发作20 min内进行脑部扫描,发现具有显著CSD特征的缓慢扩布信号,从纹外视皮质开始,以每分钟3~5 mm的速度扩散,经过枕叶,与视觉感知的视皮质的视网膜拓扑映射相符,发作和结束时间与先兆的发生和结束完全相符,进一步验证了偏头痛先兆的CSD发生机制(图1)。此外,一些学者采用PET或磁共振灌注成像发现无先兆偏头痛患者也存在枕叶低灌注或低血流量[6,7],提示无先兆偏头痛可能与有先兆偏头痛存在类似的CSD发病机制。但这种一个时点的灌注测量并不能反映真正的CSD动态过程,且有学者发现无先兆偏头痛患者并无脑灌注改变。相对而言,BOLD-fMRI可更准确地反映CSD的特点。对家族性偏瘫性偏头痛(familial hemiplegic migraine,FHM)患者采用CT/磁共振灌注成像或SPECT扫描,均发现发作期不同时段高灌注或低灌注,而发作结束后恢复正常,磁共振波谱成像发现FHM患者相应半球存在NAA/Cr峰减少,这些都提示FHM存在神经系统原发的功能异常[8,9]。
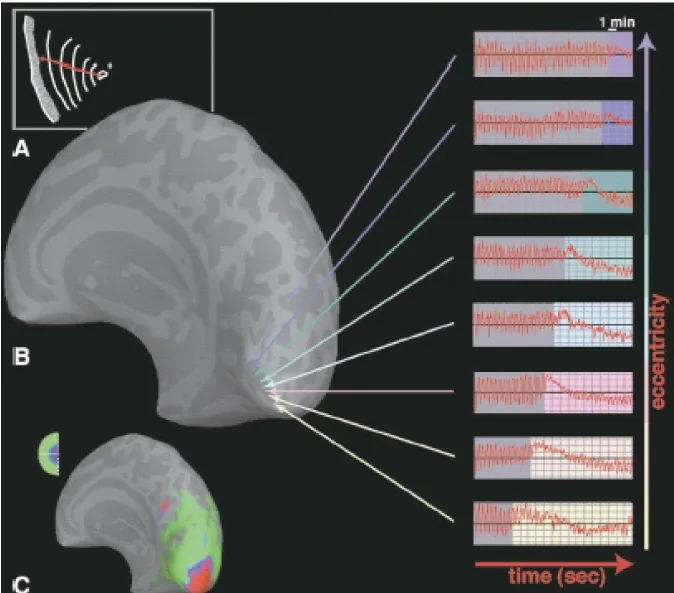
图1 偏头痛先兆期的皮质扩布抑制
2 偏头痛发作期
2.1 脑血管和血流量变化 长久以来普遍的观点认为,偏头痛发作与脑和脑膜血管扩张有关。但早期一些学者采用超声多普勒测量脑血流量和血流速度,从而间接判断偏头痛患者大脑中动脉是否扩张,得出的结果并不一致。甚至有学者采用MRA及磁敏感成像检查发现一例偏头痛患者头痛发作时局部血管痉挛,血流减少和静脉扩张[10]。Schoonman等[11]对20例硝酸甘油诱导偏头痛发作患者分别在输注硝酸甘油时和头痛发作(或无发作的在输注硝酸甘油后6 h)时采用MRA测量颈内、外动脉、大脑中动脉(MCA)、脑膜中动脉(MMA)、基底动脉、大脑后动脉血管直径。结果显示,输注硝酸甘油过程中所有血管有短暂扩张,但偏头痛发作期相比非发作期、头痛侧对照非头痛侧的脑血管直径并无差别,颈内动脉和椎基底动脉系统血流量无论在输注硝酸甘油时还是头痛发作时也无改变。提示脑血管和脑膜中动脉颅外段并未参与到偏头痛的发生过程中,或至少脑血管直径改变对偏头痛的发生并不起决定作用,进一步说明偏头痛是一种中枢神经系统疾病。但该研究并非以自然发作偏头痛为研究对象,并非连续测量,因而并不能否定自然发作偏头痛患者在头痛发作瞬间可能存在一过性血管扩张。Asghar等[12]采用高分辨直接MRA成像测量无先兆偏头痛发作期的大脑中动脉和脑膜中动脉直径,发现在发作期头痛同侧两者直径均增加,而头痛对侧动脉直径无变化,给予舒马曲普坦后头痛消失,头痛同侧脑膜中动脉直径也恢复正常,但大脑中动脉无变化,这些均提示偏头痛发作期血管活性物质对发作侧血管可产生扩张作用。
2.2 脑干功能影像学 有学者将电极置入中脑导水管周围灰质(PAG),发现可以诱发偏头痛,提示PAG可能参与了偏头痛的启动。早期的PET研究发现偏头痛发作期脑干、扣带回、听觉与视觉相关皮质血流量增加,而给予舒马曲普坦,头痛及畏光畏声症状完全缓解后,只有头痛对侧的脑干仍被激活[13];也有观察到中脑、脑桥、下丘脑在头痛缓解后仍保持被激活,提示这些持久被激活的部位在偏头痛的启动中发挥着重要作用[14 ,15]。Afridi等[15]发现,偏头痛发作期同侧脑桥背侧被激活,这种观察到的不同侧脑干激活的现象目前仍无法合理解释。18F-MPPF是选择性的5-HT1A受体拮抗药,味道诱发的偏头痛患者采用18F-MPPF标记的PET检查显示,偏头痛发作期较缓解期,偏头痛较非偏头痛者脑桥中缝核MPPF结合力增加,且左侧眶额皮质、中央前回、颞极结合力也明显增加,偏头痛缓解期和非偏头痛者之间无明显差别,提示偏头痛发作期脑桥中缝核受体密度增加或内源性5-HT水平减少[16]。
对视觉诱发的偏头痛患者行BOLD-fMRI检查发现,75%的患者在枕叶出现高信号前或头痛症状发作前,黑质、红核已经出现增强信号,提示黑质和红核参与到视觉诱发偏头痛激活的神经网络中[17]。Stankewitz等[18]采用fMRI观察偏头痛不同时期脊髓三叉神经核对痛刺激的反应,发现偏头痛患者发作间隙期脊髓三叉神经脊束核的信号低于正常对照组,偏头痛发作前信号与对照组相当,而头痛发作期其信号明显低于对照组,呈周期性。通过改变信号强度可以预测下次头痛发作,这种周期性激活现象可能是偏头痛的一种重要的发病机制。动物实验显示,脑干网状系统,特别是延髓头端腹内侧,在发展和维持中枢敏化中有重要作用。Urban等[19]对正常自愿者制作热/辣椒素敏化模型产生继发性痛觉过敏,全脑fMRI证实中脑网状系统激活,主要位于楔状核和中脑导水管周围灰质,提示该结构与中枢敏化有关。一般认为,偏头痛发作期对特殊味道、声音、光线的敏感与皮质加工过程功能紊乱有关。Stankewitz等[20]采用fMRI发现,嗅觉刺激时偏头痛患者边缘叶系统(杏仁核、岛叶)及脑桥头端信号明显增强,脑桥头端与偏头痛发作有关,提示嗅觉传入系统和三叉疼痛感受通路存在关联。
总之,脑干不同结构在偏头痛的触发,对疼痛传入的失抑制及中枢敏化,对头痛及其伴随症状的关联中发挥着重要作用。
2.3 皮质功能影像学 偏头痛发作时,与疼痛加工相关的皮质激活,主要包括前后扣带回、额叶前部、小脑、岛叶、颞叶[15]。在热性痛刺激时,颞极的激活在偏头痛发作期比发作间期更明显。与正常对照组比较,偏头痛患者的颞极与多个脑区有更多的功能联系,提示颞极的高兴奋性和异常功能连接可能参与导致偏头痛的特殊临床表现,包括对味道敏感、畏光、畏声、焦虑及颞叶癫等[20]。Denuelle等[22]对偏头痛患者头痛发作时采用连续光刺激,观察发作期、舒马曲普坦治疗缓解后、发作间期的PET表现,发现发作期和发作缓解后低强度光刺激可激活视皮质,发作期激活程度更明显,但发作间期未见激活,提示发作期畏光与视皮质高兴奋有关。然而,fMRI的结果却不尽一致,一些研究显示偏头痛患者枕叶皮质兴奋性和健康对照组有差别;但一些研究显示无差别。这种不一致性提示,可能只在偏头痛的某些阶段存在皮质抑制功能缺陷,从而诱发皮质高兴奋性[23]。
2.4 皮质下结构的功能影像学 Denuelle等[24]采用PET扫描发现,偏头痛发作时不仅中脑、脑桥被激活,下丘脑也被激活,而且在舒马曲普坦治疗头痛缓解后以上部位还持续被激活,提示下丘脑可能也参与到偏头痛的触发中。Maleki等[25]采用磁共振弥散张量成像(DTI)和概率性纤维跟踪技术描绘视皮质到丘脑枕的路径,对健康人群采用3T核磁扫描,勾画出图像形成视通路(视神经-外侧膝状体-视皮质)及非图像形成视通路(视交叉-丘脑枕-相关皮质区),非图像形成视通路可让光刺激汇聚于丘脑枕,而研究显示丘脑枕在偏头痛发作时选择性激活,提示丘脑枕是偏头痛发作期光刺激加重头痛的解剖基础。动物实验发现,在中枢敏化模型中存在丘脑后部被激活,这与fMRI研究一致,对偏头痛伴有痛觉超敏的患者在发作期轻刷手背,可发现丘脑后部的BOLD反应明显大于非发作期的同一群患者[26]。作者认为,有些偏头痛患者存在其他部位的痛觉过敏或痛觉超敏,这一现象与敏化的丘脑神经元整合加工从脑膜、头皮、面、躯干和肢体传入的痛觉信息有关。因此,从以上研究可以认为,下丘脑可能参与偏头痛的触发,丘脑参与颅外痛觉超敏的产生。
3 偏头痛慢性化
偏头痛可能从发作性疾病转化成慢性状态,但其慢性化机制并不清楚,目前有关偏头痛慢性化的影像学研究也不多。偏头痛慢性化常常与急性抗偏头痛药过度使用有关。Fumal等[27]对消炎止痛药药物过量性头痛(MOH)患者做FDG-PET扫描,发现双侧丘脑、眶额皮质、前扣带回、岛叶/腹侧纹状体及右下顶叶为低代谢,小脑蚓为高代谢,小脑在发作期血流增加,眶额皮质灰质容积减少,活性减少,但扣带回前背侧功能连接增强。在停药3周后,这些与疼痛加工相关区域的葡萄糖代谢异常基本恢复正常,但眶额皮质的代谢活性进一步降低。眶额皮质与驱动、强迫行为、药物依赖和赌博成瘾有关[28],提示MOH患者眶额皮质功能异常与止痛药过度使用有关。FDG-PET研究还显示,慢性偏头痛的脑干代谢增加,额叶内侧、顶叶、体感皮质代谢减少[29],提示痛觉抑制通路可能存在功能异常。Ferraro等[30]采用fMRI研究发现,MOH患者药刚停时,初级体感皮质、下顶叶、缘上回及外侧疼痛基质通路比健康对照者疼痛相关活性明显减低,但在6个月后两者无差别,提示MOH患者外侧疼痛通路存在明显的功能异常,停药后6个月可恢复正常。
综上所述,偏头痛发作期的功能神经影像学揭示了偏头痛患者大脑中存在数个活性增强或减低区,代谢增高或降低均与疼痛加工、感知、抑制及偏头痛伴随症状的区域有关(表1)。这些区域的功能改变提示,偏头痛患者存在原发的脑功能异常或反复疼痛继发的代谢异常,显示偏头痛中枢起源问题而非单纯血管功能异常,一定程度上揭示了偏头痛启动、维持和复发及相关症状发生的病理生理机制。

表1 偏头痛各时期脑功能影像学改变
[1] Yu S, Liu R, Zhao G,etal. The prevalence and burden of primary headaches in China: a population-based door-to-door survey[J]. Headache,2012,52: 582-591.
[2] Bolay H, Moskowitz M A. The emerging importance of cortical spreading depression in migraineheadache[J]. Rev Neurol (Paris), 2005,161:655-657.
[3] Duckrow R B. Regional cerebral blood flow during spreading cortical depression in conscious rats[J]. J Cereb Blood Flow Metab,1991,11: 150-154.
[4] Cutrer F M, Sorensen A G, Weisskoff R M,etal. Perfusion-weighted imaging defects during spontaneous migrainous aura[J]. Ann Neurol,1998,43:25-31.
[5] Hadjikhani N, Sanchez D R, Wu O,etal.Mechanisms of migraine aura revealed by functional MRI in human visual cortex[J]. Proc Natl Acad Sci USA,2001,98:4687-4692.
[6] Woods R P, Iacoboni M, Mazziotta J C. Bilateral spreading cerebral hypoperfusion during spontaneous migraine headache[J].N Engl J Med, 1994,331: 1689-1692.
[7] Denuelle M, Fabre N, Payoux P,etal. Posterior cerebral hypoperfusion in migraine without aura[J]. Cephalalgia,2008,28: 856-862.
[8] Laspina I, Vignati A, Porazzi D. Basilar artery migraine: Transcranial Doppler EEG and SPECT from the aura phase to the end[J]. Headache,1997,37:43-47.
[9] Mourand I, Menjotde C N, Carra D C,etal. Perfusion-weighted MR imaging in persistent hemiplegic migraine[J]. Neuroradiology,2012,54:255-260.
[10] Shimoda Y,Kudo K,Kuroda S,etal. Susceptibilityweighted imaging and magnetic resonance angiography during migraine attack:a case report[J]. Magn Reson Med Sci,2011,10:49-52.
[11] Schoonman G G, Grond J, Kortmann C,etal.Migraine headache is not associated with cerebral or meningeal vasodilatation -A 3T magnetic resonance angiography study[J]. Brain, 2008,131:2192-2200.
[12] Asghar M S, Hansen A E, Amin F M,etal. Evidence for a vascular factor in migraine[J]. Ann Neurol,2011,69:635-645.
[13] Weiller C, May A, Limmroth V,etal. Brain stem activation in spontaneous human migraine attacks[J].Nat Med,1995,1:658-660.
[14] Afridi S K, Matharu M S, Lee L,etal. A PET study exploring the laterality of brainstem activation in migraine using glyceryl trinitrate[J]. Brain,2005,128:932-939.
[15] Bahra A, Matharu M S, Buchel C,etal. Brainstem activation specific to migraine headache[J]. Lancet,2001,357:1016-1017.
[16] Demarquay G, Lothe A, Royet J P,etal. Brainstem changes in 5-HT1A receptor availability during migraine attack[J]. Cephalalgia, 2011,31:84-94.
[17] Cao Y,Aurora S K, Nagesh V,etal.Functional MRI-BOLD of brainstem structures during visually triggered migraine[J]. Neurology,2002,59:72-78.
[18] Stankewitz A, Aderjan D, Eippert F,etal.Trigeminal nociceptive transmission in migraineurs predicts migraine attacks[J]. J Neurosci, 2011,31:1937-1943.
[19] Urban M O, Gebhart G F. Supraspinal contributions to hyperalgesia[J]. Proc Natl Acad Sci USA,1999,96:7687-7692.
[20] Stankewitz A, May A. Increased limbic and brainstem activity during migraine attacks following olfactory stimulation[J]. Neurology, 2011,77:476-482.
[21] Moulton E A, Becerra L, Maleki N,etal. Painful heat reveals hyperexcitability of the temporal pole in interictal and ictal migraine states[J]. Cereb Cortex,2011,21:435-448.
[22] Denuelle M, Boulloche N, Payoux P,etal.A PET study of photophobia during spontaneous migraine attacks[J]. Neurology,2011,76:213-218.
[23] Huang J, DeLano M, Cao Y. Visual cortical inhibitory function in migraine is not generally impaired: evidence from a combined psychophysical test with an fMRI study[J]. Cephalalgia, 2006,26(5):554-560.
[24] Denuelle M, Fabre N, Payoux P,etal. Hypothalamic activation in spontaneous migraine attacks[J]. Headache,2007,47:1418-1426.
[25] Maleki N, Becerra L, Upadhyay J,etal. Direct optic nerve pulvinar connections defined by diffusion MR tractography in humans: implications for photophobia[J]. Hum Brain Mapp, 2012,33:75-88
[26] Burstein R, Jakubowski M, Garcia-Nicas E,etal.Thalamic sensitization transforms localized pain into widespread allodynia[J]. Ann Neurol,2010,68:81-91.
[27] Fumal A, Laureys S, Di Clemente L,etal. Orbitofrontal cortex involvement in chronic analgesic-overuse headache evolving from episodic migraine[J]. Brain, 2006,129(2):543-550.
[28] Volkow N D, Fowler J S, Wang G J. The addicted human brain viewed in the light of imaging studies:brain circuits and treatment strategies[J]. Neuropharmacology,2004,47(1):3-13.
[29] Aurora S K, Barrodale P M, Tipton R L,etal. Brainstem dysfunction in chronic migraine as evidenced by neurophysiological and positron emission tomography studies[J]. Headache,2007,47:996-1003.
[30] Ferraro S, Grazzi L, Mandelli M L,etal. Pain processing in medication overuse headache: a functional magnetic resonance imaging (fMRI) study[J]. Pain Med ,2011,13:255-262.
(2013-10-22收稿 2013-11-02修回)
(责任编辑 尤伟杰)
于生元,博士,教授,主任医师,E-mail: yusy1963@126.com
100853北京,解放军总医院神经内科
R747.2
