莪术油对人乳头状瘤病毒的抑制作用
2014-07-18张小燕丁晓萍徐海燕卞美璐陈庆云
张小燕,丁晓萍,叶 梅,徐海燕,卞美璐,陈庆云
莪术油对人乳头状瘤病毒的抑制作用
张小燕1,丁晓萍1,叶 梅1,徐海燕1,卞美璐2,陈庆云2
目的探讨莪术油对人乳头状瘤病毒(human papillomavirus, HPV)16亚型的抑制作用。方法以不同浓度的含莪术油培养液体外培养宫颈癌细胞系SiHa、CaSki 和宫颈永生化细胞H8,相差显微镜下观察活细胞形态学变化;采用四甲基偶氮唑蓝比色法、流式细胞术检测不同浓度莪术油对细胞增殖的影响;应用反转录-聚合酶链反应技术(reverse transcriptase polymerase chain reaction,RT-PCR)检测人乳头状瘤病毒HPV16亚型 E6E7的表达。结果不同浓度的莪术油可以抑制细胞的增殖;莪术油作用于SiHa细胞,G1期细胞减少(P<0.05),G2、S期细胞增加(P<0.01),细胞阻滞于G2、S期。莪术油作用于CaSki 、H8细胞,G1期细胞减少(P<0.01),S期细胞增加(P<0.01),使细胞阻滞于S期。加药组SiHa、CaSki和H8细胞凋亡率高于对照组,有统计学差异(P<0.01,P<0.01,P<0.05);三种细胞HPV16E6E7基因片段mRNA表达均明显低于对照组(P<0.01)。结论莪术油在体外抑制宫颈癌细胞系SiHa、CaSki 和宫颈永生化细胞H8增殖,其机制可能是通过抑制HPV16E6E7表达而抑制细胞生长。
莪术油;人乳头状瘤病毒;反转录-聚合酶链反应
宫颈癌是最常见的恶性肿瘤之一,目前已经明确高危型人乳头状瘤病毒感染是宫颈癌和癌前病变的主要危险因素[1],与宫颈癌有关的高危HPV亚型的治疗目前尚无特效药物,HPV疫苗大规模投入临床使用尚需时日,研制开发抗HPV药物对于宫颈癌的防治具有重要意义。莪术属姜科植物的干燥根茎,经温莪术蒸馏得到的挥发油-莪术油在抗病毒和肿瘤治疗中表现出良好的效果,故受到关注[2,3]。但是,莪术油对于宫颈病变相关的高危型HPV作用的研究报道甚少。本研究旨在探讨中药莪术油对于HPV16抑制作用的机制,为临床对宫颈癌的防治提供理论依据。
1 材料与方法
1.1 材料来源
1.1.1 细胞系 CaSki细胞系,HPV16阳性的人宫颈癌细胞株,H8细胞系,人宫颈鳞状上皮永生化细胞系,HPV16 阳性细胞株,SiHa细胞系,HPV16 阳性细胞株,以上均由中国医学科学院基础医学研究所生物物理室提供。
1.1.2 引物 由上海生工生物工程技术服务有限公司应用美国PE公司391型 DNA自动合成仪合成。
1.1.3 试剂 莪术油,由海南碧凯药业有限公司提供;培养液和血清:Dulbecco’s Modified Eagle Medium(DMEM)培养液(GIBCO BRL),胎牛血清(天津市川页生化制品有限公司);工具酶:Taq DNA 聚合酶(Promega),反转录酶(AMV Reverse Transcriptase)(Promega)。
1.2 实验方法
1.2.1 细胞培养 CaSki和SiHa细胞在含5%胎牛血清的DMEM培养液中,H8细胞在含2%胎牛血清的DMEM培养液中,37℃, 5% CO2饱和湿度环境下培养。
1.2.2 细胞形态观察 将对数生长期的细胞接种于预先放置玻片的6孔板培养板内,每孔10×104个细胞,分为4个组(对照组,药物1-3组,药物浓度分别为15、25、35 μg/ml),形成附有细胞的盖片,培养3 d后,在倒置显微镜下观察细胞形态。
1.2.3 细胞生长抑制情况 将细胞接种于六板96孔细胞培养板,每孔3000个细胞,第2天更换为含药培养液,分4组,方法同上,每个浓度平行5孔。37℃,5%CO2培养24 h后每孔加入5 mg/ml四甲基偶氮唑蓝(MTT)20 μl,继续培养4 h,弃去上清液,每孔加入二甲基亚砜150 μl, 37 ℃培养20 min,酶标仪测定OD值,波长492 nm,连续6 d,记录生长曲线。
1.2.4 细胞周期检测 在六孔培养板中以含不同浓度药物的培养液培养5 d,分4组,方法同上,每个药物浓度平行3孔,收集细胞,制备单细胞悬液,PBS清洗2次,预冷70%乙醇固定,4℃保存待检。经0.01%RNA酶处理胞浆RNA、50 μg/ml碘化丙锭(propidium iodide, PI)DNA染色30 min后,经300筛目过滤除去成团细胞,应用流式细胞仪检测细胞周期中不同时相的细胞百分比和细胞凋亡率。每份标本测定5000个细胞。根据DNA含量区分细胞所处细胞周期时相。
1.2.5 mRNA表达检测 收集培养第5天的细胞,TRIZOL处理后提取RNA,反转录为cDNA,扩增HPV16E6、E7,同时扩增β-actin作为内参照,HPV16E6、E7引物(616 bp):上游5′-TGACTTTGCTTTTCGGGATT-3′,下游5′-GAGAACAGATGGGGCACAC-3′。β-actin(552 bp)引物序列:上游:5′-ATCATGTTTGAGACCTTCAACACC-3′,下游:5′-CATGGTGGTGCCGCCGCCAGACAG-3′。扩增参数为:94 ℃预变性5 min;94 ℃变性45 s,50 ℃复性45 s,72 ℃延伸1 min,扩增30个循环;72 ℃延伸加时5 min;PCR产物4 ℃保存; 2%琼脂糖凝胶电泳观察结果,电压40 V。应用Scion Image 4.0 (NIH)软件进行电泳条带图像灰度值的半定量分析。待测基因电泳条带灰度比值=待测条带灰度值/同一份标本内参照β-actin条带灰度值。每个加药样本至少检测3次。

2 结 果
2.1 莪术油对细胞的生长抑制作用 MTT检测发现, SiHa在莪术油作用第1天开始,不同药物浓度与空白对照吸光度值(OD)有显著性差异(P<0.01),并呈剂量依赖性(图1)。H8与SiHa相似。而CaSki在药物作用第2天开始,不同药物浓度与空白对照吸光度值(OD)差异有显著性(P<0.01),并呈剂量依赖性。计算莪术油作用第5天SiHa、H8、CaSki 50%抑制浓度(IC50)分别为25.6、31.4、33.8 μg/ml,其中SiHa对药物的敏感性最高。

图1 莪术油作用下各组SiHa细胞生长曲线
2.2 药物对细胞形态的影响 SiHa细胞用莪术油处理后,可见细胞生长稀疏,部分细胞固缩(图2,3)。莪术油对CaSki 和H8细胞也有相似作用。
2.3 莪术油作用下细胞周期和凋亡率 莪术油作用于SiHa细胞,G1期细胞减少(P<0.05),G2、S期细胞增加(P<0.01),细胞阻滞于G2、S期。莪术油作用于CaSki、H8细胞,G1期细胞减少,(P<0.01),S期细胞增加(P<0.01),使细胞阻滞于S期。在莪术油作用下,SiHa、 CaSki和H8细胞凋亡率高于对照组,有统计学差异(P<0.01,P<0.01,P<0.05,表1)。
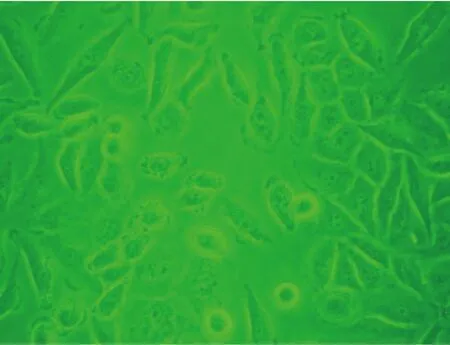
图2 SiHa细胞对照组(HE,×200)
2.4 莪术油对HPV E6E7基因表达的影响 本实验中在不同浓度莪术油作用下,SiHa、CaSKi、H8 HPV16E6E7基因片段mRNA表达均明显低于对照组(P<0.01),并呈剂量依赖关系(P<0.01,表2,图4-6)。

图3 SiHa细胞加药组(35 μg/ml)(HE,×200)
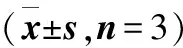
表1 莪术油作用下细胞周期分布和细胞凋亡率
注:与对照组相比,①P<0.05,②P<0.01;药物1-3组,药物浓度分别为15、25、35 μg/ml
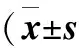
表2 RT-PCR产物电泳条带灰度值 ;n=3)
注:药物1-3组,药物浓度分别为15、25、35 μg/mL

图4 不同浓度莪术油作用下SiHa细胞系HPV16E6E7表达

图5 不同浓度莪术油作用下CaSKi细胞系HPV16E6E7表达

图6 不同浓度莪术油作用下H8细胞系HPV16E6E7表达
3 讨 论
近年来,从中药中筛选抗病毒和抗肿瘤药物是药物治疗研究的热点。莪术油是经温莪术蒸汽蒸馏得到的挥发油,含有多种抗癌有效成分,如β-榄香烯、莪术醇、莪术酮、吉玛酮等,在中药复方中多有配用。中药制剂保妇康栓由莪术油和冰片两味中药组成,在体外抑制宫颈癌细胞系CaSki 和宫颈永生化细胞H8增殖[4]。本实验通过研究莪术油对于体外培养的宫颈癌细胞系和宫颈永生化细胞的作用,探讨中药在抗HPV中的作用。
H8细胞系是HPV16阳性的宫颈永生化细胞系,可以作为宫颈癌前病变的体外试验模型[5],而SiHa、CaSki是HPV16阳性的宫颈癌细胞系,均为常见的人宫颈病变体外研究模型。莪术油对于SiHa、CaSki和H8细胞的生长具有抑制作用,随着药物浓度的增加,抑制作用增强。活细胞照像提示莪术油可以杀伤细胞,细胞生长稀疏,崩解破碎,证实药物对三种细胞增殖有抑制作用。其中HPV16阳性的SiHa细胞对莪术油的敏感性最高。
凋亡异常是肿瘤形成和进展的重要原因,通过各种途径和方式诱导增强肿瘤细胞的凋亡,是抑制杀伤肿瘤细胞的重要方面。与细胞凋亡有密切关系的基因有Bcl-2、Fas/FasL、caspases等。Bcl-2是凋亡抑制基因,一旦细胞受到凋亡因子的诱导,Bcl-2向线粒体转位通过寡聚化在线粒体外膜形成跨膜通道,或开启线粒体PT孔,导致线粒体中的凋亡因子释放,激活caspase,导致细胞凋亡[6,7]。Fas及其配体FasL是肿瘤坏死因子受体的超家族成员,Fas和FasL被认为是细胞凋亡的诱导因子,在细胞发生凋亡时,Bcl-2 mRNA转录水平显著降低,APpl·791-系统诱导的凋亡过程是通过Bcl-2表达的负调控Fas来实现的[8]。Fas蛋白与FasL结合后激活caspase,启动caspases的级联反应,导致靶细胞凋亡。在HSC细胞凋亡过程中caspase家族起着重要作用,其中caspase-3是细胞凋亡过程中最主要的不可替代的终末剪切酶,在凋亡的早期阶段,细胞色素C从线粒体释放,继而伴caspases激活,活化的caspase-3被裂解相应的胞质胞核底物而激活核酸酶,从而降解DNA,最终导致细胞凋亡[9]。国艳等[10]发现,莪术油注射液对体外培养的肝星状细胞有明显促凋亡作用,可能是通过上调促凋亡基因Fas/FasL的表达,下调抑凋亡基因Bcl-2的表达,使线粒体通透性增加,链锁激活caslyase-3蛋白,而导致细胞凋亡。流式细胞术结果显示,在不同浓度的莪术油作用下,SiHa、 CaSki和H8细胞凋亡率高于对照组。另外,在莪术油作用下,SiHa细胞阻滞于G2、S期,CaSki 和H8细胞则阻滞于S期,表明莪术油可以通过影响DNA的合成和复制,有效的抑制肿瘤细胞的增殖。研究证实莪术油的成分姜黄素、榄香烯对肿瘤细胞的各个周期都有抑制作用[11]。
本实验中,在莪术油作用下,SiHa、CaSki、H8三种细胞系HPV16E6E7基因片段mRNA表达均明显低于对照组,且存在剂量依赖关系。莪术油可能通过抑制肿瘤细胞HPV16E6E7表达,激活P53和Rb通路促进细胞衰老和凋亡。
莪术油在体外抑制宫颈癌细胞系SiHa、CaSki 和宫颈永生化细胞H8增殖,因此莪术油可能是抑制HPV的有效中药,对于明确为感染性疾病的宫颈癌的防治具有重大的意义,但是其作用机制及临床疗效尚有待进一步探讨。
[1] Chao A, Huang H J, Lai C H.Human papillomavirus research on the prevention,diagnosis,and prognosis of cervical cancer in Taiwan[J]. Chang Gung Med J, 2012,35(4):297-308.
[2] 刘红艳,彭安邦,廖爱军,等.莪术油注射液对肝星状细胞凋亡的影响[J].中华肝脏病杂志,2009,17(10):790-791.
[3] 王海文,周尚菲.微波联合复方莪术油栓治疗宫颈糜烂的疗效观察[J].中国基层医药,2009,16(7):1170-1171.
[4] 张小燕,卞美璐,房 青,等.中药保妇康栓对人乳头状瘤病毒抑制作用的实验研究[J].中日友好医院学报, 2007,21(4):216-219.
[5] Park C,Kim G Y,Kim G D,etal. Induction of G2/M arrest and inhibition of cyclooxygenase-2 activity by curcumin in human bladder cancer T24 cells[J].Oncol Rep, 2006,15(5):1225-1231.
[6] Murphy E,Imahashi K,Steenbergen C.Bel-2 regulation of mito-chondrial energetics[J].Trends Cardiovasc Med,2005,15:283-290.
[7] ShimiZR S,Kanaseki T, Mizushima N,etal.Role of Bcl-2 familyproteins in anon-apoptotic programmed cell death dependent onautophagy genes[J].Nat Cell Biol,2004,6:1221-1228.
[8] Novo E,Marra F,Zamara,etal.Overexpression of Bcl-2 by activated human hepatic stellate cells:resistance to apoptosis as a mechanism of progressive hepatic fibrogenesis in humans[J].Gut,2006,55:1174-1182.
[9] Takahashi A.Caspase:executioner and undertaker of apoptosis[J].Int J Hematol,1999,70:226-232.
[10] 国 艳,彭安邦,廖爱军,等.莪术油注射液对肝星状细胞增殖、凋亡及分泌细胞外基质的影响[J].中华肝脏病杂志,2008,16:302-303.
[11] Holy J M.Curcumin disrupts mitotic spindle structrure and induces micronu-cleation in MCF-7breast cancer cells[J].Mutat Res,2002,518(1):71-84.
(2013-07-15收稿 2013-09-22修回)
(责任编辑 梁秋野)
Mechanismofproliferativeinhibitionofoleumcurcumaeonhumanpapillomavirusinvitro
ZHANG Xiaoyan1, DING Xiaoping1, YE Mei1,XU Haiyan1, BIAN Meilu2, and Chen Qingyun2.
1. Department of Obstetrics and Gynecology, The Second Artillery General Hospital of PLA, Beijing100088, China; 2. Department of Obstetrics and Gynecology, China-Japan Friendship Hospital, Beijing100029, China
ObjectiveTo study the inhibition of HPV16 by oleum curcumae.MethodsThe human cervical cancer cell line-CaSki, SiHa and the immortalized cervical epithelial cell-H8 were cultured with different concentrations of oleum curcumae. Changes in cellular form were observed by phase contrast microscopy. The proliferative inhibition under different concentrations of oleum curcumae on CaSki, SiHa and H8 was measured by methyl thiazolyl tetrazolium(MTT) assay and flow cytometry assay. The mRNA expression of HPV16 E6E7 was determined by RT-PCR semi-quantitatively.ResultsThe growth of CaSki, SiHa and H8 was inhibited by different concentrations of oleum curcumae. SiHa cells were accumulated in G2, S phase(P<0.01), while CaSki, H8 cells were accumulated in S phase (P<0.01). The apoptosis rates in CaSki, SiHa and H8 cells were higher than those in control group(P<0.01,P<0.01,P<0.05). After treated by oleum curcumae, CaSki, SiHa and H8 cell showed decreased level of HPV16 E6E7 mRNA than that in the control group (P<0.01).ConclusionsOleum curcumae may execute its antiHPV activity primarily by decreasing the expression of HPV 16E6E7 in cervical cancer cell line and immortalized cervical epithelial cells.
oleum curcumae; human papillomavirus; reverse transcriptase polymerase chain reaction
张小燕,博士,副主任医师,E-mail: xiehe2003@sina.com.cn
1. 100088北京,解放军第二炮兵总医院妇产科;2. 100029北京,卫生部中日友好医院妇产科
R73-34
