依托咪酯对大鼠海马CA1区神经元突触结构电流-电压曲线的离子通道机制研究
2014-07-17于婵娟刘亚华黄春阳
于婵娟, 刘亚华, 田 亮, 黄春阳, 刘 涛, 蒋 晖
(新疆医科大学附属肿瘤医院麻醉科, 乌鲁木齐 830011)
神经元突触前膜所释放的神经递质和处于突触后膜上的相应受体接触所产生的突触后效应多种多样,其中最重要的效应之一是直接作用于突触后膜配体门控离子通道产生突触后电位。根据突触后膜离子通道开放离子转运的影响,突触后电位分为兴奋性突触后电位(excitatory postsynaptic potential, EPSP),即神经递质引起短暂的突触后膜去极化,使神经元静息电位改变产生兴奋;抑制性突触后电位(inhibitory postsynaptic potential ,IPSP),神经递质引起短暂的突触后膜超极化,使神经元兴奋性遭到抑制。 其中处于突触后膜上的GABAA受体为神经元主要的抑制性膜蛋白受体,该受体是一种配体门控的氯离子通道,由5个亚基组成。神经元(GABA)受体介导的抑制突触传递的作用增强,其主要机制是许多全身麻醉用药和GABAA受体相互作用直接或间接导致了氯离子内流的结果[1-2]。
依托咪酯(etomidate,ETO)是一种静脉注射麻醉剂,因为起效快,恢复快,对心血管和呼吸系统没有明显的毒副作用,通常用于临床麻醉诱导或者短小手术的麻醉。有研究表明,依托咪酯主要作用于中枢神经系统的GABAA受体,其不仅能增强γ-氨基丁酸(GABA)和GABAA受体结合所产生的效应,也可以直接作用于GABAA受体发挥类γ-氨基丁酸样作用[3]。依托咪酯的麻醉作用主要是与γ-氨基丁酸(GABA)受体结合,使膜氯离子通道开放,氯离子内流使细胞膜超极化,从而抑制细胞的兴奋性。
本研究应用全细胞膜片钳技术,分析依托咪酯对大鼠海马CA1区兴奋性突触后电流(excitatory postsynaptic currents,EPSCs)的电流-电压(I-V)曲线的影响以及与外向整流单通道氯电流的关系,进一步揭示依托咪酯通过作用于GABA受体所产生的突触后电流的细胞学机制。
1 材料与方法
1.1脑片的制备选取生长13~19 d的Wistar大鼠20只,雄性,空调室内饲养,控制室温为22~25℃,湿度为40%~60%,自由进水进食。将大鼠迅速断头,使用外科器械去除颅骨,分离脑组织,切取海马半球,遂迅速将所切取的海马半球置于切片机载物台上,放入装有0~4℃人工冰水脑脊液(以95%O2/5%CO2饱和)的切片凹槽中。使用振动切片机切取400 μm厚的海马脑部切片,后将其放置于37℃孵化槽中培养1 h,取出在室温下培养1 h(孵化槽中仍灌注以95%O2/5%CO2饱和的人工脑脊液)。
1.2药品与试剂人工脑脊液(NaCl 118,KCl 4.75,KH2PO41.19,NaHCO325,MgSO41.19,D-glucose 11,CaCl2·2H2O 2.94,pH=7.4);电极内液(K-gluconate 170,HEPES 10,NaCl 10,MgCl22,EGTA 0.2,Mg-ATP 3.5,Na-GTP 1.0,pH=7.2),以上药物浓度单位均为mmol/L。
依托咪酯脂肪乳(2 mg/mL,中国徐州恩药业集团有限公司有限公司,批号H20120511)。10%脂肪乳剂(乐山誉衡药业公司,批号0020801)。
1.3电生理记录所有实验均控制在室温18~23℃下进行。将所制备脑片移放到记录槽中,通过水管道以95%O2/5%CO2饱和的人工脑脊液持续灌注,流速控制为2 mL/min左右,凹槽灌注温度为30~32℃,循环液体容积为50 mL。利用拉制仪将硅硼玻璃管拉制成实验用记录电极,电极电阻为3.5~5 MΩ。隔离器连接双极电刺激Schaeffer 侧支/联合纤维(刺激冲动性为0.1 ms),间隔为20 s; 记录CA1区锥体神经元细胞EPSC。刺激强度最大为50%为宜,保持膜钳制电位为-70 mV。
全细胞记录使用Axopatch 200B膜片钳放大器,电刺激脉冲和信号采集以及单通道氯电流频谱记录均由计算机程序Clampx9.0及digidata1320A接口完成。采样频率为10 KHz,Bessel低通滤波器的频率设定为2 KHz。连续监测接触电阻(access resistance,Ra),只分析Ra稳定的细胞。采集数据使用pClamp 8.0软件进行整合分析,整合通道开放概率(P)通过公式NP=∑{t1+t2+t3…+tn}(n=10)进行处理,其中t为各样本通道开放增强时间占总刺激时间的比例。
1.4实验分组将20张制备的大脑切片(n=20)分为60 μL脂肪乳剂组(n=10)和10 μmol/L依托咪酯组(n=10)。 使用60 μL脂肪乳剂以及依托咪酯10 μmol/ L分组培养大脑切片40 min[4],观察待基线稳定后,Schaeffer 侧支/联合纤维给予单一刺激,同时改变CA1区锥体神经元膜钳制电位(-100 mV~ +40 mV,幅度为20 mV),每个分段钳制电压给予1次电刺激,实时记录单通道氯离子整合电流通道开放强度,绘制电压-电流(I-V)曲线。
1.5统计学处理使用Clamfit9.0和Origin5.0软件进行数据分析。EPSC频率值做标准化处理,即检测数据以相对于每组基线均值的比值或百分率表示为均数±标准差(-x±s)。组内比较采用配对t检验,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
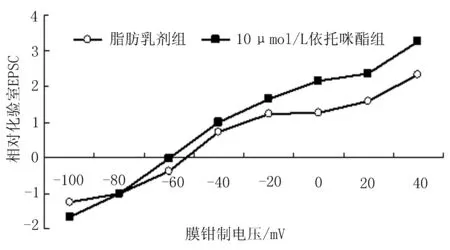
2.1依托咪酯对大鼠海马CA1区的I-V曲线的影响10 μmol/L依托咪酯组和60 μL脂肪乳剂组根据膜钳制电压测得的相对化EPSC数值见表1。随着膜钳制电位的变化,10 μmol/L依托咪酯组的相对EPSC值在-60、-40、-20、0、20及40 mV均高于60 μL脂肪乳剂组,差异有统计学意义(P<0.05)。

表1 10 μmol/L依托咪酯及60 μL脂肪乳剂对相对EPSC的影响(-x±s, mV)
注:与60 μL脂肪乳剂组相比较,P<0.05。
根据该表制图后形成图1,改变膜钳制电压(-100~+40 mV),发现脂肪乳剂组反转电位为-53 mV左右,10 μmol/L依托咪酯组为-60 mV左右,经统计学处理,差异有统计学意义(P<0.05)。说明10 μmol/L依托咪酯降低反转电位,使I-V曲线左移。
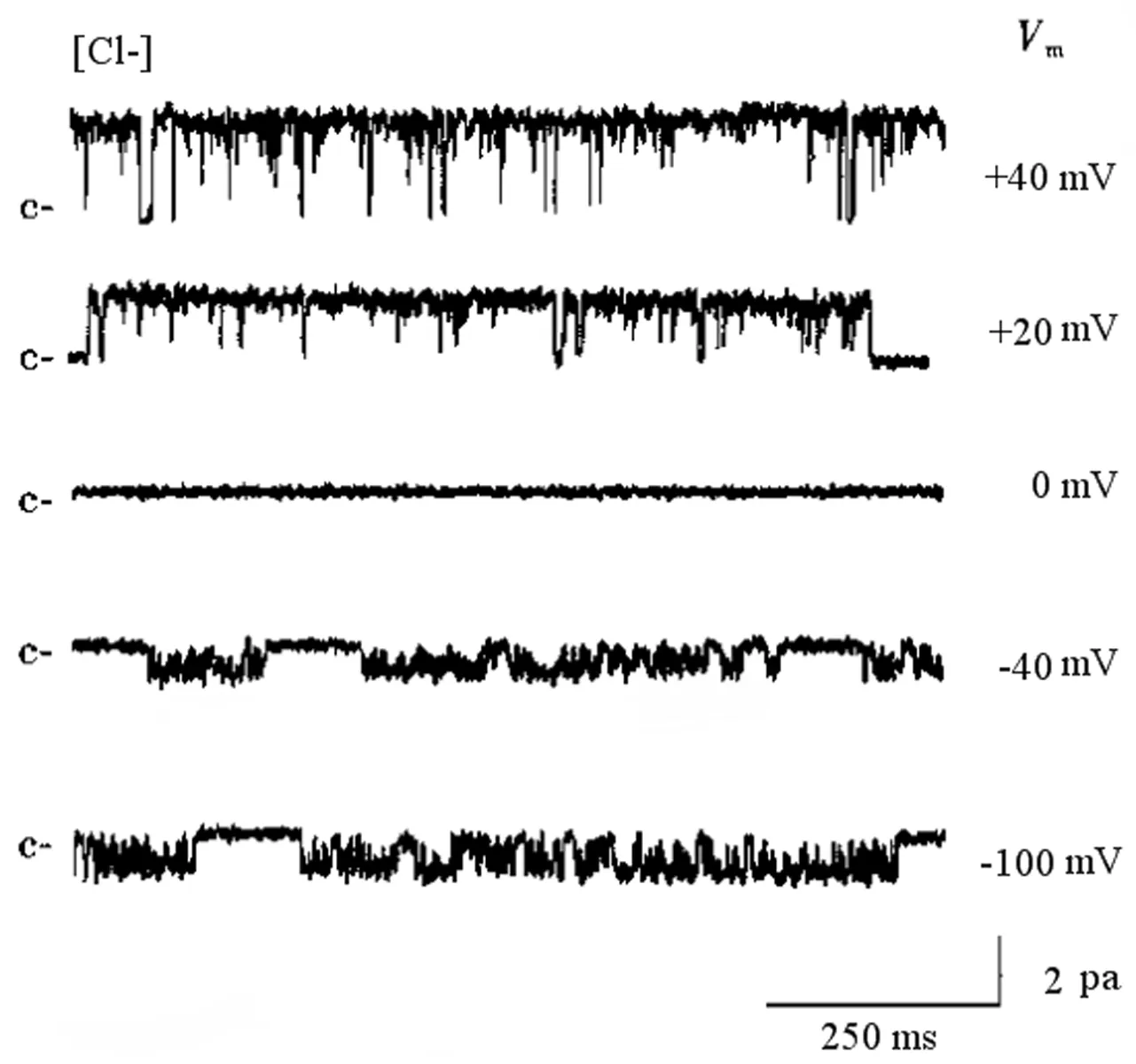
全程实时记录外向整流单通道氯电流通道的开放概率,脂肪乳剂组膜钳制电压(-100~+40 mV)时通道开放NP频谱见图2;依托咪酯组膜钳制电压(-100~+40 mV)时通道开放NP频谱见图3。与脂肪乳剂组比较,依托咪酯组在各个膜钳制电压检测点氯离子通道开放概率更频繁。
3讨论
GABA神经元在大脑的海马结构中分布非常广泛,其释放的抑制性氨基酸GABA具有极其重要的生理作用,特别在锥体细胞、海马中间神经元之间建立的快突触传导通路以及中隔与海马中间神经元的GABA能神经传导通路中,GABA均是其突触连接间最为主要的抑制性神经递质。 而GABAA受体是一种神经递质门控的氯离子通道,是由5个亚基组成的膜蛋白受体,不同的亚基又包含不同的亚型,主要有6类α亚基(α1~α6 )、4类β亚基(β1~β4)、4类γ亚基(γ1~γ4)及δ、ε、θ和П亚基等。均是由5个亚基包围分子中心区域形成一个由神经递质γ-氨基丁酸门控性的氯离子通道[5-6]。

配体门控离子通道是一类与相应受体偶联于同一跨膜蛋白大分子上的通道,受体未与递质结合时,该通道呈关闭状态,突触后膜保持静息电位[7-9]。一旦神经递质与相应受体结合使后者激活时,受体蛋白分子结构变构,离子通道打开形成贯通细胞膜的双向离子通道,离子出现跨膜转运,其顺膜电化学梯度出现的转运形成打破静息电位的膜电位差,形成动作电流,进而形成动作电位。当以上作用于突触结构时,通过已打开的突触后膜的配体门控离子通道所产生的电流,集成为突触后电流。其膜内外形成的总电位差称为突触后电位。突触后电流类型可按照其最终形成的突触后电位分为兴奋性突触后电流(excitatory postsynaptic current,EPSC)和抑制性突触后电流(inhibitory postsynaptic current,IPSC)。正常情况下,突触前膜释放的兴奋性氨基酸神经递质谷氨酸和突触后膜的AMPA和NMDA受体结合产生内向的阳离子电流(即EPSC),其主要开放Na+离子通道和Ca2+离子通道。而GABAA受体属于配体门控的阴离子通道,主要与抑制性氨基酸神经递质γ-氨基丁酸结合,对Cl-通透,发生Cl-内流,从而使突触后膜超级化对神经元信号传导产生抑制性的作用。
本实验进一步分析10 μmol/L依托咪酯对EPSC的电流-电压曲线的影响,发现依托咪酯可使I-V曲线左移,使反转电位由-53 mV降低为-60 mV左右,说明了参与构成EPSC的离子发生了变化,其中外向的电流有所增加。通过数据处理整合单通道氯电流的开放NP频谱图可以得知在这一时刻氯的外向电流明显增强,氯通道的开放程度加大,故进一步阐述了所增加的外向电流主要是由氯离子的跨膜内流转运引起的。
正常情况下,氯离子对静息膜电位的贡献很小,而胞内外氯离子浓度为细胞膜电位所调节并受到膜上存在的任何氯离子转运机制的调节。氯离子的跨膜转运,产生的电位结果可能是超极化的,也可以是去极化的,这种效应依赖于氯离子的平衡电位相对于静息电位为负或为正,而其又取决于细胞内氯离子转运系统所起的作用是消耗还是聚集。在静息电位去极化作用越是明显的细胞中,麻醉药物引起的超极化作用也就越大,这与麻醉药物引起的K+和Cl-跨膜转运作用非常一致,这些离子转运出现的电位变化结果与细胞的静息电位状态十分相近,其结果可能更好地解释了其超极化机制与细胞复极化之间的相似关系。同时,全身麻醉类药物降低海马神经元的膜电阻,增加氯离子通道的开放率,使海马神经元氯离子内向转运显著增强,细胞膜电位差进一步加大。因此,本研究结果提示,依托咪酯作用于神经元突触结构,与膜上GABAA受体结合,直接或间接改变了构成EPSCs的离子成分,使外向电流增加,且该外向电流很可能主要为氯离子的跨膜转运所形成。
参考文献:
[1] Bruce E, Herring M, Carolyn P,et al. Etomidate and propofol inhibit the neurotransmitter release machinery at different sites[J].Physiology,2011,589(5):1103-1115.
[2] Christian G, Rachel J, Uwe R, et al. Modulation of presynaptic β3-containing GABAAreceptors limits the immobilizing actions of GABA ergic anesthetics[J]. Mol Pharmacol, 2007,72(8):780-787.
[3] Erwin H,Jacob Engelmann,Kirsty G,et al.Etomidate Reduces initiation of backpropagating dendritic action potentials:Implications for sensory processing and synaptic plasticity during anesthesia[J]. Neurophysiology, 2007,97(2):2373-2384.
[4] 于婵娟,刘涛,蒋晖,等.依托咪酯对大鼠海马CA1区兴奋性突触后电流的影响[J].江苏医药,2012,20(37):1023-1025.
[5] 李建国,李晓明,胡平,等.成年大鼠海马ca1区锥体神经元外向整流氯离子单通道特性[J].生物化学与生物物理进展,2003,30(6):874-878.
[6] 陈瑛,苏瑞斌.氯离子通道和药物靶标[J].国际药学研究杂志,2009,36(6):457-460.
[7] 孙雪华,林群,曾邦雄.依托咪酯易化大鼠海马CA1区长时程抑制的诱导[J].福建医科大学学报,2005,39(2):133-136.
[8] 王浩森.氯离子通道生理药理学特点及相关疾病的研究进展[J].临床与医疗,2012,11:489-491
[9] 谢玉波,施小彤,刘敬臣.异丙酚或依托咪酯对戊四唑诱发大鼠海马CAl区神经元动作电位和突触传递的影响[J].中华麻醉学杂志,2007,27(7):591-593.
