Aβ单克隆抗体对痴呆模型小鼠学习记忆功能的影响
2014-07-13陈泉金李丽莎
陈泉金, 王 琴, 李丽莎, 陶 亮
(中山大学中山医学院药理学教研室, 广州 510080)
阿尔茨海默病(Alzheimer′s disease,AD)是一种常见的渐进性神经退行性疾病,主要表现为记忆力减退、认知功能障碍等神经精神症状。AD典型的病理特征包括外周淀粉样斑块沉积(主要由Aβ多肽聚集形成的)、神经元纤维缠结、小胶质细胞激活、胆碱能神经元死亡和突触缺失[1]。在许多老年痴呆动物模型中也发现了记忆力的减退以及突触可塑性的改变与Aβ蛋白水平的升高有着密切联系[2-3]。因此开发新的能够有效减轻脑组织内Aβ的负荷、阻止和逆转Aβ聚集的药物十分重要。人源化和鼠源化Aβ单克隆抗体是国内某知名药企合成的具有自主知识产权的新型生物制剂,可有效降低海马组织的Aβ蛋白水平,有望开发成为治疗AD的新型生物制剂。本研究初步研究和探讨人源化和鼠源化Aβ单克隆抗体对痴呆模型小鼠学习记忆功能的改善作用以及对海马组织内Aβ1-42和Aβ1-40蛋白水平的影响,为Aβ单克隆抗体的进一步开发提供依据。
1 材料与方法
1.1试剂与仪器多奈哌齐、人源化Aβ抗体和鼠源化Aβ抗体均由国内某知名药企提供。β淀粉样蛋白1-42(Aβ1-42)和1-40(Aβ1-40)ELISA试剂盒购自深圳菲优生物有限公司。小鼠Morris水迷宫视频跟踪系统(型号MT-200),酶标仪购自美国Biotek公司。
1.2动物与分组健康雄性和雌性APP/PS1双转基因小鼠分别为25只和20只,具有相同遗传背景的雄性和雌性正常对照小鼠均为8只,以上小鼠均为3月龄,由南京大学国家遗传工程小鼠资源库提供(SPF级,许可证号SCXK(苏)2010-0001)。雄性和雌性小鼠分别设正常组、模型组、多奈哌齐组、人源化Aβ抗体组和鼠源化Aβ抗体组,减去给药过程中的死亡例数,每组雄性小鼠最终分别剩有8、5、5、7、6只,雌性小鼠最终分别剩有8、5、3、2、4只。将APP/PS1双转基因小鼠养至6月龄再进行实验,多奈哌齐组给予3 mg/kg剂量的多奈哌齐灌胃给药, 正常对照组及模型组按照0.5 mL/只小鼠的体积腹腔注射,人源化Aβ抗体组及鼠源化Aβ抗体组小鼠分别腹腔注射1 mg/mL的人源化Aβ抗体及鼠源化Aβ抗体各0.5 mL。以上各组均为每周给药1次,共给药15 w,然后进行水迷宫实验。
1.3Morris水迷宫实验[4]实验时间共5 d,前4 d为定位航行实验,连续4 d观察和记录实验动物寻找并爬上平台所需的时间,检测小鼠学习获得能力。最后1 d(第5天)进行空间搜索实验,撤去平台,记录动物第1次经过原平台位置的时间(潜伏期)、穿越原平台位置的次数,检测小鼠空间记忆能力。以潜伏期和穿越平台次数作为评价指标检测药物对痴呆模型小鼠学习记忆的改善作用。
1.4海马组织Aβ蛋白含量测定Morris水迷宫测试结束后,将小鼠处死后取出大脑,迅速分离海马,加蛋白裂解液和盐酸胍制备脑组织匀浆,1 000 r/min离心20 min,取上清液置于-20℃冰箱保存。根据深圳菲优生物有限公司提供的Aβ1-42和Aβ1-40ELISA试剂盒的说明书测定海马组织Aβ1-42和Aβ1-40的蛋白含量。
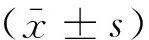
2 结果
2.1定位航行实验各组实验动物找到平台所需的时间随着训练进程呈缩短趋势。与模型组比较,第3天和第4天其他各组找到平台所需的时间明显减少,差异有统计学意义(P<0.05),见表1。
2.2空间搜索实验正常组、模型组、多奈哌齐组、人源化Aβ抗体组和鼠源化Aβ抗体组的游泳速度差异无统计学意义(P>0.05),与模型组相比,其他4组潜伏期缩短,穿越平台次数增加,差异有统计学意义(P<0.01),而其他4组之间的潜伏期及穿越平台次数均无统计学差异(P>0.05)。Morris水迷宫实验结果表明,人源化Aβ抗体和鼠源化Aβ抗体均能够显著改善痴呆模型小鼠的空间学习记忆能力,见表2。
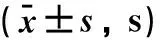
表1 定位航行实验结果
注:与模型组比较,*P<0.05。
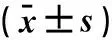
表2 空间搜索实验结果
注:与模型组比较,*P<0.05。
2.3海马组织Aβ蛋白含量测定各组海马组织中Aβ1-42蛋白含量均很低,检测不到,但Aβ1-40蛋白含量远高于Aβ1-42。正常组海马组织中Aβ1-40蛋白含量明显低于模型组,差异有统计学意义(P<0.01);与模型组相比,人源化Aβ抗体组和鼠源化Aβ抗体组海马组织中Aβ1-40蛋白含量显著降低,差异有统计学意义(P<0.01);多奈哌齐组海马组织中Aβ1-40蛋白含量与模型组相比并无统计学差异(P>0.05),见表3。
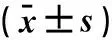
表3 海马组织Aβ1-42和Aβ1-40蛋白含量
注:与模型组比较,**P<0.01。
3 讨论
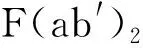
Aβ单克隆抗体的研究是AD治疗药物研发的一大热门领域,而APP/PS1双转基因小鼠模型在AD免疫治疗领域中的应用越来越广泛,该模型小鼠在出生后6~7个月即可检测到Aβ蛋白的沉积和学习记忆功能的损伤,因此本实验选择6月龄的小鼠开始进行给药。另外在多篇文献中Aβ单克隆抗体的给药剂量均设为0.5 mg/只小鼠,每周给药1次。Tamura等[7]报道给药15 w后发现小鼠脑中Aβ1-42和Aβ1-40的蛋白含量均显著降低。本实验据此设计给药剂量和时间。本研究通过实验检测Aβ单克隆抗体对痴呆模型小鼠学习记忆功能的影响,发现该药物能够明显改善痴呆模型小鼠的学习记忆能力,改善程度同多奈哌齐相似;同时发现该药物的作用机制可能与降低海马组织Aβ1-40蛋白含量有关,而多奈哌齐为胆碱酯酶抑制剂,对海马组织Aβ1-40蛋白含量无明显影响。虽然本实验结果未能比较Aβ单克隆抗体在不同性别小鼠中的治疗是否有差异,但是对于不同性别的小鼠经成组t检验发现人源化Aβ抗体组和鼠源化Aβ抗体组的疗效与模型组相比均有统计学差异(P<0.01)。
本实验所用的APP/PS1双转基因小鼠是在APP蛋白(人源淀粉样前蛋白)的第670位和671位的氨基酸发生双突变以及PS1基因(人类早老素基因)的第9个外显子敲除后得到的AD模型,通过基因突变和敲除,能够导致Aβ产生增多和诱导早老性痴呆,是一种评价AD药物疗效的可靠模型[8]。本研究ELISA结果表明在APP/PS1双转基因小鼠海马组织中Aβ1-42含量极低,而Aβ1-40含量远高于Aβ1-42,这与Du等[9]的实验报道结果一致。同时Röskam等[10]在综述中也提到Aβ1-40是大脑中产生的含量最丰富的Aβ多肽,而含量较少的Aβ1-42是一种更容易引起AD病理特征的Aβ多肽。然而也有文献报道海马组织中Aβ1-42含量高于Aβ1-40。既然有证据表明Aβ1-40在海马组织中含量丰富,就需要进一步深入研究其对AD病理特征的影响程度。
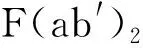
参考文献:
[1] Hartman RE, Izumi Y, Bales KR, et al. Treatment with an amyloid-beta antibody ameliorates plaque load, learning deficits, and hippocampal long-term potentiation in a mouse model of Alzheimer′s disease[J]. J Neurosci, 2005, 25(26):6213-6220.
[2] Selkoe DJ.Soluble oligomers of the amyloid beta-protein impair synaptic plasticity and behavior[J]. Behav Brain Res, 2008, 192(1):106-113.
[3] Haass C, Selkoe DJ. Soluble protein oligomers in neurodegeneration:lessons from the Alzheimer's amyloid beta-peptide[J]. Nat Rev Mol Cell Biol, 2007, 8(2):101-112.
[4] Gallagher JJ,Minogue AM,Lynch MA.Impaired performance of female APP/PS1 mice in the Morris water maze is coupled with increased Aβ accumulation and microglial activation[J]. Neurodegener Dis, 2013, 11(1):33-41.
[5] 邱宏,金国琴,金如锋,等. 水迷宫重复测量数据的方差分析及其在SPSS中的实现[J]. 中西医结合学报, 2007, 5(1):101-105.
[6] Solomon B, Koppel R, Hanan E, et al. Monoclonal antibodies inhibit in vitro fibrillar aggregation of the Alzheimer beta-amyloid peptide[J]. Proc Natl Acad Sci U S A, 1996, 93(1):452-455.
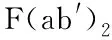
[8] Liu CC, Liu CC, Kanekiyo T, et al. Apolipoprotein E and alzheimer disease:risk, mechanisms and therapy[J]. Nat Rev Neurol, 2013, 9(2):106-118.
[9] Du J, Sun B, Chen K, et al. Metabolites of cerebellar neurons and hippocampal neurons play opposite roles in pathogenesis of Alzheimer′s disease[J]. PLoS One, 2009, 4(5):e5530.
[10] Röskam S,Neff F,Schwarting R,et al. APP transgenic mice:the effect of active and passive immunotherapy in cognitive tasks[J]. Neurosci Biobehav Rev, 2010, 34(4):487-499.
[11] Demattos RB, Bales KR, Cummins DJ, et al. Peripheral anti-A beta antibody alters CNS and plasma A beta clearance and decreases brain A beta burden in a mouse model of Alzheimer′s disease[J]. Proc Natl Acad Sci USA, 2001, 98(15):8850-8855.
[12] Morgan D,Diamond DM,Gottschall PE,et al.A beta peptide vaccination prevents memory loss in an animal model of Alzheimer's disease[J]. Nature, 2001, 408(6815):982-985.
[13] Tampellini D, Magrané J, Takahashi RH, et al. Internalized antibodies to the Abeta domain of APP reduce neuronal Abeta and protect against synaptic alterations[J]. J Biol Chem, 2007, 282(26):18895-18906.
[14] Arbel M,Solomon B.Immunotherapy for alzheimer′s disease:attacking amyloid-beta from the inside[J]. Trends Immunol, 2007, 28(12):511-513.
[15] Schenk D, Barbour R, Dunn W, et al. Immunization with amyloid-beta attenuates Alzheimer-disease-like pathology in the PDAPP mouse[J]. Nature, 1999, 400(6740):173-177.
