RECK基因GFP融合蛋白真核表达载体的构建及鉴定
2014-07-13刘利军杨向明申致远赵伟礼孙沫逸
刘利军, 扈 梅, 杨向明, 申致远, 赵伟礼, 孙沫逸
(1新疆医科大学口腔医学院, 新疆医科大学第一附属医院口腔颌面肿瘤外科, 乌鲁木齐 830054; 2第四军医大学口腔医学院口腔颌面外科, 西安 710032; 3武警新疆总队吐鲁番支队, 新疆 吐鲁番 838000)
在恶性肿瘤出现局部侵袭生长与发生远处转移的过程中,涉及到肿瘤细胞通过多种方式穿破细胞外基质、 浸润血管壁基膜、促进肿瘤细胞新生微小血管生成及进入肿瘤细胞周边微环境等复杂多样的病理过程[1]。而在恶性肿瘤转移的过程中,由肿瘤细胞分泌的多种蛋白酶降解细胞外基质(ECM)及基底膜的能力被认为与恶性肿瘤的侵袭与远处转移的能力密切相关,细胞外基质及基底膜的破坏程度也与患者的预后呈正相关。基质金属蛋白酶 (MMPs)是这些蛋白酶中最重要的一种蛋白酶,所以在对肿瘤侵袭与转移的实验研究中,关于MMP及其抑制剂的研究方兴末艾,对其了解的不断深入,也为临床治疗肿瘤提供了新的途径。
伴有kazal结构域的富含半胱氨酸的逆转诱导蛋白(reversion-inducing-cysteine-rich protein with Kazal motifs, RECK)基因是1998年 Takahashi等[2]在 v-Ki-ras基因转染的NIH3T3细胞中发现的一种基因。其染色体定位于 9p13~p12,长度约为87 bp,序列中包含有21个外显子和20个内含子, 其转录子大小为 4.6 KU。相关研究证实,RECK基因在转录水平上能有效抑制MMP-2、MMP- 9及 MT1-MMP, 从而抑制肿瘤的侵袭及转移能力[3]。Frumoto等[4]在有关胰腺星形细胞TGF-beta 信号通路中的研究中发现,抑制RECK蛋白酶水解活性能有效增加ECM的积累。Takahashi等[2]研究发现, 鼠内源性RECK基因在正常的NIH3T3细胞中有表达,而在多种癌基因转染的细胞中表达水平明显降低,说明此基因的表达可能受多种癌基因的负向调控而在肿瘤细胞中的表达水平下降。Chung等[5]在对口腔癌易感性的研究过程中发现,RECK基因的基因多态性与槟榔块的相互作用与口腔癌的发生与淋巴结转有较大相关性,说明RECK基因可以成为一个肿瘤的预后指标,而在治疗肿瘤侵袭和转移中有可能成为基因治疗的靶点。
为进一步研究RECK基因在口腔颌面部恶性肿瘤转移中的作用,本实验通过构建并鉴定RECK基因的绿色荧光蛋白 GFP 融合蛋白体外表达载体,并将构建的载体转染至口腔舌鳞癌细胞系SCC-25中,观察RECK基因在舌鳞癌细胞中的表达, 为揭示RECK基因在舌鳞状细胞癌的发生和转移中的作用机制奠定实验基础。
1 材料与方法
1.1材料与试剂pCDNA3.1真核质粒由北京中科院遗传发育生物学研究所戴建武实验室馈赠。pEGFP-N1载体购自美国Addgene公司,人胎肝cDNA文库购自Stratagene公司,DEPC、蛋白胨和酵母提取物购自Sigma-Aldrich公司,大肠杆菌 DH5α 感受态细胞、PCR 扩增试剂、DNA Ladder marker、T4 DNA 连接酶购自 Takara 公司,限制性内切酶HindⅢ、XhoⅠ、BamHⅠ、XbaⅠ购自Takara公司。总 RNA 提取试剂 Trizol Reagent 购自 Gibco公司,人舌癌SCC-25细胞系购自美国ATCC细胞库。细胞培养基RPMI 1640、脂质体转染试剂 Lipofectmine 2000 transfection regent、脂质体转染辅佐试剂无血清 Opitim 培养液购自美国 Invitrogen 公司。RIPA细胞裂解液购自北京百盛生物有限公司,人RECK单抗、GAPDH单抗购自Abnova公司。
1.2基因克隆使用PCR方法,从人胎肝cDNA文库中克隆RECK基因,目的片段克隆上游引物引入XhoⅠ内切酶位点, 序列为: 5′- ATACTCGAGATGGCGACCGTCCGGGCCTCTCTGCGAG -3′; 下游引物引入XbaⅠ内切酶位点, 5′-TATTCTAGATCAGTTATATGTCCAGAGCAAGT-
GC-3′, PCR 扩增条件: 94 ℃ 55 s, 61 ℃~58 ℃每一个循环降低 0.5 ℃ 55 s, 72 ℃ 10 min, 共 32循环。从pEGFP-N1质粒中克隆GFP基因,上游引物设计含HindⅢ内切酶位点为:5′-ATAAAGCTTATGGTGAGCAAGGGCGAGGA-3′下游引物含BamHⅠ内切酶位点为5′-TATGGATCCTCACTTGTACAGCTCGTCCATG-3′。PCR 扩增条件:94℃ 50 s,61℃~58℃每个循环降低0.5℃ 45 s, 72 ℃ 5 min, 共 32循环。PCR产物分别行1.5%琼脂糖凝胶电泳。
1.3pCDNA3.1-GFP-RECK表达载体的构建pCDNA3.1质粒及GFP序列PCR产物用BamHⅠ和HindⅢ核酸内切酶行双酶切反应,酶切反应后使用T4 DNA 连接酶连接HindⅢ和BamHⅠ酶切位点GFP基因至pCDNA3.1质粒中,连接完成后,转化入DH5α感受态细胞,提取质粒测序。测序正确后,使用XhoⅠ和XbaⅠ核酸内切酶,分别行pCDNA-GFP质粒及RECK基因PCR产物双酶切,再将含有XhoⅠ和XbaⅠ酶切位点的RECK基因通过T4 DNA 连接酶连接、转化入DH5α,获得 pCDNA-GFP-RECK 真核表达质粒,送测序后,提取测序正确菌株的质粒。
1.4SCC-25细胞中RECK基因表达将人舌癌细胞系SCC-25细胞复苏后接种于含10%胎牛血清、105 U/L 青霉素及 100 mg/L 链霉素的RPMI 1640培养基中,在 37 ℃、5%的CO2培养箱中培养。3~4 d传代1次。转染前24 h在直径为 5 cm 的培养皿中接种1×105个SCC-25细胞,于 37 ℃、5%的CO2培养箱中培养过夜。将转染试剂Lipofectmine 2000 transfection regent与无血清的Optimum 混合后室温孵育5 min, 然后按照使用说明吸取推荐浓度pCDNA-GFP-RECK质粒,滴入分别含有表达载体和空载体的离心管中, 室温孵育20 min后,将混合物加入培养皿中。培养箱中培养 5 h后更换为完全培养基,继续培养24 h后用荧光倒置显微镜在470 nm波长下观察GFP荧光蛋白表达。培养24 h后使用Trizol RNA 提取试剂分别提取SCC-25及转染GFP-RECK基因的SCC-25细胞mRNA, 反转录cDNA后,使用上游5′-CCTCAGTGAGCACAGTTCAGA-3′、下游5′-GCAGCACACACACTGCTGTA-3′为引物,行实时定量PCR(real-time PCR)检测RECK基因表达情况。
1.5SCC-25细胞中GFP-RECK蛋白表达细胞培养及质粒转染方法同前,将转染RECK基因的SCC-25细胞培养48 h后,吸除培养液,0.25%胰酶消化细胞后,使用含有10 μg/L的蛋白酶K 的RIPA细胞裂解液裂解细胞。以人GAPDH为内参使用小鼠抗人RECK基因单克隆抗体行Western-blot,检测RECK蛋白表达情况。
2 结果
2.1GFP及RECK基因克隆及鉴定将RECK基因PCR 产物电泳结果可见为单一条带,大小约为2 910 bp(图1), 与 目标RECK基因大小相一致。将扩增出的目的GFP蛋白基因条带行1.5%琼脂糖凝胶电泳,GFP基因约为720 bp,电泳结果示条带与目标基因大小相一致(图2),送测序后证实所得 GFP、RECK基因序列与数据库中序列相符。
2.2pCDNA3.1-GFP-RECK表达质粒克隆及鉴定将提取的质粒行1.5%琼脂糖凝胶电泳后结果示质粒大小约8 860 bp(图3),与目的连接后的质粒大小一致。将质粒送北京奥科公司测序,结果回报质粒GFP-RECK蛋白基因为含有RECK基因的全长的GFP-RECK蛋白的融合蛋白表达质粒(图4)。
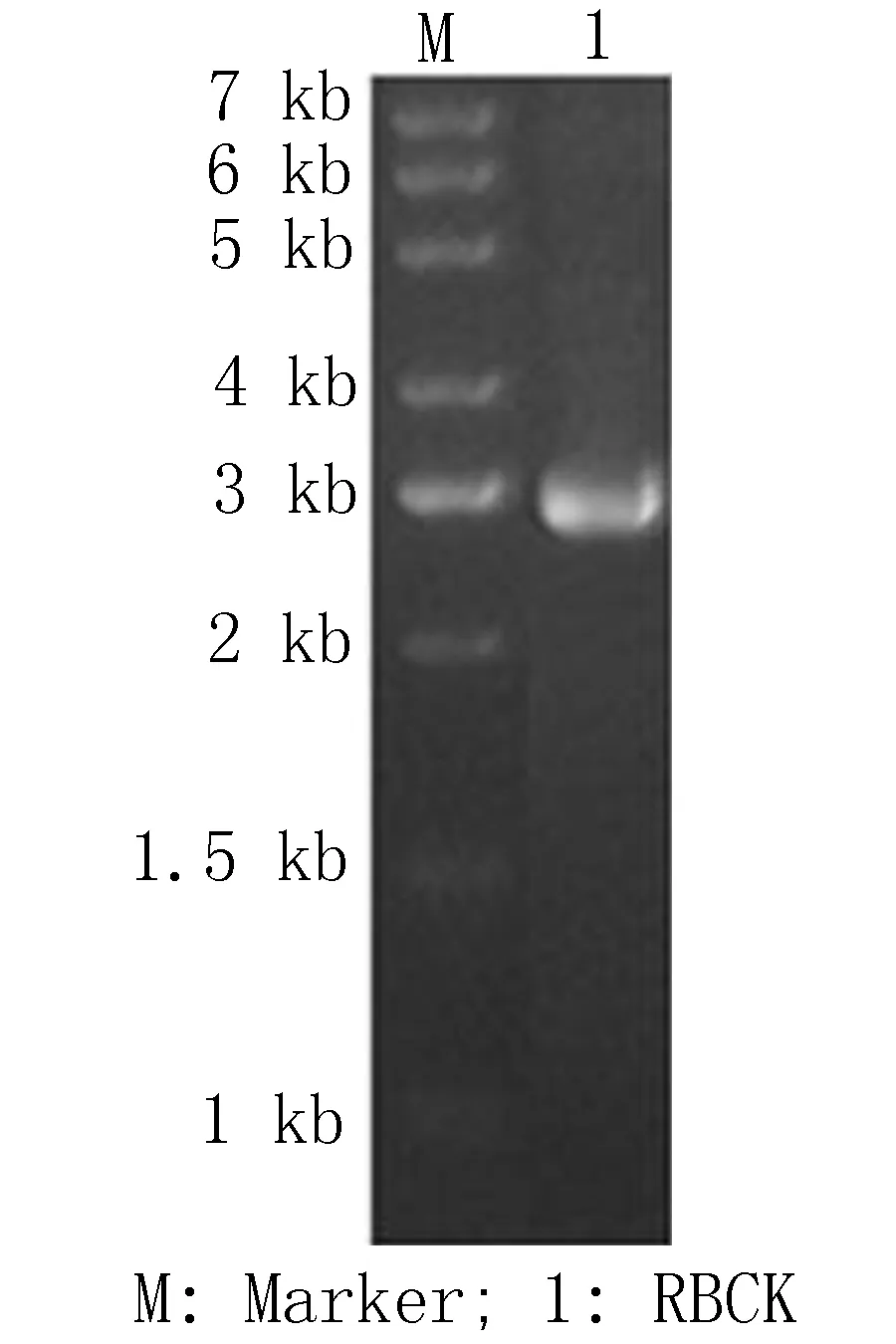
图1 RECK基因克隆1.5%琼脂糖凝胶电泳分析 图2 克隆GFP基因1.5%琼脂糖凝胶电泳分析 图3 pCDNA-GFP-RECK质粒1.5%琼脂糖凝胶电泳分析
图4 GFP-RECK质粒测序结果
2.3pCDNA-GFP-RECK转染SCC-25细胞内定位检测GFP蛋白在转染 48 h后在470 nm波长条件下,荧光显微镜可见GFP-RECK 转染的细胞荧光信号主要集中在与SCC-25细胞质有关的区域(图5)。
2.4SCC-25中转染RECK基因及蛋白表达水平检测转染RECK基因的SCC-25细胞系RECK基因表达水平(2.687±0.374)明显高于对照组(0.485±0.125),差异有统计学意义(P<0.05)(图6)。在Western-Blot检测示转染的RECK基因在人舌癌细胞系SCC-25中RECK蛋白有较高表达(图7)。
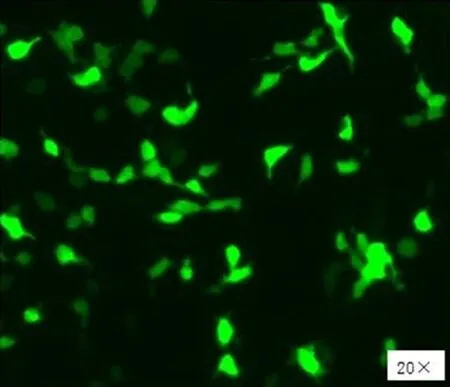
图5 转染pCDNA-GFP-RECK至SCC-25细胞系后荧光显微镜图片(20×)
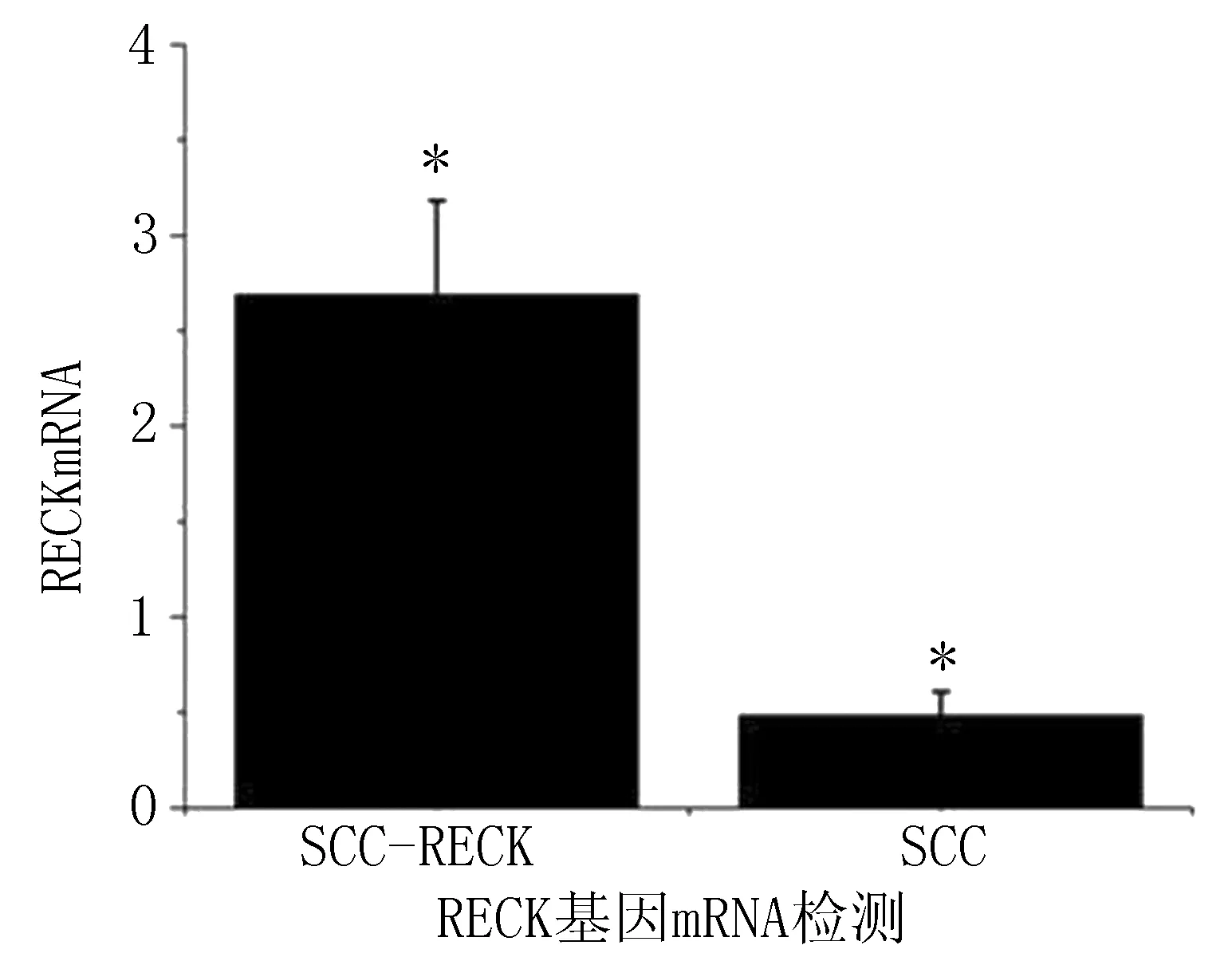
图6 SCC-25细胞系转染pCDNA-GFP-RECK后mRNA表达水平检测
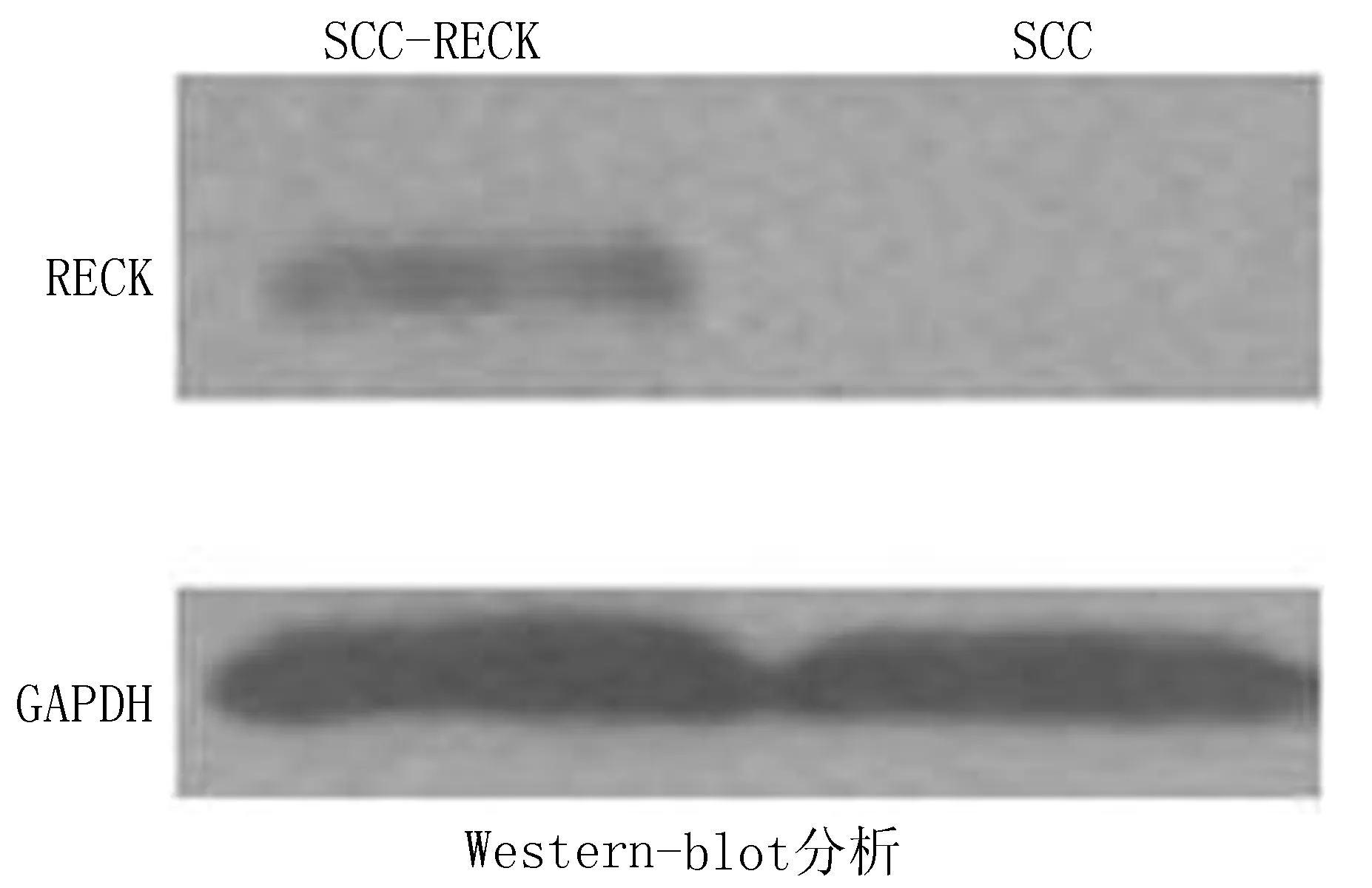
图7 SCC-25细胞系转染pCDNA-GFP-RECK基因后RECK蛋白表达检测
3 讨论
在对恶性肿瘤转移机制的研究中,能明显抑制基质金属蛋白酶的RECK基因及蛋白因为能够抑制肿瘤的侵袭、肿瘤血管生成和转移,而被认为与多种肿瘤的生物学表型有密切关联[6-8]。RECK 基因编码的蛋白质大小约 110 KU,此蛋白具有Kazal域的同感序列,蛋白序列中有2个表皮生长因子样(EGF)重复区和3个丝氨酸蛋白酶抑制物(SPI)相似的功能区。RECK 基因广泛地在人类正常组织和非肿瘤细胞中表达, 而在肿瘤来源的细胞系、肿瘤衍生细胞和肿瘤基因转化的细胞中, 其表达被抑制。而恢复 RECK 基因表达则能抑制肿瘤细胞的转移能力及表型,同时肿瘤细胞分泌的基质金属蛋白酶MMP-9、MMP-2的能力也被抑制。在肝癌、胰腺癌、前列腺癌、乳腺癌、直肠癌等的临床研究中发现在肿瘤组织中RECK基因的表达水平与肿瘤的预后有着密切的关系, 有RECK基因表达的患者其预后明显优于无RECK基因表达的患者[9-10]。研究证实RECK抑制肿瘤转移是通过下调金属蛋白酶家族的蛋白质分泌和活性而实现的。
舌癌是最常见的口腔恶性肿瘤,其常发生早期颈淋巴结转移,且转移率较高,预后不佳。目前, 对于舌癌的病因仍不完全清楚,其涉及多种物理化学因素如:口腔内的损伤因素、吸烟及酒精等,以及癌基因的激活和抑癌基因的失活、肿瘤细胞逃避免疫监视等多种原因。舌癌最为显著的病理学特征之一就是肿瘤细胞的侵袭性生长及颈淋巴结转移[11],而这些因素都与细胞外基质的降解与破坏有关。而RECK基因能有效抑制降解细胞外基质的金属蛋白酶 家族中多种蛋白酶的表达,因此深入研究 RECK 抑制舌癌侵袭及转移的详细机制对于舌癌的诊断及治疗具有十分重要的价值。
在对细胞基因的研究过程中,随着分子生物学的发展,基因合成和基因转染技术的成熟为细胞稳定表达某些目的基因提供了可能,可以在体外合成特定基因,然后转染实验个体,最终达到研究或治疗目标并以此来研究基因在细胞中表达及对细胞属性的影响。常见的真核质粒构建过程中,目标序列在1~2 kbp较容易构建,而长序列较易出现移码或丢码现象而相对较难构建,这对质粒选择和实验操作提出了较高要求。本实验在RECK真核表达质粒实验操作过程中使用了高保真酶及长序列测序,并在肿瘤细胞内进行转染后对目的基因表达水平、蛋白表达情况进行验证来保证实验结果。
本实验成功克隆了 RECK 基因, 并构建出体外表达GFP-RECK 融合蛋白的真核表达质粒,为进一步研究该基因的功能及在舌癌淋巴转移形成和发展中的作用奠定了实验基础。
参考文献:
[1] Rajeshwar PV,Corwin H.Matrix metalloproteinases(MMPs):Chemical-biological functions and (Q)SARs[J].Biol Med Chem, 2007,(15):2223-2268.
[2] Takahashi C, Sheng ZQ, Thomas PH. Regulation of matrix metalloproteinase-9 and inhibition of tumor invasion by the membrane-anchored glycoprotein RECK[J].Proc Natl Acad Sci USA, 1998, (95):13221-13226.
[3] Junseo OH, Takahashi R, Kondo S. The membrane-anchored MMP Inhibitor RECK is a key regulator of extracellular matrixintegrity and angiogenesis[J]. Cell, 2001, (107):789-800.
[4] Frumoto K, Ari S, Mori A, et al. RECK gene expression in hepatocellular carcinoma:correlation with invasion-related clinicopathological factors and itsclinicalsignificance. Reverse-inducing-cys-teine-rich protein with Kazal motifs[J]. Hepatology, 2001, 33(1):189-195.
[5] Chung TT, Yeh CB, Li YC et al. Effect of RECK gene plymorphisms on hepatocellular carcinoma susceptibility and clinicopathologic features[J]. PLoS ONE, 2012, 3(7):e33517.
[6] Masui T, Doi R, Koshiba T, et al. RECK expression in pancreatic cancer:its correlation with lower invasiveness and better prognosis[J]. Clin Cancer Res, 2003, 9(5):1779-1784.
[7] Span PN, Sweep CG, Manders P, et al. Matrix metalloproteinase inhibitor reversion-inducing cysteine-rich protein with Kazal motifs:a prognostic marker for good clinical outcome in human breast carcinoma[J]. Cancer, 2003, 97(11):2710-2715.
[8] Rabien A, Ergun B, Erbersdobler A. RECK overexpression decreases invasive potential in prostate cancer cells[J]. Prostate. 2012, 72(9):948-954.
[9] Du YY, Dai DQ, Yang Z, et al. Role of RECK methylation in gastric cancer and its clinical significance[J]. World J Gastroenterol, 2010, 16(7):904-908.
[10] Stenzinger A, von Winterfeld M, Rabien A, et al. Reversion-inducing cysteine-rich protein with Kazal motif (RECK) expression:an independent prognostic marker of survival in colorectal cancer[J]. Hum Pathol,2012, 43(8):1314-1321.
[11] Nagini S, Letchoumy PV, Thangavelu A, et al. Of humans and hamsters: a comparative evaluation of carcinogen activation, DNA damage, cell proliferation, apoptosis, invasion, and angiogenesis in oral cancer patients and hamster buccal pouch carcinomas[J]. Oral Oncol,2009, 45(6):e31-37.
