牛、羊初乳中多肽的筛分比较及抗炎作用研究
2014-07-13张悦葛武鹏贾玉良陈瑛王迁秦立虎
张悦,葛武鹏,贾玉良,陈瑛,王迁,秦立虎
(1.西北农林科技大学 食品科学与工程学院,陕西 杨凌 712100;2.陕西省质量技术监督局信息中心,西安 710006;3.陕西杨凌质量技术检测检验所,陕西 杨凌,712100;4.西安奶业科学研究所,西安 710065)
0 引 言
初乳所含营养物质极为丰富[1],其含有大量的免疫球蛋白和其他很多免疫成份,如肽类、激素、酶、糖及生长因子等[2]。食品中的功能成分小分子量的生物活性多肽(<1 000 g/mol)[3],它们是通过体内胃肠消化或体外蛋白酶解后得到的具有生物活性的小的氨基酸序列[4,5],显示出很多特殊功能特性,如抗菌性,抗高血压,免疫调节等[6]。
肿瘤坏死因子TNF-α已经确定是与炎症相关的支持因子,所以对于炎症的治疗策略是干预和降低TNF-α的浓度[7],炎症疾病困扰着人们,仅有报道称乳铁蛋白素具有抗炎作用[8],但很少有研究报道关于乳中的多肽成分的抗炎作用。
因此,本研究旨在分离纯化经模拟人体消化后牛羊初乳中的多肽,并检测了所获多肽的抗炎功能特性。
1 实 验
1.1 材料
1.1.1 原料
牛、羊初乳样品均为牛、羊产犊后第1天到第7天的乳;肽分离柱SuperdexTMPeptide 10/300GL;BV2神经小胶质细胞系。
1.1.2 试剂
Pepsin胃蛋白酶 (1∶10,000, 质量浓度5 g/L浓度0.01 mol/L的HCl)和trypsin胰蛋白酶(1∶250,浓度为5 g/L,pH=7.0磷酸盐缓冲液),DMEM培养基 (粉剂),双抗(含青霉素及链霉素和左旋谷氨酰胺),FBS(胎牛血清),LPS脂多糖 (血清类型 055∶B5),小鼠肿瘤坏死因子α(TNF-α)酶联免疫分析试剂盒,乙酸,色谱纯。
1.1.3 主要设备
AKTA PurifierTM10蛋白质层析仪,680酶标仪,冷冻离心机,3111二氧化碳培养箱,IF-300-150制冰机,高压立式蒸汽灭菌锅。
1.2 方法
1.2.1 乳样品的预处理
将所有收集的牛、羊初乳样品进行模拟人体胃肠消化处理。用浓度为1 mol/L的HCl使得蛋白质量浓度在3 g/L,37 ℃,pH值为1.5预热10 min,按照酶∶底物=1∶100的量加入胃蛋白酶溶液 (质量浓度5 g/L,浓度为0.01 mol/l的HCl)37 ℃下消化30 min;用浓度为1 mol/L的NaOH调pH值到6.8停止消化;调整pH值至7.8,40℃水浴预热10 min。按照酶∶底物=1∶30的量,加入胰蛋白酶溶液(质量浓度5 g/L(pH=7.0)磷酸缓冲液)40℃消化1 h。8 000 r/min冷冻离心30 min,上清液冷冻干燥后备用。
1.2.2 应用蛋白质层析仪对乳样品进行分离纯化
上机前所有样品要过0.22 μm的针头滤器 (水系),上样量为1 mL。选择专门分离多肽的柱子SuperdexTMPeptide 10/300GL,柱子内径10/床高300, 柱体积24 mL,平均颗粒13~15 μm,分离范围100~7 000 u,耐压为1.8 MPa,流速为1.2 mL/min。具体的分离纯化步骤参照厂商说明书。首先用pH值为4.6的乙酸-乙酸钠缓冲液清晰柱子和泵1 h,再让样品过0.22 μm的针头滤器(水系)后上样1 mL,3种检测波长280,254,215 nm的检测器均打开是为选择出最好的色谱图,最后仪器配有同步自动收集器收集所分离纯化出的样品。
1.2.3 BV2细胞培养
BV2,小鼠神经小胶质细胞系,用含10%胎牛血清的DMEM培养基 (含100 U/mL青霉素和100 μg/mL链霉素,2mM左旋谷氨酰胺,pH值为7.1~7.2)在37℃质量分数为5%的CO2条件下培养,每隔2~3 d换培养基1次。
1.2.4 抗炎作用分析
选取BV2细胞培养上清液,分别加入1 μL分离纯化出的每种多肽,再向其中加入能够诱发炎症的1 mg/L of LPS脂多糖,然后于无血清FBS培养基上培养24 h。所选的ELISA试剂盒采用的是竞争法检测样品中的肿瘤坏死因子α(TNF-α)的含量。向预先包被了抗体的酶标孔中加入样品,再加入辣根过氧化物酶标记的识别抗原,在37℃下孵育1 h,两者与固相抗原竞争结合形成免疫复合物,经PBST洗涤后,结合的HRP催化TMB(四甲基联苯胺)成蓝色,随后在酸的作用下转化成黄色,在450 nm波长下有吸收峰,吸光值与样品中的抗原浓度成负相关。文中未做特别说明时,样品质量浓度为3.3 g/L。
1.2.5 数据统计与分析
文中数据为3次平行测得值的平均值。采用SPSS统计软件16.0在显著性水平P=0.05下进行数据统计与分析。ELISA试剂盒数据处理选择ELISA数据处理软件ELISACalc。
2 结果与讨论
2.1 牛、羊常乳经模拟消化后的多肽分离纯化比较
经过模拟人体消化后,牛、羊常乳通过SuperdexTMPeptide 10/300GL肽分离柱的分离后的洗脱曲线如图1所示。其中,图1(a)表示牛常乳的分离出的各组分多肽的峰,图1(b)表示羊常乳的分离出的各组分多肽的峰。通过多次实验后结果比较后,选择254 nm作为最佳检测波长,即在254 nm处各样品中分离出的多肽种类最多,下同。
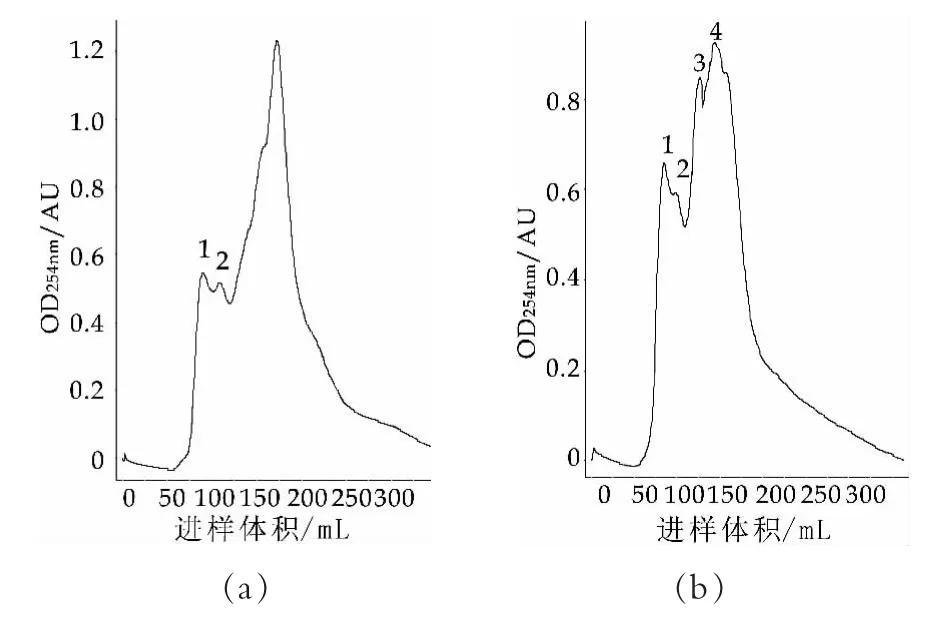
图1 牛、羊常乳经模拟消化后的多肽分离纯化比较
由图1(a)可以看出,牛乳中分离出来了3种不同的多肽组分,并且随着进样体积的增加,产生了一个最高吸收峰3,依据分子筛的原理,我们可以推断多肽组分3的分子量小于多肽组分1和2。从图1(b)可以看出,羊乳中分离出来了4种不同的多肽组分。说明羊乳中的多肽组分比牛乳中的多。众所周知,羊乳的蛋白分子量低于牛乳的,所以羊乳蛋白更易水解产生多肽,这与Clarks[9]等人的研究相符合。
虽然AKTA PurifierTM10蛋白质层析仪可以方便快速的区分样品中的多肽组分种类,但其也只是初步的分离纯化,如果需要更精确的区分,可能还需要更高级更好的仪器设备和方法,如Jasmin[10]等人研究的固相金属亲和色谱IMAC联合质谱(MALDI-TOF-MS)法,反向或离子交换色谱结合等[11]。本研究着重初步区分牛、羊初乳经过模拟人体消化后的多肽组分,并作比较,最后选出具有较好功能的可能是复杂成分的组分之后再做细分。
2.2 牛、羊初乳经模拟消化后的多肽分离纯化比较
初乳作为雌性动物刚产过子之后的乳,其营养是极为丰富的,尤其是蛋白质,如免疫球蛋白等能够抵抗很多疾病[12]。与常乳相比较,初乳中富含多种功能特性和生物活性的蛋白质,主要包括β-乳球蛋白β-Lg)、α-乳白蛋白(α-La)、多肽、乳清白蛋白(SA)、免疫球蛋白(Ig)和乳铁蛋白(Lf)。β-Lg和α-La含人体所需的几乎全部氨基酸[13],所以有必要对牛、羊初乳中的多肽组分进行分离纯化,以探究对人体有积极作用的氨基酸序列。而已有研究者表明羊乳中的氨基酸种类多于牛乳并且人体所需的必须氨基酸质量分数也较高[14]。
图2描述了第1天牛、羊初乳经过模拟消化后所分离出来的多肽组分。由图2(a)知,第1天的牛初乳经消化后分离出了2种多肽组分,而由图2(b)知,第1天的羊初乳经消化后分离出了3种多肽组分;图3显示了牛、羊初乳第1至7天分离出的组分比较,第1至第7天的牛初乳经过消化后所分离出来的多肽组分没有显著变化,而在第7天,牛初乳中所分出的多肽组分最多有5种。从图3知,第1至第7天羊初乳经过消化后所分离出来的多肽组分有显著的变化,从第1天至第3天,羊初乳所分离出的多肽组分逐渐增多,然后从第4天至第6天又减少了,第7天又增多;第3和第4天中分离出的多肽组分最多。

图2 牛、羊初乳第1天经模拟消化后的多肽分离纯化比较
从图3结果可以初步看出,羊初乳中所分离出的多肽明显多于牛初乳中的,这与牛、羊初乳中蛋白质的组成,结构和大小都有关[15]。
从图3中可以发现,牛、羊初乳第1天第2天的多肽组分均少于后面几天,这可能与挤乳的卫生环境,挤乳方法,挤乳设备有关[16],有可能在开始的第一第二天,有害病原微生物会通过这些途径传播进入到初乳中去,这些有害病原微生物如结核分枝杆菌,沙门氏菌,李斯特菌和大肠杆菌等,或者是有一些病毒引发的炎症[17]。因此第一第二天的初乳我们并不建议将其制成乳制品销售。在模拟人体消化的时候,是一个pH值为2.0的酸性环境,会造成一些大分子蛋白的变性,而前两天的初乳中含有大量大分子蛋白,所以减少了酶解的蛋白量也会导致肽组分的减少。到了第三天以后,蛋白大部分也趋于稳定状态,有些大分子蛋白分解成了小分子,所以酶解后会增加多肽的组分。近年来,鲜有人将牛羊初乳进行模拟消化后比较多肽组分,而本研究的目的就是要探究在人体吃进初乳之后,经过消化后还有哪些多肽组分真正可能作用于人体健康。
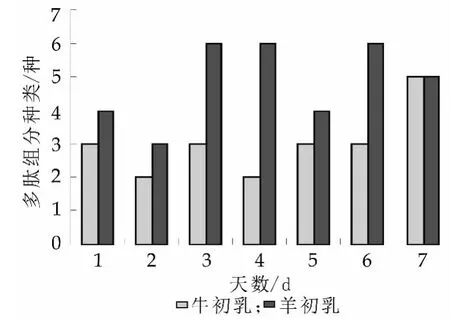
图3 牛、羊初乳第1至7天分离出的多肽组分比较
2.3 小鼠肿瘤坏死因子α(TNF-α)ELISA结果即抗炎功能性分析
图4 为ELISA试剂盒的标准曲线,应用ELISAcalc软件,用标准浓度和OD值计算出来了标准曲线方程为y=(A-D)/[1+(x/C)B]+D,A=0.79643,B=1.19957,C=16.70256,D=0.01166,r2=0.99802。然后通过ELISA试剂盒检测得到了所分离出来的59种多肽组分的OD值,最后计算出来了每种多肽组分中所含有的TNF-α的浓度值,从而确定该组分是否具有抗炎作用。

图4 ELISA标准曲线
竞争性ELISA分析是一种有效的对样品中抗原定量的免疫分析系统[18]。小鼠肿瘤坏死因子TNF-α已经被确立为是一种与炎症相关的细胞因子,并且在炎症疾病中均可发现,如风湿性关节炎,回肠炎,细胞壁硬化或葡萄膜炎等。很多治疗炎症的策略集中在了降低TNF-α[7]。具有抗炎作用的多肽可以与由LPS脂多糖诱导的TNF-α相互作用从而降低其对人体的伤害。本研究通过检测分离出的59种多肽组分中的TNF-α浓度,可以确定哪些多肽组分对人体具有抗炎作用。
表1显示了59种多肽组分中的TNF-α的浓度值,阳性对照值为18.52±0.027 ng/L,即LPS达到最大值且没有样品作用;阴性对照值为2.05±0.015 ng/L,即没有LPS作用。从表中可以看出,所有乳样品中小鼠肿瘤坏死因子TNF-α的浓度范围是2.42±0.006 ng/L~18.03±0.102 ng/L,与阳性对照18.52±0.027 ng/L相比,所有分离出的多肽组分均降低了TNF-α的浓度,表明其均具有抗炎作用,只是作用的程度有所不同,通过比较发现,羊初乳第3天第1种多肽组分和第7天第1种多肽组分,牛初乳第3天第1种多肽组分和第7天第1种多肽组分均显著的降低了TNF-α的浓度,所以其抗炎性能优于其他组分,并且羊初乳降低TNF-α的浓度的幅度大,显示出较好的抗炎性能;综上,羊初乳第3天中含有的一种多肽中的TNF-α的浓度最低,所以其相比较其他组分显示出最好的抗炎性能。

表1 每种肽组分中的TNF-α的浓度值(n=3)
3 结 论
⑴从牛初乳中分离出了23种多肽,从羊初乳中分离出了36种多肽,羊初乳中的多肽种类多于牛初乳。
⑵通过检测,所有乳样品中小鼠肿瘤坏死因子TNF-α的浓度范围是(2.42±0.006)~(18.03±0.102) ng/L,与阳性对照(18.52±0.027)ng/L相比,所有分离出的多肽均具有抗炎作用。
⑶通过比较,羊初乳第3天中含有的一种多肽显示出最好的抗炎性能,羊初乳的抗炎性能优于牛初乳。
[1]臧卜箴,臧金武.天然食品-牛初乳[J].食品工业科技,1999,(增刊):101-103.
[2]马玉敏,王恬,初乳中生长因子对肠道生长发育的影响[J].动物科学与动物医学,1999,16(3):14-16.
[3]B.TESSIER C,HARSCOAT_SCHIAVO C,MARC I.Selective Separation of Peptides Contained in a Rapeseed (Brassica campestris L.)Protein Hydrolysate Using UF/NF Membranes[J].J.Agric.Food Chem,2006,54:3578-3584.
[4]CRISTINA M,JUSTO P,MAR D,et al.Affinity Purification of Angiotensin Converting Enzyme Inhibitory Peptides Using Immobilized ACE[J].J.Agric.Food Chem,2006,54:7120-7124.
[5]吴慧,卢蓉蓉,凌玉芳,周蕊.乳清蛋白抗氧化肽的分离纯化及序列分析[J].食品与发酵工业,2010,36(10):6-10.
[6]J G LEBLANC C;MATAR J C,VALDEZ J,et al.Immunomodulating Effects of Peptidic Fractions Issued from Milk Fermented with Lactobacillus helveticus[J].J.Dairy Sci,2002,85(11)?:2733-2742.
[7]MASLI S,TURPIE B.Anti-inflammatory effects of tumour necrosis factor(TNF)-α are mediated via TNF-R2(p75)in tolerogenic transforming growth factor-β-treated antigen-presenting cells[J].Immunology,2009,127(1):62-72.
[8]YAN D,CHEN D,SHEN J,et al.Bovine Lactoferricin is Anti-Inflammatory and Anti-Catabolic in Human Articular Cartilage and Synovium.J.Cell[J].Physiol,2013,228:447–456.
[9]CLARKS S,SHERBON J W.Genetic variants of alpha(s1)-CN in goat milk:breed distribution and associations with milk composition and coagulation properties[J].Small Rumin Res,2000,38(2):135-143.
[10]JASMIN M,ALEXANDER S,ANDREAS H,et al.Analysis of the Peptide Profile of Milk and Its Changes during Thermal Treatment and Storage[J].J.Agric.Food Chem,2008,56,2899–2906.
[11]GAGNAIRE V,JARDIN J,JAN G,et al.Invited review:Proteomics of milk and bacteria used in fermented dairy products:From qualitative to quantitative advances[J].J.Dairy Sci,2009,92:811-825.
[12]FOLEY J,OTTERBY D.Availability,storage,treatment,composition,and feeding value of surplus colostrums:A review[J].J.Dairy Sci,1978,61:1033–1060.
[13]PECIULAITIENE N,MISEIKIENE R,BALTRENAITE L,et al.Genetie differences among native and modern cattle breeds in Lithuania based on milk protein loci polymorphise[J].Pol J Vet Sci,2007,10(1):35-41.
[14]SILANIKOVE N,LEITNER G,MERIN U,et al.Recent advances in exploiting goat’s milk:Quality,safety and production aspects[J].Small Ruminant Research,2010,89:110-124.
[15]CEBALLOS L S,MORALES E R,ADARVE G T,et al.Composition of goat and cow milk produced under similar conditions and analyzed by identical methodology[J].J Food Compos Anal,2009,22(4):322-329.
[16]A J TRUJILLO N,CASTRO J M,QUEVEDO A,et al.Effect of Heat and High-Pressure Treatments on Microbiological Quality and Immunoglobulin G Stability of Caprine Colostrum[J].J.Dairy Sci,2007,90:833-839.
[17]GUERRAULT P.Apport de colostrum:Plusieurs methodes[J].La Chevre,1990,180:30–31.
[18]ROSA P,MARIA A,ROSA S,et al.Specific Detection of the A-madori Compounds in Milk by Using Polyclonal Antibodies Raised against a Lactosylated Peptide§[J].J.Agric.Food Chem,1998,46:5373-5379.
