PLLA/PVA*电纺制备 复合纳米纤维膜及其吸水性研究
2014-07-09赵瑨云陈良壁
赵瑨云 陈良壁
(福建省高校绿色化工技术重点实验室/武夷学院生态与资源工程学院 福建武夷山 354300)
为了满足功能化材料发展的需求,纳米技术作为一个交叉学科领域得到了广泛的发展。由于纳米纤维大的长径比和高的比表面积,其显示出良好的尺寸效应。纳米纤维膜的形貌与细胞外基质非常相似,因此其可作为组织工程支架材料使用[1]。作为组织工程支架材料除了应具有可降解性和生物相容性外,其应具备满足细胞生长和繁殖所需的机械强度[2,3]。聚乳酸 (PLLA)由于其来源广泛、无毒、无刺激性,是一种具有优良的生物相容性和可生物降解性的材料。已成为最具发展潜力的可生物降解材料[6-7]。但是由于PLLA的亲水性差,细胞难以在支架上粘附并生长。并且PLLA比较脆,力学性能较差,使其应用受到了一定程度的限制[8,9]。目前一些亲水性的聚合物如:聚 乙 二醇 (PGE)[8]、聚 乙烯 吡 咯 烷 酮(PVP)[9]、PVA[10]等已与支架共混,提高支架膜的透水性及其力学强度。聚乙烯醇 (PVA)是一种亲水性优良、对人体无毒,无副作用,具有良好的生物相容性并可降解的水溶性高分子,使其在工程材料领域具有广泛地应用前景[13]。由于共混后的支架材料具有很好的组织相容性、可渗透性,使其作为药物和蛋白质释放的载体。
静电纺丝是一项简单易行、“自上而下”制备纳米纤维膜的技术。电纺制备的膜是由无数纳米纤维组成的多孔膜,其形貌与细胞外基质结构非常相似。因此电纺纤维膜可作为细胞粘附生长的支架材料使用。Inoue等[14]人研究认为 PLLA与PVA之间的相容性取决于两者之间的组分,且PVA分子中的羟基与PLLA分子中的羰基形成氢键是两者相容性提高的主要原因。Sheetal等[13]人通过分子模拟预测共混物之间的相容性,表明PLLA与PVA分子之间具有一定的相容性。
本文以PLLA与PVA为成膜物,DMSO为溶剂通过静电纺丝方法制备PLLA/PVA复合纳米纤维膜,研究了两者之间的相容性及其PVA的加入对纤维膜的形貌、亲水性及其孔隙率的影响。
1 实验部分
1.1 原料
聚乳酸 (PLLA),Mw=1.0×105,深圳光华伟业实业有限公司;聚乙烯醇 (PVA),聚合度为1700,醇解度99%,上海国药试剂厂,二甲亚砜(DMSO)分析纯,上海国药试剂厂;其它试剂均为市售分析纯。
1.2 PLLA/PVA复合纳米纤维膜的制备
将5g的PLLA和0.5g的PVA溶解在 DMSO溶剂中,配置成质量浓度为10wt%的纺丝液,常温下磁力搅拌10h,使其完全溶解,形成均一纺丝溶液。把纺丝液装入内径为16mm,体积为10mL的注射器 (针头规格为18)中,然后将该注射器安置在微量注射泵上。将高压电源的正电极夹在注射器的金属针头上,另一个电极与距针头15cm的铝箔纸收集板相连。利用微量注射泵的推力把纺丝液从注射器的针头挤出,在针头形成Taylor锥体,在高压电场力作用下纺丝液被抽拉成丝。纺丝过程中的供料速度1mL/h。制得的 PLLA/PVA复合纳米纤维膜于80℃真空干燥12h,以便去除残余溶剂。真空干燥后,把膜放在干燥器中备用。利用相同的方法制备PLLA纳米纤维膜和PVA纳米纤维膜
1.3 PLLA/PVA复合多孔膜的结构表征
1.3.1 表面形貌测定 PLLA/PVA复合纳米纤维膜的形貌用SEM测量 (JMS-7500F),样品表面经过喷金处理,采用SEM自带的软件Smile-view(versions 2.0)测量纤维直径大小,每组数据取100根纤维测量,后取平均值。
1.3.2 接触角测定 PLLA/PVA复合纳米纤维膜的接触角采用SL2008型接触角仪 (上海梭伦信息科技有限公司)测量,测量时温度为25℃。
1.3.3 孔隙率测定 选用一个比重瓶装满乙醇,称重W1,把重Ws的样品浸入乙醇中,真空脱气,务必使乙醇充满纤维膜,然后再加满乙醇,称重为W2;把浸满了乙醇的纤维膜取出后,剩余的乙醇与比重瓶称重W3。纤维膜的孔隙率按以下公式计算,

1.3.4 吸水率测定 将PLLA/PVA复合纳米纤维膜干燥至恒重称量W1,后在室温下浸泡在蒸馏水中,每隔一段时间后取出,迅速用滤纸吸干表面水后测其质量 W2,按下列公式计算吸水率(WB):

2 结果与讨论
PLLA和PVA溶液都可以溶解在DMSO溶剂中,后将这两个溶液混合,在常温下磁力搅拌,溶液仍然澄清透明,说明PLLA和PVA在DMSO溶剂中的相容性比较好。主要是因为PVA分子链的羟基与PLLA分子上的羰基形成氢键,从而提高了PLLA与PVA之间的相容性[12]。
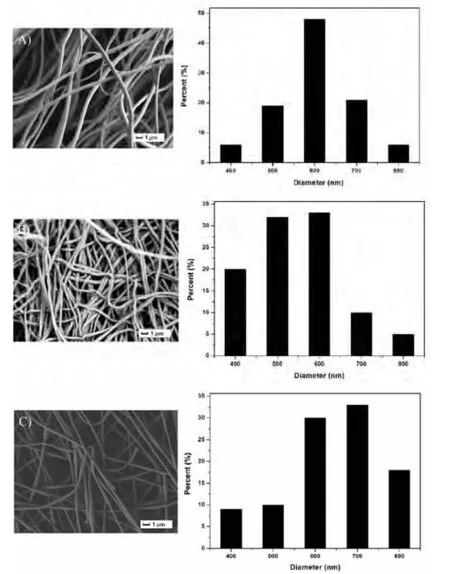
图1 纳米纤维的扫描电镜图
图1A为质量浓度为10 wt%PLLA/DMSO溶液通过静电纺丝方法制备的PLLA纳米纤维膜,从图1A中可知制备的纤维表面光滑,纤维直径为600±76nm(见表1)。相比较而言,质量浓度为10wt%PVA/DMSO溶液,通过电纺制备的纤维如图1B所示,从图IB中可知,纤维表面光滑,但纤维发生了一定程度的扭曲,可能是纤维纺丝后处理过程中所导致的。纤维的直径大小为450±58nm(见表1),直径分布也较窄。表1根据以上所得,PLLA和PVA都可以在DMSO的溶剂中,通过电纺得到表面光滑、均一的纤维。因此仍然以DMSO为溶剂,PLLA:PVA=9:1(w/w)为溶剂,在不改变其它条件下,通过电纺制备PLLA/PVA复合纳米纤维膜,如图1C所示。从图1C中可知,制备的纤维表面光滑,直径为650±110nm(见表1),相比较纯的PLLA和PVA纳米纤维而言,纤维的形貌几乎没有发生改变,但是纤维的直径增大了。这主要是由于PLLA/PVA混合溶液的粘度比相同浓度的PLLA和PVA溶液的粘度大,因此在静电纺丝过程中就更难以被拉伸,因此纤维的直径变大。图2A为通过数码相机拍照得到的纤维膜形貌,纤维膜呈现乳白色不透明。不透明的主要原因是纤维为多孔材料,光通过纤维时发生了一定程度的折射现象[14]。图2B为PLLA/PVA复合纳米纤维的显微镜图,从图中可知纤维非常均匀,没有缺陷 (如珠子、珠串结构等)。说明PLLA和PVA在DMSO溶剂中相容性非常好,而且在电纺过程中,也不会发生相分离。因此当DMSO溶剂发挥后,就形成了相容性非常好的PLLA/PVA复合纳米纤维。
水接触角是表征材料亲水性非常重要的指标。接触角越小表明材料的亲水性越好。从表1可知,PLLA纳米纤维膜的接触角为92±5°,表明PLLA纳米纤维膜是强疏水性材料,这主要是由于PLLA疏水性材料,因此其制备的纳米膜也是疏水性的材料。相比较而言,PVA纳米纤维膜的接触角为31±3°,说明PVA纳米纤维膜是亲水性材料,主要因为PVA分子量上有大量的羟基,因此其亲水性比较好。PLLA/PVA复合纳米纤维膜的接触角为58±3°,说明在 PLLA材料中加入10 wt%的PVA,材料的亲水性得到了很大程度的改善。主要因为加入的PVA材料分子链上的羟基对改善PLLA/PVA复合纳米纤维膜起到了非常关键的作用。
作为一个组织工程支架材料,细胞渗透对细胞的生长起到了关键的作用,而营养和氧气必须扩散到细胞中且代谢产物必须从细胞中去除。因此组织工程支架材料必须是多孔结构,这样才有利于细胞的渗透和养分的传输。从表1中可知,PLLA和PVA纳米纤维膜的孔隙率分别为85%和70%,虽然PVA纳米纤维膜的直径比较小,但是PVA是一个强亲水性材料,在溶剂挥发后,由于空气中的水蒸气会使PVA纳米纤维膜上的纤维发生一定程度的粘结,因此其孔隙率有所降低。PLLA/PVA复合纳米纤维膜的孔隙率为82%,说明加入10wt%的PVA后,纤维膜的孔隙率略有降低。也是由于PVA上的羟基的亲水性导致的。
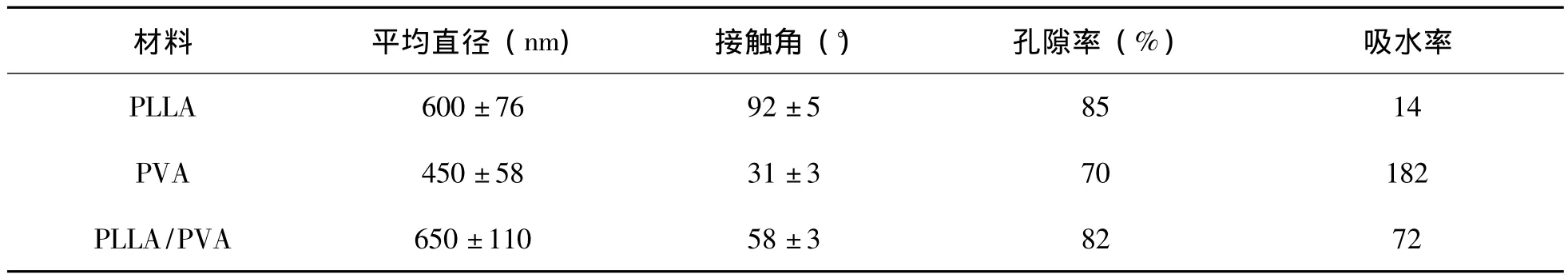
表1 PLLA/PVA复合纳米纤维膜的平均直径、接触角、孔隙率和吸水率
为了使细胞黏附、扩散、分裂和显型都能够得到控制直至一个新的组织的形成,支架材料必须具有一定吸水性。图3为PLLA、PVA和PLLA/PVA复合纳米纤维膜的吸水性实验。从图3中可知,PLLA纳米纤维膜在10h基本上达到吸水平衡,且吸水率为14%(见表1),说明PLLA纳米纤维膜是疏水性材料。而PVA纳米纤维膜在40h后达到吸水平衡,吸水率为182%(见表1),说明PVA纳米纤维膜是亲水性材料。PLLA/PVA纳米纤维膜的吸水率为72%(见表1),相比较PLLA纳米纤维膜而言,加入10 wt%的PVA后,材料的吸水性得到了很大程度的提高。
3 结论
PLLA纳米纤维膜是一个疏水性的材料,加入10wt%亲水性的PVA后制备的PLLA/PVA复合纳米纤维膜的亲水性得到了很好的改善。由于电纺制备的纤维膜为多孔性材料且与细胞外基质形貌非常相似。因此PLLA/PVA复合纳米纤维膜有利于细胞的黏附与生长,因而有望作为组织工程支架材料。

图2 PLLA/PVA复合纳米纤维膜
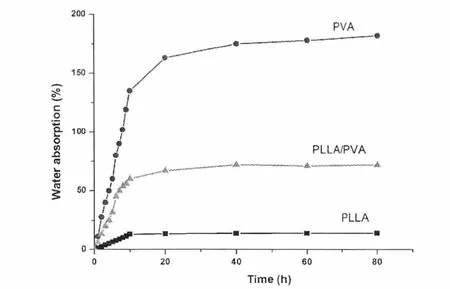
图3 PLLA/PVA复合纳米纤维膜吸水实验
[1] Matthews JA,Wnek GE,Simpson DG,et al.Electrospinning of collagen nanofibers [J].Biomacromolecules.2002,3(2):232.
[2] Liang D,Hsiao BS,Chu B.Functional electrospun nanofibrous scaffolds for biomedical applications [J].Advanced Drug Delivery Reviews,2007,59(14):1392.
[3]Holzwarth JM,Ma PX.Biomimetic nanofibrous scaffolds for bone tissue engineering[J].Biomaterials,2011,32(36):9622.
[4]Garlotta D.A literature review of poly(lactic acid) [J].Journal of Polymers and the Environment.2001,9(2):63.
[5] Wu CS.Improving polylactide/starch biocomposites by grafting polylactide with acrylic acid–characterization and biodegradability assessment[J].Macromo Biosci,2005,5(4):352.
[6] Martin O,Averous L.Poly(lactic acid):plasticization and properties of biodegradable multiphase systems [J].Polymer,2001,42(14):6209.
[7] Meneghello G,Parker DJ,Ainsworth BJ,et al.Fabrication and characterization of poly(lactic-co-glycolic acid)/polyvinyl alcohol blended hollow fibre membranes for tissue engineering applications[J].Journal of Membrane Science.2009,344(1-2):55.
[8] Lin WJ,Lu CH.Characterization and permeation of microporous poly(ε -caprolactone)films[J].Journal of Membrane Science,2002,198(1):109.
[9] Kondolot Solak E,Asman G.Sorption,diffusion,and pervaporation characteristics of dimethyl-formamide/water mixtures using sodium alginate/polyvinyl pyrrolidone blend membranes [J].Vacuum,2008,82(6):579.
[10]Tiwari SK,Tzezana R,Zussman E,et al.Optimizing partition -controlled drug release from electrospun core-shell fibers[J].International Journal of Pharmaceutics,2010,392(1-2):209.
[11] Ramires P,Milella E.Biocompatibility of poly(vinyl alcohol) -hyaluronic acid and poly(vinyl alcohol) -gellan membranes crosslinked by glutaraldehyde vapors[J].Journal of Materials Science:Materials in Medicine,2002,13(1):119.
[12] Shuai X,He Y,Asakawa N,et al.Miscibility and phase structure of binary blends of poly(L-lactide)and poly(vinyl alcohol)[J].Journal of Applied Polymer Science,2001,81(3):762.
[13]Jawalkar SS,Aminabhavi TM.Molecular modeling simulations and thermodynamic approaches to investigate compatibility/incompatibility of poly(l-lactide)and poly(vinyl alcohol)blends[J].Polymer,2006,47(23):8061.
[14] Chen GFS,Liu HQ.Electrospun cellulose nanofiber reinforced soybean protein isolate composite film [J].Journal of Applied Polymer Science,2008,110(2):641.
