大蒜素增强脑胶质瘤细胞株U87对TRAIL敏感性的机制研究
2014-07-07张凤香孙大鹏贺成业韩冠英
张凤香,孙大鹏,贺成业,韩冠英
辽宁医学院附属第一医院,辽宁锦州 121001
大蒜素增强脑胶质瘤细胞株U87对TRAIL敏感性的机制研究
张凤香,孙大鹏,贺成业,韩冠英
辽宁医学院附属第一医院,辽宁锦州 121001
目的 研究大蒜素是否能通过增加脑胶质瘤细胞U87对肿瘤坏死因子相关凋亡诱导配体(tumor necrosis factor-related apoptosis-inducing ligand,TRAIL)的敏感性来促进U87细胞的凋亡及其相关机制的研究。方法 采用MTT法检测大蒜素联合TRAIL对U87细胞活性的影响;流式细胞术(Annexin V/FITC)评估大蒜素联合TRAIL对U87细胞凋亡的影响;Transwell实验进一步检测大蒜素联合TRAIL对U87细胞的侵袭能力的影响;Western-blot、RT-PCR和Q-RT-PCR方法检测大蒜素联合TRAIL对与U87细胞凋亡相关的基因和蛋白的表达影响。结果 与其他组比较,大蒜素联合TRAIL明显降低U87细胞活力和侵袭能力,促进U87细胞凋亡。在分子水平上,与单独作用组比较,联合作用组明显增加DR4、DR5、Caspase-3和Caspase-8的活性,而AKT、pFKHR、MMP-2和MMP-9的活性明显被抑制。结论 大蒜素能增强脑胶质瘤细胞U87对TRAIL的敏感性,从而促进U87凋亡。
大蒜素;肿瘤坏死因子相关凋亡诱导配体;胶质瘤细胞系U87
肿瘤坏死因子相关凋亡诱导配体(tumor necrosis factor-related apoptosis-inducing ligand,TRAIL)是肿瘤坏死因子家族中的重要一员。研究表明,TRAIL可以通过与死亡受体DR4或DR5链接,激活Caspase-8促凋亡途径,进而诱导肿瘤细胞凋亡[1]。但是某些肿瘤细胞对TRAIL的这种抗凋亡作用有抵抗性[2]。最近的研究表明,对TRAIL具有耐药性的某些肿瘤细胞可以通过联合化疗作用增强其对TRAIL的敏感性,这表明联合治疗可能克服肿瘤细胞对TRAIL的耐药性[3]。脑胶质瘤是人类脑部主要的一种肿瘤,大量研究表明,其癌症细胞对TRAIL有很强的耐药性[4-5]。因此,寻找一种能够增强脑胶质瘤细胞对TRAIL敏感性的治疗方法十分重要。大蒜素作为一种药物已被广泛使用,并对人体健康产生了积极的影响[6]。研究证明,大蒜及其制剂可以减少前列腺癌、结肠癌、喉癌和胃癌的发病率,对肝癌的治疗作用也已经通过动物实验得到了证实[7-8]。大蒜素还可以使乳腺癌细胞等肿瘤细胞对TRAIL的敏感性增强[9]。但大蒜素是否能增强脑胶质瘤细胞对TRAIL的敏感性尚不得而知。因此,本课题选取对TRAIL具有耐药性的脑胶质瘤细胞U87作为研究对象,研究大蒜素是否能对TRAIL诱导的脑胶质瘤细胞凋亡产生影响。
材料和方法
1 材料 人脑胶质瘤细胞U87(中国科学院);重组人可溶性TRAIL(Peprotech);RPMI-1640,小牛血清(Hyclone)Leibovitz's L-15培养基(Gibco);四甲基偶氮唑蓝(dimethylthiazolyl-2,5-diphenyltetrazolium bromide,MTT)和二甲基亚砜(dimethyl sulfoxide,DMSO)(Sigma);青霉素、链霉素(大连美罗);Annexin V-FITC/PI试剂盒(欣博盛生物科技有限公司);兔抗人AKT,兔抗人pFKHR,鼠抗人Caspase-3、Caspase-8单克隆抗体,兔抗人MMP2、MMP9多克隆抗体均购自Abcam公司;山羊抗兔IgG,山羊抗鼠IgG购自中杉金桥;RTPCRkits和基因特异性引物(Takara)。
2 U87细胞的培养与传代 人U87细胞用含10%胎牛血清、100 U/ml青霉素、100 μg/ml链霉素的Leibovitz's L-15培养基,在5% CO2、37℃恒温箱中培养。每2 ~ 3 d更换1次培养液,至第5天细胞达到合适密度,用0.25%胰蛋白酶消化1 min,置显微镜下观察。当细胞将要分离而呈圆粒状时,弃掉胰酶,加入适量的培养液,反复吹打贴壁细胞,将细胞悬液按1∶2稀释,传到新培养瓶中,继续培养。
3 MTT检测U87细胞的增殖 取对数生长期细胞,0.25%胰酶消化,调整细胞浓度为5×104/ml,按每孔200 μl接种于96孔板,按0 ng/ml、10 ng/ml、20 ng/ml、50 ng/ml、100 ng/ml TRAIL或10 μg/ml、20 μg/ml、30 μg/ml、40 μg/ml、50 μg/ml Allicin添加,每组设4个平行孔,每孔反应体系总体积为200 μl,37℃、无CO2条件下培养,分别于24 h、48 h和72 h时,每孔加入新鲜配制的浓度为5 mg/ml MTT 20 μl,继续培养4 h。吸去培养液,每孔加入150 μl DSMO,微量振荡器上振荡10 min,室温孵育30 min后放入酶标仪,以490 nm波长检测光密度值(OD)。
4 AnnexinⅤ-FITC/PI检测U87细胞的凋亡 培养48 h后收集各组细胞,调整细胞浓度至1×106/ml,以冷PBS洗2次并用1×Binding Buffer重悬,每组分别取100 μl移至新管,加入5 μl FITC AnnexinⅤ及5 μl PI,振荡后于室温下避光静置15 min,每管加入400 μl 1×Binding Buffer,染色后上流式细胞仪检测。
5 Transwell检测U87细胞的侵袭能力 将Matrigel与L-15培养基按1∶4稀释,在Transwell上室中加入40 μl的Matrigel稀释液,37℃孵育12 h,使胶凝固。各组细胞用含0.1% BSA的无血清培养基重新悬浮,调整细胞浓度至2×105/ml。取100 μl细胞加入上室,500 μl含10%血清培养基加入下室,每组设3个复孔,于CO2孵箱培养48 h后,取出小室,用棉签蘸取PBS轻轻擦掉上膜细胞,小室以甲醇固定15 min,PBS洗涤3次,每次5 min;结晶紫染色15 min,PBS洗涤3次,每次5 min,后镜下观察,每个滤膜随机取5个视野(100×),取均值计数,照相分析。
6 RT-PCR和qRT-PCR检测相关基因表达收集并计数各组细胞,按5×106个细胞加1 ml RNAiso Plus提取细胞总RNA,经紫外分光光度计检测RNA浓度,参照反转录试剂盒说明书进行反转录反应。反转录PCR法检测;DR4:forward 5' GGAACACAGCATGTCAGTGCAA 3',reverse5' TGTCACTCCAGGGCGTACAATC 3';DR5:forward 5' AGCTAAGTCCCTGCACCACGA 3',reverse5' TGTACAATCACCGACCTTGACCA 3';caspase3:forward 5' GACTCTGGAATATCCCTGGACAACA 3',reverse 5'CTGAGGTTTGCTGCATCGACA 3';caspase8: forward 5' CCAAATGCAAACTGGATGATG AC 3', reverse 5' CTCTTGTTGATTTGGGCACAGAC 3'。MMP2: forward 5' AGCTAAGTCCCTGCACCACG A 3',reverse 5' TGTACAATCACCGACCTTGACCA 3';MMP9:forward 5' CAACAACCATGCTGGGCATC 3',reverse 5' TGATGTCAGTCACTTGGGCATTAAC 3';AKT:forward 5' TCCTGGTTGTCCTAGCTGTC 3',reverse5' CAGGCTTTACAAGTGATGAG 3';p-FHKR:forward 5' GAAGGTGAAGGTCGGAGTC 3',reverse5' GAAGATGGTGATGGGATTTC 3'。扩增条件为:95℃ 30 s;94℃ 5 s,61℃ 30 s,共30个循环。
7 Western blot检测相关蛋白表达 收集各组细胞,PBS洗2次,以裂解缓冲液提取细胞总蛋白。每孔40 μg的含量加样,电泳分离。转至PVDF膜上,5%脱脂奶粉在37℃封闭2 h。分别与1∶300兔抗人DR4、DR5;1∶2 000鼠抗人Caspase3、Caspase8;1∶600兔抗人MMP2、MMP9;1∶1 000兔抗人AKT和pFHKR等抗体4℃孵育过夜。TBST洗膜3次,每次10 min,后加入辣根过氧化物酶标记的山羊抗鼠IgG(1∶500)羊抗兔IgG(1∶500),4℃孵育2 h。洗膜3次,每次10 min。ECL发光试剂盒发光显影,凝胶成像。
8 统计学方法 所有数据均用SPSS13.0软件进行统计分析,结果用±s表示,采用ANOVA分析。P<0.05为差异有统计学意义。
结 果
1 大蒜素可增强U87细胞对TRAIL的敏感性抑制细胞活性 在U87细胞中当TRAIL剂量≤50 ng/ml时,细胞活力为75.67%±4.93%。当TRAIL剂量增至200 ng/ml或延长至72 h时,细胞活力没有降低(图1A)。在U87细胞中,30 μg/ml大蒜素+ 50 ng/ml TRAIL细胞活力从71.21%±0.07%明显降到29.02%±3.16%,而20 μg/ml大蒜素+ 50 ng/ml TRAIL不能进一步增加细胞毒性。提示30 μg/ml大蒜素+ 50 ng/ml TRAIL可降低U87细胞的生存能力(图1C)。
2 大蒜素可增加U87细胞对TRAIL的敏感性诱导凋亡 在U87细胞加入50 ng/ml TRAIL和(或) 30 μg/ml大蒜素作用48 h后,流式细胞仪检测显示,大蒜素+ TRAIL组凋亡率为76.30%,大蒜素组为15.94%,TRAIL组为28.8%。与其他组比较,大蒜素+ TRAIL组明显促进细胞凋亡。见图2。
3 大蒜素可增加U87细胞对TRAIL的敏感性降低侵袭能力 培养48 h后,与其他组相比大蒜素+ TRAIL组,U87细胞的侵袭能力被显著抑制。见图3。
4 大蒜素和TRAIL对U87细胞内DR4和DR5表达的调控 TRAIL仅轻微诱导DR4和DR5的表达。大蒜素和TRAIL联合作用明显增强DR4和DR5的表达。见图4。
5 大蒜素和TRAIL对U87细胞内Caspases家族表达的调控 大蒜素+ TRAIL组明显增强Caspase-3、Caspase-8的表达。见图5。
6 大蒜素和TRAIL对U87细胞内MMPs家族表达的调控 大蒜素+ TRAIL组明显抑制MMP-2和MMP-9的表达。见图6。
7 大蒜素和TRAIL对U87细胞内Akt和pFKHR表达的调控 大蒜素+TRAIL组能更有效地下调Akt和pFKHR表达。见图7。
讨 论
在该研究中,我们检测大蒜素是否能增加U87对TRAIL的敏感性,从而进一步促进细胞的凋亡,并对其分子机制进行了研究。MTT和Annexin V/ FITC检测结果表明,TRAIL和大蒜素联合治疗能够明显降低U87细胞活力并促进U87细胞凋亡。Transwell检测结果表明,与其他组比较,大蒜素和TRAIL联合作用组的U87细胞侵袭能力被明显抑制。以上结果表明,大蒜素和TRAIL联合治疗可以明显抑制U87细胞活力和侵袭能力,并促进细胞凋亡。

图 1 大蒜素和(或)TRAIL对U87细胞活性的影响Fig. 1 Effects of allicin and/or TRAIL on U87 cells viability
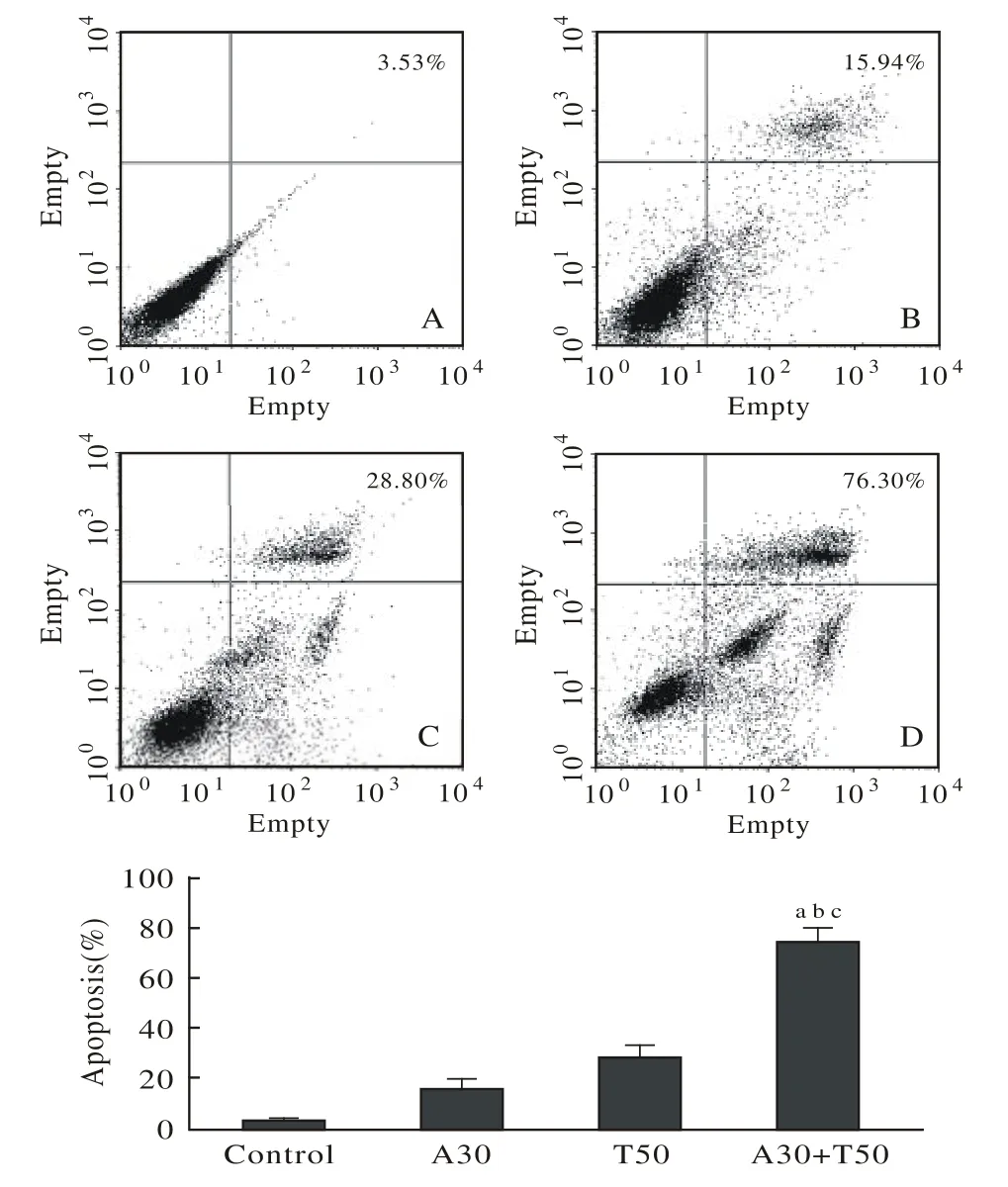
图 2 流式细胞术分析显示作用48 h后TRAIL + Allicin组可明显促进细胞凋亡Fig. 2 Flow cytometry analysis showed that TRAIL + Allicin group could significantly enhance apoptosis in cells after 48 h
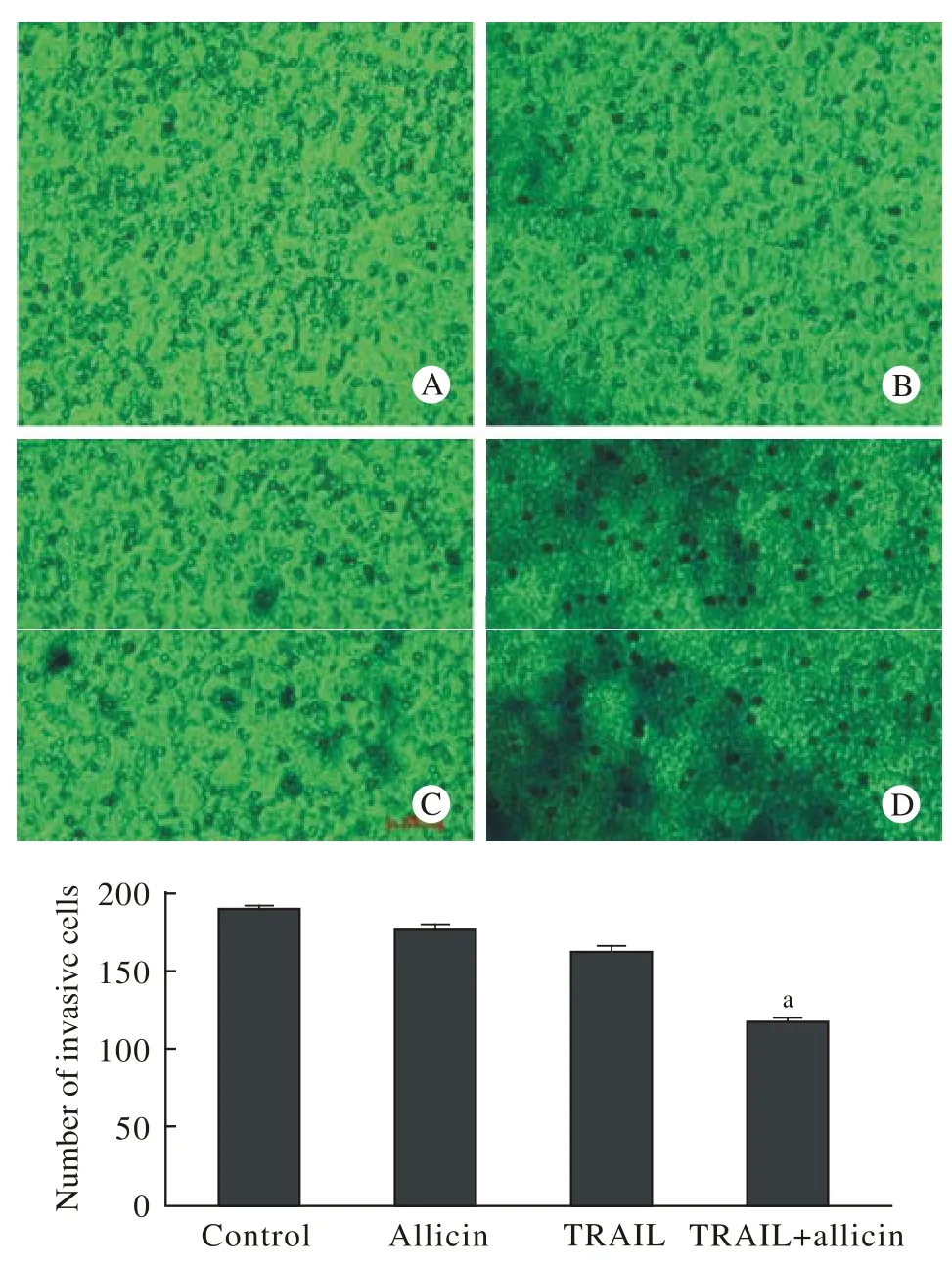
图 3 Transwell分析结果显示作用48 h后TRAIL + Allicin组可明显抑制细胞的侵袭Fig. 3 Transwell analysis showed that TRAIL + Allicin group could inhibit invasion of cells after 48 h A: control;B:allicin;
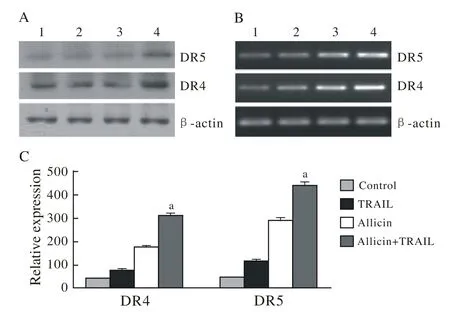
图 4 TRAIL和(或) Allicin对DR4和DR5表达的影响 A:Western blot检测DR4和DR5的蛋白表达情况; B:RT-PCR检测DR4和DR5的mRNA表达情况; C:q-PCR检测DR4 和DR5的表达情况Fig. 4 Effect of TRAIL and/or allicin on the expression of DR4 and DR5 A: Western blot analysis showing the protein expression of DR4 and DR5; B: Real-time-PCR analysis showing the mRNA expression of DR4 and DR5; C: Q-RTPCR analysis showing the expression of DR4 and DR5

图 5 TRAIL和(或) Allicin对Caspase-3和Caspase-8表达的影响A:Western blot检测Caspase-3和Caspase-8的蛋白表达情况; B:RT-PCR检测Caspase-3和Caspase-8的mRNA表达情况;C:q-PCR检测Caspase-3和Caspase-8的表达情况Fig. 5 Effect of TRAIL and/or allicin on the expression of caspase-3 and caspase-8 A: Western blot analysis showing the protein expression of caspase-3 and caspase-8; B: Real-time-PCR analysis showing the mRNA expression of caspase-3 and caspase-8; C: Q-RTPCR analysis showing the expression of caspase-3 and caspase-8
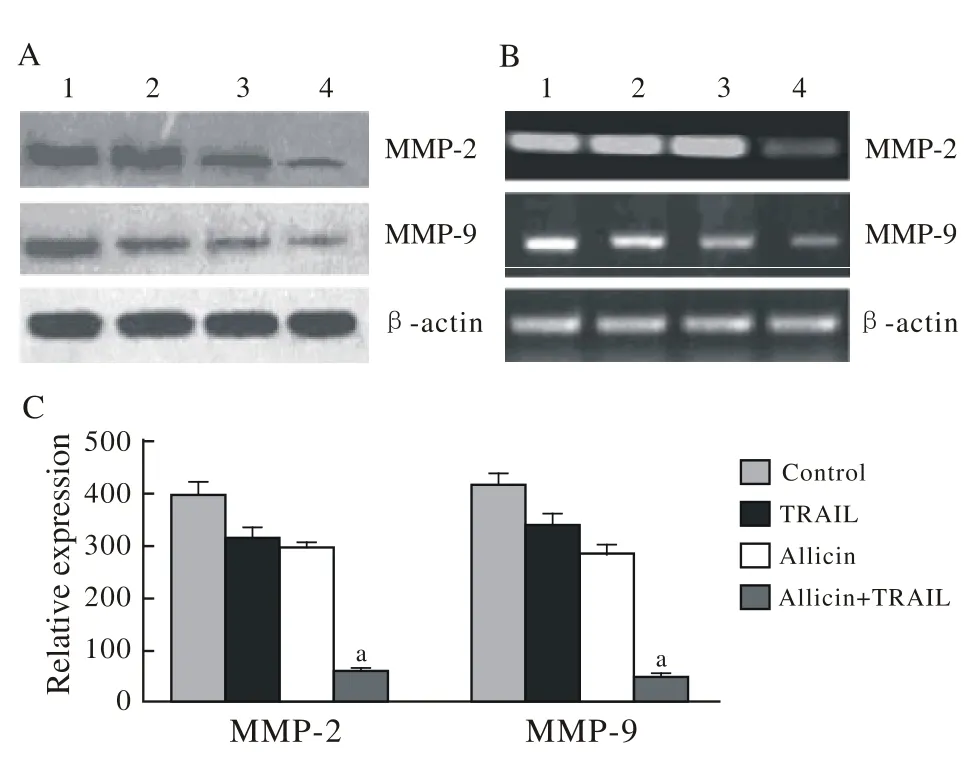
图 6 TRAIL和(或) Allicin对MMP-2和MMP-9表达的影响A:Western blot检测MMP-2和MMP-9的蛋白表达情况;B:RT-PCR检测 MMP-2和MMP-9的mRNA表达情况;C:q-PCR检测MMP-2和MMP-9的表达情况Fig. 6 Effect of TRAIL and/or allicin on the expression of MMP-2 and MMP-9 A: Western blot analysis showing the protein expression of MMP-2 and MMP-9; B: Real-time-PCR analysis showing the mRNA expression of MMP-2 and MMP-9; C: Q-RT-PCR analysis showing the expression of MMP-2 and MMP-9

图 7 TRAIL和(或) Allicin对Akt和pFKHR表达的影响A:Western blot检测Akt和pFKHR的蛋白表达情况; B:RTPCR检测Akt和pFKHR的mRNA表达情况; C:q-PCR检测Akt和pFKHR的表达情况Fig. 7 Effect of TRAIL and/or allicin on the expression of Akt and pFKHR A: Western blot analysis showing the protein expression of Akt and pFKHR; B: Real-time-PCR analysis showing the mRNA expression of Akt and pFKHR; C: Q-RTPCR analysis showing the expression of Akt and pFKHR
众所周知,TRAIL是通过与DR4和DR5的相互作用来触发凋亡信号,然后引起Caspase-8介导的细胞凋亡,而在该过程中DR4和DR5起到了核心作用。而TRAIL只有在表达DR4和DR5的肿瘤细胞中才能起到诱导细胞凋亡的作用。本研究表明,与其他组比较,大蒜素和TRAIL联合治疗明显增强DR4和DR5的表达。该研究结果表明,上调DR4和DR5的表达可能在大蒜素增强U87细胞对TRAIL敏感性的过程中起到了重要作用。最近有研究报道,一些化疗药物可以通过激活Caspase-3的活性来使一些本来对TRAIL有耐药性的肿瘤细胞恢复对TRAIL的敏感性。Caspase-3是凋亡蛋白酶家族的一员,是凋亡通路的重要组成部分。我们的研究结果发现,在TRAIL联合大蒜素促进胶质瘤细胞凋亡的过程中,Caspases家族是引发细胞凋亡的关键调节点。
基质金属蛋白酶几乎能降解细胞外基质中的所有蛋白成分,在肿瘤侵袭转移中起关键性作用[10-11]。本研究结果显示,大蒜素和TRAIL联合作用组比单独作用组能更有效地抑制MMP-2和MMP-9的表达。该研究结果表明,大蒜素可通过提高TRAIL的活性降低MMP-2和MMP-9的表达,从而抑制U87细胞生长。
有研究发现,Akt是一些抗癌药物的关键靶点[12]。而叉头转录因子家族是作为Akt介导的细胞凋亡系统下游的一个靶点。在Akt促进细胞存活的机制中,活化的Akt可以通过磷酸化FKHR转录因子使其失活,从而抑制细胞凋亡。同时叉头蛋白既是Akt下游靶点,又对Fas配体具有调节作用[13]。本研究证实,TRAIL和大蒜素联合作用组可以通过降低Akt的表达和激活FKHR的活性来抑制PI3K/AKT信号通路的传导,从而抑制U87细胞的生长。
总之,我们的研究结果表明,TRAIL和大蒜素联合作用可以通过上调DR4、DR5和Caspases的表达,降低MMPs的表达,抑制PI3K/Akt信号通路,进而抑制脑胶质瘤细胞的活力和侵袭能力,促进细胞凋亡。因此,在脑胶质细胞瘤治疗中,使用TRAIL和大蒜素联合治疗或许是一个可研究的方向。
1 Lim do Y, Park JH. Induction of p53 contributes to apoptosis of HCT-116 human colon cancer cells induced by the dietary compound fisetin[J]. Am J Physiol Gastrointest Liver Physiol, 2009, 296(5):G1060-G1068.
2 Ivanov VN, Bhoumik A, Ronai Z. Death receptors and melanoma resistance to apoptosis[J]. Oncogene, 2003, 22(20): 3152-3161.
3 Wang S, El-Deiry WS. TRAIL and apoptosis induction by TNF-family death receptors[J]. Oncogene, 2003, 22(53): 8628-8633.
4 Shankar S, Srivastava RK. Enhancement of therapeutic potential of TRAIL by cancer chemotherapy and irradiation: mechanisms and clinical implications[J]. Drug Resist Updat, 2004, 7(2): 139-156.
5 Yamanaka T, Shiraki K, Sugimoto K, et al. Chemotherapeutic agents augment TRAIL-induced apoptosis in human hepatocellular carcinoma cell lines[J]. Hepatology, 2000, 32(3): 482-490.
6 Milner JA. Preclinical perspectives on garlic and cancer[J]. J Nutr,2006, 136(S3):S827-S831.
7 Hassan ZM, Yaraee R, Zare N, et al. Immunomodulatory affect of R10 fraction of garlic extract on natural killer activity[J]. Int Immunopharmacol, 2003, 3(10-11):1483-1489.
8 Uda N, Kashimoto N, Sumioka I, et al. Aged garlic extract inhibits development of putative preneoplastic lesions in rat hepatocarcinogenesis[J]. J Nutr, 2006, 136(S3):S855-S860.
9 Deryugina EI, Quigley JP. Matrix metalloproteinases and tumor metastasis[J]. Cancer Metastasis Rev, 2006, 25(1):9-34.
10 Chen NH, Liu JW, Zhong JJ. Ganoderic acid Me inhibits tumor invasion through down-regulating matrix metalloproteinases 2/9 gene expression[J]. J Pharmacol Sci, 2008, 108(2): 212-216.
11 Cook-Mills JM. Hydrogen peroxide activation of endothelial cellassociated MMPs during VCAM-1-dependent leukocyte migration[J]. Cell Mol Biol (Noisy-le-grand), 2006, 52(4): 8-16.
12 Zhou H, Li XM, Meinkoth J, et al. Akt regulates cell survival and apoptosis at a postmitochondrial level[J]. J Cell Biol, 2000, 151(3):483-494.
13 Ciechomska I, Pyrzynska B, Kazmierczak P, et al. Inhibition of Akt kinase signalling and activation of Forkhead are indispensable for upregulation of FasL expression in apoptosis of glioma cells[J]. Oncogene, 2003, 22(48): 7617-7627.
Allicin enhances antitumor activity of gliomas cells line U87 to TRAIL
ZHANG Feng-xiang, SUN Da-peng, HE Cheng-ye, HAN Guan-ying
The First Hospital of Liaoning Medical University, Jinzhou 121001, Liaoning province, China
HAN Guan-ying. Email: canghaiguanri@126.com
Objective To explore whether allicin can increase the sensitivity of glioma cells to tumor necrosis factor-related apoptosis-inducing ligand (TRAIL)-mediated apoptosis and its mechanism. Methods The effect of allicin combined with TRAIL on cell viability and cell apoptosis of U87 was detected by MTT assay and Annexin V/FITC assay, respectively. The invasive potential of allicin combined with TRAIL to U87 cells was further detected by Transwell experiment, and Western-blot, RT-PCR and Q-RTPCR were used to detect the expression of genes and proteins in allicin combined with TRAIL. Results The synergistic treatment significantly reduced cells viability and invasive activity, while promoted apoptosis in the tested U87 cells. At the molecule level, the synergistic treatment significantly increased the activation of DR4, DR5, caspase-3 and caspase-8, while the expression of AKT, pFKHR, MMP-2 and MMP-9 was significantly inhibited. Conclusion It suggests that allicin can increase the sensitivity of U87 to TRAIL, thus enhancing the apoptosis of U87.
allicin; tumor necrosis factor-related apoptosis-inducing ligand; gliomas cells line U87
R 73-3
A
2095-5227(2014)10-1063-05
10.3969/j.issn.2095-5227.2014.10.024
时间:2014-06-18 13:25
http://www.cnki.net/kcms/detail/11.3275.R.20140618.1325.002.html
2013-10-28
张凤香,女,博士,主治医师。Email: zhangfengxiang64 @163.com
韩冠英,男,副教授。Email: canghaiguanri@126.com
