帕金森病患者睡眠障碍特点分析
2014-07-07刘建安徐江涛宋永斌张晓馨于春芳
刘建安,徐江涛,宋永斌,张晓馨,杨 俊,于春芳,吕 芸
兰州军区乌鲁木齐总医院 神经内科,新疆乌鲁木齐 832000
帕金森病患者睡眠障碍特点分析
刘建安,徐江涛,宋永斌,张晓馨,杨 俊,于春芳,吕 芸
兰州军区乌鲁木齐总医院 神经内科,新疆乌鲁木齐 832000
目的 使用多导睡眠图(polysomnogram,PSG)分析帕金森病(Parkinson's disease,PD)患者睡眠结构特点,探索影响PD患者睡眠结构的机制。方法 对2011年10月- 2014年2月在我院神经内科门诊或住院的33例PD患者和33例对照者行一整夜多导睡眠图监测,并对记录数据进行分析。结果 PD组早醒(4例 vs 0例)、睡眠破碎(25例 vs 16例)、快动眼睡眠期颏肌失张力消失(16例 vs 3例)的检出率均高于对照组(P<0.05);PD组和对照组比较,PD组觉醒时间占总睡眠时间百分比、一期睡眠占总睡眠时间百分比[S1(%)]高于对照组,而三期睡眠占总睡眠时间百分比[S3(%)]及快速眼球运动(repid eyes movement,REM)期占总睡眠时间百分比[REM(%)]低于对照组;PD病程≤2年组和对照组比较,两者睡眠结构参数均无统计学差异;PD病程>2年组和对照组比较,前者觉醒时间占总睡眠时间百分比、S1(%)高于后者,S3(%)和REM(%)低于对照组;PD病程≤2年组和>2年组比较,前者在觉醒时间占总睡眠时间百分比低于后者,而REM(%)高于后者。结论 帕金森病患者睡眠障碍主要表现为早醒、睡眠破碎和快动眼睡眠期颏肌失张力消失;帕金森病患者明显存在睡眠结构紊乱,浅睡期时间延长,深睡期时间缩短;病程是影响PD患者睡眠结构的一个重要因素。
帕金森病;睡眠结构;多导睡眠图
随着对帕金森病(Parkinson's disease,PD)认识的深入,人们发现其非运动症状对PD患者生活质量的影响较运动症状更为明显,而在非运动症状中,睡眠障碍对PD患者生活质量和生活能力的影响尤为显著[1]。目前,通过多导睡眠图(polysomnogram,PSG)对帕金森病患者睡眠的研究结果表明PD患者总体睡眠质量差,睡眠障碍的发生率高,主要表现为入睡困难、睡眠破碎、睡眠运动障碍等,但也有学者指出PD患者常出现的睡眠障碍类型为早醒,睡眠破碎等,与同龄老人相比并不表现入睡困难[2]。而对PD患者睡眠结构的相关研究表明,其存在总睡眠时间短、睡眠效率低、睡眠转换多、慢波睡眠及快速眼球运动(repid eyes movement,REM)期睡眠少、浅睡眠增多等特点,同时REM期及慢波睡眠缺失明显[3]。但也有国外学者的研究表明帕金森病患者睡眠结构的紊乱与病程有着密切关联,睡眠结构的紊乱随着病程加长而加重[4]。总之,就目前国内外研究来看,对于PD患者睡眠障碍类型存在分歧;对PD患者睡眠结构特点及与病程的关系,观点也不尽相同。本文通过对33例帕金森病患者和年龄、性别、体质量指数和文化程度相匹配的33名对照者睡眠结构的分析,并探讨帕金森病患者睡眠障碍可能存在的内在机制。
对象和方法
1 研究对象 本研究为回顾性研究,病例组来自2011年10月- 2014年2月在我院神经内科门诊或住院的PD患者33例,其中男22例,女11例,年龄(63.91±8.74)岁,病程0.5 ~ 22年。病程≤2年者14例,病程>2年者19例。所选病例均符合1985年全国锥体外系疾病会议制定的PD诊断标准,全部经过了头颅CT、MRI等检查及精神量表评估,排除帕金森病综合征、帕金森叠加综合征、原发性震颤疾病患者,排除伴发脑卒中、脑肿瘤、慢性头痛及精神分裂症等精神类等疾病(抑郁症除外)。所有入组患者均获得知情同意。对照组33例从来我院做年度健康体检者中筛选,其体检结果中未发现神经系统疾病,1周内均未服用各类镇静催眠及抗抑郁等精神类药物。
2 主要仪器 Biologic公司多导睡眠监测系统;Analysis Manager睡眠分析软件。
3 方法及指标 所有患者1周内均停用镇静催眠及各类抗抑郁等精神类药物。在接受检查当晚22:30时到达多导睡眠检测室。在23:30按照检查要求连接好检测装置上床就寝,次日清晨8:00结束监测。本研究中以睡眠潜伏期30 min为界点,入睡潜伏期>30 min者定为入睡困难;早醒定义为凌晨3:00以前醒来且再无法入睡;睡眠破碎定义为整夜出现3次以上超过5 min的觉醒;睡眠结构指一个完整睡眠周期中各个分期所占的百分比,一个睡眠周期包括NREM期和REM期,其中NREM期又包括一期(S1)、二期(S2)浅睡眠期,三期(S3)、四期(S4)深睡眠期。本研究中,以上床就寝至检测结束的时程为总睡眠时间,S1(%)为S1期睡眠时间所占总睡眠时间百分比,S2(%)、S3(%)、S4(%)依此类推;对于帕金森病患者,病程≤2年者视为短病程,病程>2年者视为长病程。
4 统计学方法 应用SPSS17.0对记录所得数据进行分析。各种睡眠障碍以检出率(%)表示,采用χ2检验;对各组睡眠结构参数比较,采用t检验,不符合正态分布时采用秩和检验,方差不齐时采用t'检验。P<0.05为差异有统计学意义。
结 果
1 一般情况比较 本研究中,PD组与对照组在性别、文化程度上(按文盲、小学、中学、大学及以上分类)均匹配。PD组年龄(63.91±6.74)岁,对照组年龄(63.27±6.67)岁(P=0.767);PD体质量指数23.61±2.00,对照组体质量指数23.97±1.87(P= 0.713)。病程≤2年组年龄(62.43±6.54)岁、PD病程>2年组年龄(65.00±6.95)岁,与对照组比较无统计学差异(P=0.68),3组间均无统计学差异;病程≤2年组体质量指数24.42±1.95,PD病程>2年组体质量指数22.51±2.02,与对照组比较无统计学差异(P=0.51),3组间均无为无统计学差异。
2 PD组与对照组睡眠障碍检出率比较 PD组的早醒、睡眠破碎和REM期颏肌失张力消失的检出率均显著高于对照组(P<0.05)。见表1。
3 PD组和对照组睡眠结构参数比较 两组S2(%)、S4(%)无差异;PD组觉醒时间(%)、S1(%)显著高于对照组,而S3(%)和REM(%)低于对照组,其中两者REM期持续时间占总睡眠时间(%)的差异最大(P<0.001)。见表2。

表1 PD组与对照组睡眠障碍检出率的比较Tab. 1 Comparison of morbidity between PD group and controls (n, %)
表2 PD组和对照组PSG睡眠结构参数的比较Tab. 2 Comparison of sleep structural parameter between PD group and controls (±s)
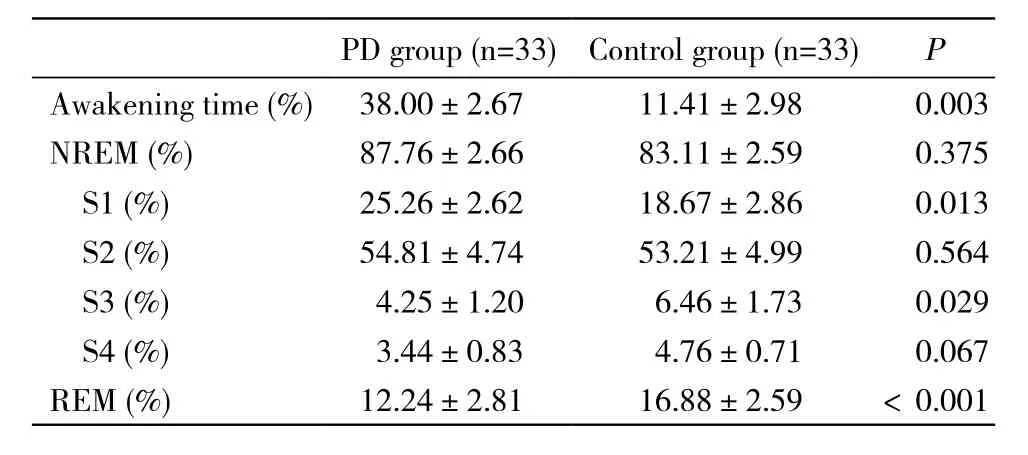
表2 PD组和对照组PSG睡眠结构参数的比较Tab. 2 Comparison of sleep structural parameter between PD group and controls (±s)
PD group (n=33)Control group (n=33)P Awakening time (%)38.00±2.6711.41±2.980.003 NREM (%)87.76±2.6683.11±2.590.375 S1 (%)25.26±2.6218.67±2.860.013 S2 (%)54.81±4.7453.21±4.990.564 S3 (%)4.25±1.206.46±1.730.029 S4 (%)3.44±0.834.76±0.710.067 REM (%)12.24±2.8116.88±2.59<0.001
4 PD组病程≤2年组和>2年组与对照组睡眠结构参数比较 PD组和对照组比较,PD组S1(%)高于对照组;而S3(%)和REM(%)低于对照组,其中两者REM(%)的统计学差异最显著(P<0.001);PD病程≤2年组和对照组比较,睡眠结构差异无统计学意义;PD病程>2年组与对照组比较,前者S1(%)高于对照组;而S3(%)和REM(%)低于对照组;PD病程≤2年组和PD病程>2年组比较,前者S3(%)和REM(%)低于后者。见表3。
讨 论
本研究结果显示,PD组入睡困难的发病率为39.4%,而对照组为30.3%,差异无统计学意义,这与以往的研究结果不一致。国内外很多学者的研究都指出入睡困难是帕金森病睡眠障碍的主要表现[5-8]。众所周知,年龄是影响睡眠的一个重要因素,入睡困难是老年人常见的睡眠特点,因此PD患者表现的入睡困难很可能只是年龄造成的,而与PD本身的关系不是很密切[9-10]。本研究中PD组有4例存在早醒,而对照组没有早醒者。早醒既是抑郁症患者的一个常见症状又是抑郁症状出现前的一种表现[11]。本研究中虽然没有对PD组进行抑郁评估,但其早醒的患病率为12.1%,这与以往研究结果中帕金森病患者抑郁发病率的统计结果基本一致[12]。所以,早醒作为帕金森病患者睡眠的一个特点,可能主要是帕金森病引起的抑郁所致。在本研究结果中,PD组25例存在睡眠破碎,其发生率高达75.8%,而对照组仅有16例(48.5%),两者存在较大差异,表明睡眠破碎是帕金森病患者较为突出的特点。这与帕金森病本身肌肉僵硬、呼吸窘迫以及诸多的合并症有着密切的联系[13]。研究结果还显示对照组睡眠破碎的发生率也高达48.5%,说明即使没有帕金森病的存在,睡眠破碎也普遍存在于老年人中。老年人褪黑素水平下降,睡眠维持功能低,包括自主神经在内的神经系统老化等均是造成睡眠破碎的原因[14]。本研究中,PD组和对照组差异最显著的是REM期颏肌失张力消失。而REM期颏肌失张力消失是诊断快速动眼睡眠行为障碍(REM sleep behavior disorder,RBD)的一项重要指标[15]。Schenck等[16]研究了29例诊断为RBD的患者,发现38%在约(3.7±1.4)年后出现PD或是帕金森综合征;随访5年时这个比例增加到65%。另外,在一项大型队列研究中发现,很多PD患者在发病前已经患有RBD,说明RBD在某种程度上是PD发生的一个危险信号,而在PD患者中,伴发RBD的患者较无伴发者最终进展为痴呆比例大大增加[17-18]。因此RBD常被认为是一种潜在的神经系统退行性病变的表现。因此,快动眼睡眠期颏肌失张力消失是PD患者非常有意义的临床特征,应该得到关注。
研究结果表明,帕金森病患者睡眠结构紊乱,浅睡眠增多,深睡眠减少,且容易觉醒。帕金森病患者由于觉醒时间增多,整体睡眠效率下降,而且主要以浅睡眠为主,深睡眠不足,精力得不到恢复;REM持续时间显著减少,全身肌张力保持在较高水平,身体得不到全面放松,体力无法恢复。精力、体力均不能通过睡眠得到有效调整,进而引起抑郁、疲乏等一系列继发症状[19-20]。
有国外学者指出,对于早期PD患者,其睡眠结构与对照组无差异,这与本研究的结果一致[21]。造成这一结果的原因可能是在帕金森病早期中枢神经的损害还不严重,维持正常睡眠结构的机制尚存,也有可能是小剂量的多巴胺能类药物对睡眠的改善抵消了早期的损害。已有充分的证据证明小剂量多巴胺能药物有改善睡眠的作用,而大剂量的多巴胺能类药物会破坏睡眠[10,22]。随着疾病的进展,神经退行性改变愈加严重,同时服用药量的增加也造成了睡眠结构的进一步破坏。因此,造成晚期PD患者睡眠结果进一步破坏的因素,除了疾病进展以外,还有大剂量多巴胺能类药物对睡眠结构的破坏。病程≤2年组与>2年组的比较结果进一步印证了以上的推论,说明病程是影响PD患者睡眠结构的重要因素。
表3 PD病程≤2年组和PD病程>2年组睡眠结构参数的比较Tab. 3 Comparison of sleep structural parameter in PD group (course≤2 years), PD group (course>2 years) and controls (±s)
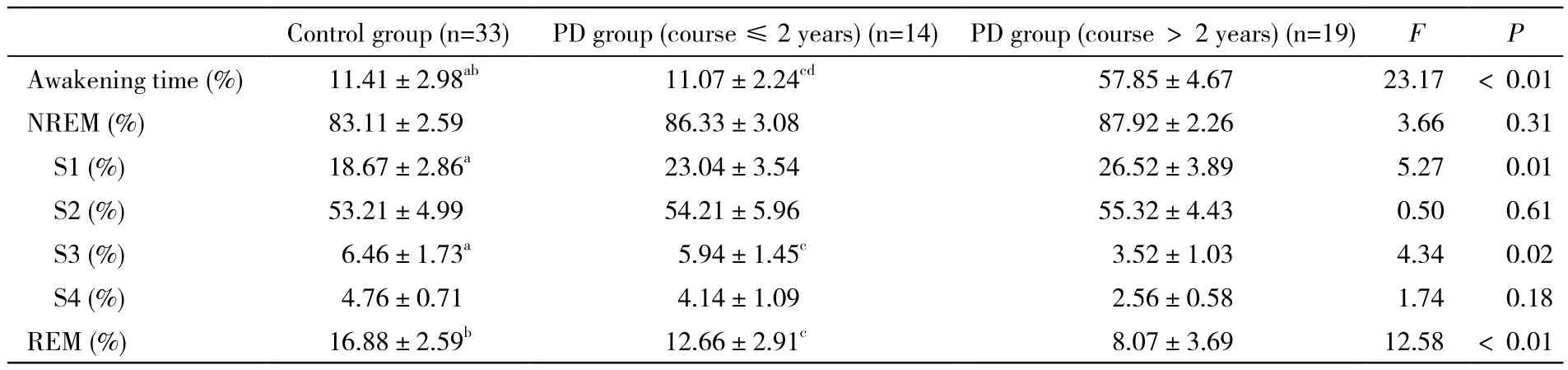
表3 PD病程≤2年组和PD病程>2年组睡眠结构参数的比较Tab. 3 Comparison of sleep structural parameter in PD group (course≤2 years), PD group (course>2 years) and controls (±s)
aP<0.05,bP<0.001, vs course>2 years;cP<0.05,dP<0.001, vs course>2 years;No significant difference was found between controls and PD group (course≤2 years)
Control group (n=33)PD group (course≤2 years) (n=14)PD group (course>2 years) (n=19)FP Awakening time (%)11.41±2.98ab11.07±2.24cd57.85±4.6723.17<0.01 NREM (%)83.11±2.5986.33±3.0887.92±2.263.660.31 S1 (%)18.67±2.86a23.04±3.5426.52±3.895.270.01 S2 (%)53.21±4.9954.21±5.9655.32±4.430.500.61 S3 (%)6.46±1.73a5.94±1.45c3.52±1.034.340.02 S4 (%)4.76±0.714.14±1.092.56±0.581.740.18 REM (%)16.88±2.59b12.66±2.91c8.07±3.6912.58<0.01
综上所述,我们可以得出以下结论:1)PD患者存在早醒、睡眠破碎和REM期颏肌失张力消失等睡眠障碍;2)PD患者睡眠结构紊乱,浅睡期时间延长,深睡期时间缩短;3)病程是影响PD患者睡眠结构的一个重要因素,这其中可能包含疾病进展程度和服药剂量增加两个方面。
1 Arnulf I. Excessive daytime sleepiness in parkinsonism[J]. Sleep Med Rev, 2005, 9(3): 185-200.
2 Wetter TC, Trenkwalder C, Gershanik O, et al. Polysomnographic measures in Parkinson’s disease: a comparison between patients with and without REM sleep disturbances[J]. Wien Klin Wochenschr, 2001, 113(7/8): 249-253.
3 Maria B, Sophia S, Michalis M, et al. Sleep breathing disorders in patients with idiopathic Parkinson’s disease[J]. Respir Med,2003, 97(10): 1151-1157.
4 Kaynak D, Kiziltan G, Kaynak H, et al. Sleep and sleepiness in patients with Parkinson’s disease before and after dopaminergic treatment[J]. Eur J Neurol, 2005, 12(3): 199-207.
5 Oerlemans WG, de Weerd AW. The prevalence of sleep disorders in patients with Parkinson’s disease. A self-reported, communitybased survey[J]. Sleep Med, 2002, 3(2):147-149.
6 胡喜庆,张本恕.帕金森病患者睡眠障碍的多导睡眠图研究[J].中华神经科杂志,2007,40(7):471-474.
7 Trenkwalder C. Sleep dysfunction in Parkinson’s disease[J]. Clin Neurosci, 1998, 5(2):107-114.
8 Partinen M. Sleep disorder related to Parkinson’s disease[J]. J Neurol, 1997, 244(1): S3-S6.
9 Gagnon JF, Bédard MA, Fantini ML, et al. REM sleep behavior disorder and REM sleep without atonia in Parkinson’s disease[J]. Neurology, 2002, 59(4):585-589.
10 Garcia-Borreguero D, Larrosa O, Bravo M. Parkinson’s disease and sleep[J]. Sleep Med Rev, 2003, 7(2):115-129.
11 Ondo WG, Dat Vuong K, Khan H, et al. Daytime sleepiness and other sleep disorders in Parkinson’s disease[J]. Neurology,2001, 57(8):1392-1396.
12 Gupta M, Singh G, Khwaja GA, et al. Hallucinations in Parkinson's disease--a study of forty three patients[J]. J Assoc Physicians India, 2004, 52:703-706.
13 Junghanns S, Glöckler T, Reichmann H. Switching and combining of dopamine agonists[J]. J Neurol, 2004, 251(Suppl 6): VI/19-VI/23.
14 Nomura T, Inoue Y, Mitani H, et al. Visual hallucinations as REM sleep behavior disorders in patients with Parkinson’s disease[J]. Mov Disord, 2003, 18(7): 812-817.
15 赵忠新.临床睡眠障碍学[M].上海:第二军医大学出版社,2003:13-41.
16 Schenck CH, Bundlie SR, Mahowald MW. Delayed emergence of a parkinsonian disorder in 38% of 29 older men initially diagnosed with idiopathic rapid eye movement sleep behaviour disorder[J]. Neurology, 1996, 46(2):388-393.
17 Norlinah MI, Afidah KN, Noradina AT, et al. Sleep disturbances in Malaysian patients with Parkinson’s disease using polysomnography and PDSS[J]. Parkinsonism Relat Disord, 2009, 15(9):670-674.
18 Comella CL. Sleep disorders in Parkinson's disease: an overview[J]. Mov Disord, 2007, 22(S17):S367-S373.
19 Diederich NJ, Vaillant M, Leischen M, et al. Sleep apnea syndrome in Parkinson’s disease. A case-control study in 49 patients[J]. Mov Disord, 2005, 20(11): 1413-1418.
20 Ferreira JJ, Galitzky M, Montastruc JL, et al. Sleep attacks and Parkinson’s disease treatment[J]. Lancet, 2000, 355(9212):1333-1334.
21 Rye DB, Jankovic J. Emerging views of dopamine in modulating sleep/ wake state from an unlikely source: PD[J]. Neurology, 2002, 58(3):341-346.
22 Brunner H, Wetter TC, Hogl B, et al. Microstructure of the nonrapid eye movement sleep electroencephalogram in patients with newly diagnosed Parkinson’s disease: effects of dopaminergic treatment[J]. Mov Disord, 2002, 17(5):928-933.
Characteristics of sleep structure in patients with Parkinson's disease
LIU Jian-an, XU Jiang-tao, SONG Yong-bin, ZHANG Xiao-xin, YANG Jun, YU Chun-fang, LYU Yun
Urumqi General Hospital of Lanzhou Military Area Command, Urumqi 832000, Xinjiang Province, China
XU Jiang-tao. Email:xujiangtao1959@163.com
Objective To analyze characteristics of sleep structure in patients with Parkinson's disease (PD) by polysomnogram (PSG) and investigate the probable pathogenesis. Methods Clinical data about 33 patients with PD from outpatient service or inpatient department of our hospital from October 2011 to February 2014 and 33 controls who were monitored by polysomnographic (PSG) evaluation were collected and analyzed. Results Of the 33 patients, 4 were found to have early awakening vs 0 in control group, fragmented sleep in 25 vs 16 in control group, and REM sleep without atonia in 16 vs 3 in control group. The morbidity in PD patients group were significantly higher than that in controls (P<0.05). Compared with control group, the percentage of awakening time occupying total sleep time [S1 (%)] in PD patients group were higher than that in controls, S3 (%) and REM (%) in PD patients group were lower than that in controls. There were no statistical difference in sleep structural parameter between PD group (course≤2 years) and controls, the percentage of awakening time occupying total sleep time and S1 (%) in PD group (course>2 years) were higher while S3 (%), REM (%) was lower than that in controls. The percentage of awakening time occupy total sleep time was higher in PD group (course≤2 years) while REM (%) was lower than that of PD group (course>2 years). Conclusion The main clinical manifestations of PD patients with sleep disorder are early awakening, fragmented sleep and REM sleep without atonia. It is obviously that sleep disorder exists in PD patients, the time of light sleep becomes longer while deep sleep becomes shorter, and PD's course is a main factor that affects their sleep structure.
Parkinson's disease; sleep structure; polysomnogram
R 742.5
A
2095-5227(2014)10-1000-04
10.3969/j.issn.2095-5227.2014.10.007
时间:2014-06-17 15:40
http://www.cnki.net/kcms/detail/11.3275.R.20140618.1355.004.html
2014-04-18
兰州军区医药卫生科研项目(LXH-2009024)
刘建安,男,在读硕士,主治医师。研究方向:帕金森病。Email: liujianan813@sin.com
徐江涛,男,主任医师,研究生导师。Email: xujiangtao 1959@163.com
