NGFβ/HIF-1α双重转染的骨髓间充质干细胞对神经元轴突再生的作用
2014-07-07庄培袁范仲凯李永明张玉强贾志强
庄培袁,吕 刚,范仲凯,李永明,张玉强,贾志强
辽宁医学院附属第一医院,辽宁锦州 121000
NGFβ/HIF-1α双重转染的骨髓间充质干细胞对神经元轴突再生的作用
庄培袁,吕 刚,范仲凯,李永明,张玉强,贾志强
辽宁医学院附属第一医院,辽宁锦州 121000
目的观察神经生长因子β(nerve growth factor β,NGFβ)/低氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)双重转染的骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)对神经元轴突再生微环境的改善作用,为完善微环境中轴突再生的理论提供资料。方法分别构建携带编码NGFβ、HIF-1α的慢病毒载体,用最佳感染复数(multiplicity of infection,MOI)转染BMSCs后,Western blot检测转染后的BMSCs表达NGFβ、HIF-1α的情况。培养SD大鼠皮质神经元并将其与转染后的BMSCs用Transwell双层培养板构建共培养体系。将共培养体系在厌氧培养罐中培养48 h后,用ELISA方法检测神经元培养上清液中NGFβ、HIF-1α、血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达水平,并用Image pro-Plus软件测量神经元轴突的长度。实验分组:A组:单独培养神经元;B组:BMSCs与神经元共培养;C组:NGFβ转染的BMSCs与神经元共培养;D组:HIF-1α转染的BMSCs与神经元共培养;E组:NGFβ/HIF-1α双重转染的BMSCs与神经元共培养。结果Le-RFP-NGFβ和Le-GFP-HIF-1α基因转染BMSCs转染率分别为84.83%和89.63%。Western blot检测显示,转染后的BMSCs能表达目的蛋白NGFβ和HIF-1α。共培养体系ELISA检测结果显示,C组和E组的NGFβ的表达量明显高于A、B组(P<0.05);D组和E组的HIF-1α的表达量明显高于A、B组(P<0.05)。D、E两组的VEGF表达量高于A、B两组(P<0.05)。Image pro-Plus测量神经元轴突长度结果显示,C、D、E组大于A、B两组(P<0.05),E组大于C、D组(P<0.05)。结论与NGFβ/HIF-1α双重转染BMSCs共培养的神经元轴突生长情况良好,在共培养环境中对神经元存活发挥重要作用的NGFβ、HIF-1α、VEGF等因子高表达。
骨髓间充质干细胞;神经营养因子β;低氧诱导因子-1α;基因转染;轴突再生
Key words:bone marrow mesenchymal stem cells; nerve growth factor β; hypoxia inducible factor-1α; gene transfection; axonal regeneration
脊髓损伤(spinal cord injury,SCI)是一种脊髓在直接或者间接暴力作用下,损伤平面以下突然失去感觉、运动和自主神经功能发生障碍的疾病。目前对于SCI的治疗方法主要是手术解除脊髓压迫,稳定损伤部位,预防继发性脊髓损伤的发生。随着医疗技术的进步,SCI的治疗已经取得了一定的进展,但是对于SCI后神经功能的恢复尚无有效的治疗方法[1]。干细胞移植治疗为SCI的治疗提供了多种极具吸引力的策略,包括替代受损的神经元和神经胶质细胞,促进轴突、髓鞘的再生,产生神经营养因子和抗炎细胞因子,促进新生血管形成等,可为神经元轴突再生提供一个有利的环境[2-3]。骨髓间充质干细胞(bone mesencymal stem cells,BMSCs)是人体骨髓、血浆等组织中具有较强更新和分化潜能的成体干细胞,可以在体外分化为成骨细胞、软骨细胞、脂肪细胞、神经细胞等。在神经损伤修复研究领域中,BMSCs是十分有研究价值的种子细胞。神经生长因子(nerve growth factors,NGF)是一种经典的神经营养因子,在周围神经发育过程和保持中枢神经胆碱能神经元功能方面发挥着重要作用。研究表明,其在中枢神经元和外周神经元再生方面有巨大的促进作用[4]。低氧诱导因子-1(hypoxia inducible factor-1,HIF-1)是一个螺旋-环-螺旋结构的转录因子,在哺乳动物生长发育过程中起重要作用。在缺氧条件下,HIF-1能够激活促红细胞生成素、葡萄糖转运体、糖酵解酶、血管内皮生长因子(vascular endothelial growth factor,VEGF)等的基因转录过程,这些蛋白可提高氧输送或促进代谢适应低氧环境[5]。研究表明,SCI后可能因为HIF-1α表达不够充分而使神经元修复受阻[6-8]。应用NGFβ能够有效地促进神经元轴突再生,但又不可避免地面临缺氧环境的制约,而HIF-1α能辅助受损脊髓组织对抗低氧环境,促进神经元生长[9-10]。我们推测:在神经元缺血缺氧的环境下,二者可能发挥协同作用,促进神经元轴突再生。所以本实验拟将细胞移植与基因治疗相结合,来探讨NGFβ/HIF-1α双重转染的BMSCs移植对SCI后神经元轴突再生的改善作用。
材料和方法
1 材料 SD大鼠BMSCs第2代细胞由广州赛业生物有限公司提供。NGFβ,HIF-1α慢病毒载体购自上海汉恒生物科技有限公司。BMSCs完全培养基购自广州赛业生物有限公司。兔抗大鼠NGFβ一抗和兔抗大鼠HIF-1α一抗购自Santa cruz公司。Neurbasal-A,B27添加剂购自Gibco公司。出生24 h内SD大鼠2只,由辽宁医学院实验动物中心提供。
2 BMSCs培养 购买的第2代BMSCs复苏后,将培养瓶放置在37℃,5% CO2恒温细胞培养箱内培养。在镜下观察到细胞融合度达80%左右时,用完全培养基(L-DMEM + 10% FBS)进行传代培养。吸去培养液,磷酸盐缓冲液冲洗3次,加入0.25%胰蛋白酶1 ml,置于37℃细胞培养箱内孵育3 min左右,镜下观察BMSCs胞体收缩,不再相互粘连成片时,加入3 ml完全培养基终止消化。用吹打管吹打后,收集细胞悬液加入到15 ml离心管中;1 000 r/min,离心5 min。小心吸去上清,加入4 ml完全培养基,吹打均匀后,进行细胞计数。计算细胞密度后,完全培养基调整细胞密度到1×105/ml,将细胞悬液接种到T25细胞培养瓶中,每瓶4 ml,每瓶做好标记,放入37℃,5% CO2细胞培养箱内培养。每瓶T25 BMSCs可以接种3个T25培养瓶。
3 携载目的基因的慢病毒载体转染BMSCs 实验分为4组,a组为未转染组;b组为NGFβ转染组;c组为HIF1-α转染组;d组为NGFβ/HIF1-α双重转染组。取第4代生长良好的BMSCs按照细胞传代过程准备接种细胞,调整细胞密度为1×105/ml。接种细胞悬液到T25细胞培养瓶中,每瓶4 ml,共接种4瓶,按组别分别标记。病毒转染BMSCs接种24 h后,按照最佳感染复数(multiplicity of infection,MOI)=100计算,得出每瓶细胞所需病毒量为4×107个。用无血清培养基将两种病毒原液浓度由1010/ml稀释至108/ml,按照组别在各组中加入病毒液。a组不加病毒,b组加入Le-RFPNGFβ病毒0.4 ml,c组加入Le-GFP-HIF-1α病毒0.4 ml,d组加入Le-RFP-NGFβ病毒和Le-GFP-HIF-1α病毒各0.4 ml。各组添加DMEM至4 ml,a组加4 ml,b、c两组加3.6 ml,d组加3.2 ml。转染6 h后,弃去各瓶中的病毒液,换用4 ml完全培养基。24 h后,在荧光显微镜下观察各组细胞荧光蛋白GFP和RFP的表达情况。
4 Western blot检测目的基因表达 慢病毒转染BMSCs转染1 d后,观察各组细胞生长情况,细胞融合达到80%左右时,收集细胞,提取蛋白,Western blot检测各组细胞NGFβ和HIF1-α的表达情况。
5 新生SD大鼠皮层神经元原代培养 新生SD大鼠皮层神经元制备过程参照Beaudoin等[11]的实验方法。取出生24 h以内的SD大鼠2只,75%乙醇浸泡10 min消毒。将乳鼠断头取出大脑,置于装有高糖DMEM小烧杯中。在冰上培养皿中仔细剥离血管膜。将皮层移入另一个培养皿中,加少量高糖DMEM,用精细剪将皮层剪成1 ~ 2 mm3的组织块。加入10 ml木瓜蛋白酶(2 mg/ml)和500 μl DNA酶I(0.2 mg/ml),在37℃下消化30 min,每5 min晃动一下。消化后,加入1 ml FBS终止消化。整个体系静止2 ~ 3 min,吸除上层的消化液。在培养皿内加入1.5 ml接种培养基(高糖DMEM + 10% FBS),加入少量DNA酶Ⅰ,用1 ml枪头轻柔吹打10次,静置2 min,收集上层细胞悬液到预冷接种培养基中,共吹打3次。计数细胞总数后用接种培养基调节细胞密度为1×106/ml。接种到多聚赖氨酸包被的Transwell 6孔板的底层中,6孔培养板置于37℃,5% CO2培养箱中,培养6 h。吸去接种培养基,换用培养神经元的无血清培养液(Neurobasal-A + 2% B27+ 0.5 mmol/L谷氨酰胺)。继续培养48 h后,每2 ~ 3 d换液1次。接种神经元6 h后更换培养基时,倒置相差显微镜下观察神经元贴壁情况,以后每天观察细胞生长情况并拍照。
6 BMSCs与神经元厌氧共培养 按照实验目的分为5组:A组(神经元组):单独培养神经元,Transwell内杯中不接种BMSCs;B组(未转染组):BMSCs与神经元细胞共培养;C组(NGFβ转染组):转染NGFβ的BMSCs与神经元共培养;D组(HIF-1α转染组):转染HIF-1α的BMSCs与神经元共培养;E组(NGFβ/HIF-1α双重转染组):NGFβ/HIF-1α双重转染的BMSCs与神经元共培养。原代神经元培养3 d后,选取生长情况良好的孔,按组别分别标记,每组2孔,共10个孔。按照组别分别在Transwell培养板的内杯中接种不同的BMSCs,每孔接种细胞悬液1 ml,接种细胞数为1×105/孔。A组不接种BMSCs,加入1 ml BMSCs完全培养基。B组接种未转染BMSCs;C组接种转染NGFβ的BMSCs;D组接种转染HIF-1α的BMSCs;E组接种NGFβ/HIF-1α转染的BMSCs。接种BMSCs 24 h后,共培养体系换用混合培养基。将Transwell双层培养板放入厌氧培养罐中,放入厌氧产气包,密封培养罐,置于37℃、5% CO2细胞培养箱内,共培养体系在厌氧环境中共培养48 h。
7 检测目标蛋白表达共培养体系 培养48 h后,将共培养体系从厌氧培养罐中取出,置于37℃、5% CO2细胞培养箱中培养。培养第3天换液,收集各组下层神经元培养层的培养上清液用ELISA方法检测NGFβ、HIF-1α、VEGF的含量。
8 Image pro-Plus软件检测轴突生长 厌氧培养48 h后第3天,倒置相差显微镜观察神经元生长情况,每组随机选取5个视野并拍照后用Image pro-Plus软件分析所得图片测量轴突长度并记录。
结 果
1 传代培养大鼠BMSCs的生长情况 第2代BMSCs复苏后6 h开始贴壁,细胞形态为圆形。24 h后细胞形态为较一致的长梭形,胞体透亮,折光性好,核较小。传代的细胞形态上无明显的差异。见图1。
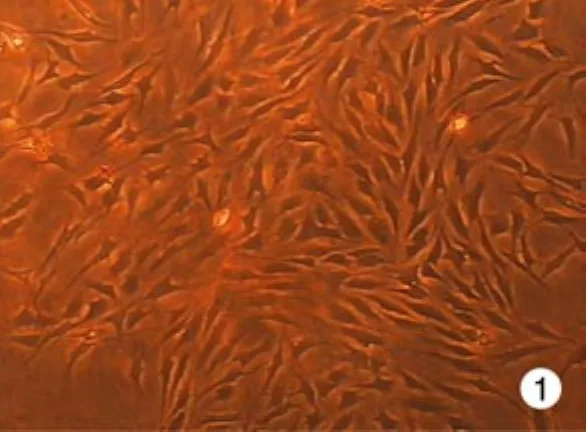
图 1 传代后第5天BMSCs 第3代生长情况 (×400)Fig. 1 Growth of P3 BMSCs at day 5 (×400)
2 荧光显微镜观察观察GFP和RFP的表达 慢病毒转染各组细胞后24 h,未转染组在明视野下可见BMSCs(图2A),在暗视野下未见荧光蛋白表达;NGFβ转染组在绿光激发下,可见红色荧光蛋白表达,Le-RFP-NGFβ转染率为84.83%(图2B);HIF1-α转染组在蓝光激发下,可见绿色荧光蛋白表达,Le-GFP-HIF-1α转染率89.63%(图2C);NGFβ/HIF1-α双重转染组在绿光激发下,可见红色荧光蛋白表达(图2D),在蓝光激发下,可见绿色荧光蛋白表达(图2E);将图2D和图2E合成后可见双重表达RFP和GFP的BMSCs呈黄色,重合率为68.62%(图3F)。
3 Western blot检测转染后BMSCs的NGFβ表达BMSCs经两种慢病毒载体转染后1 d,未转染组可见NGFβ表达,但不明显,HIF-1α转染组未见NGFβ表达,NGFβ组和NGFβ/HIF-1α双重转染组组均表达NGFβ。见图3。
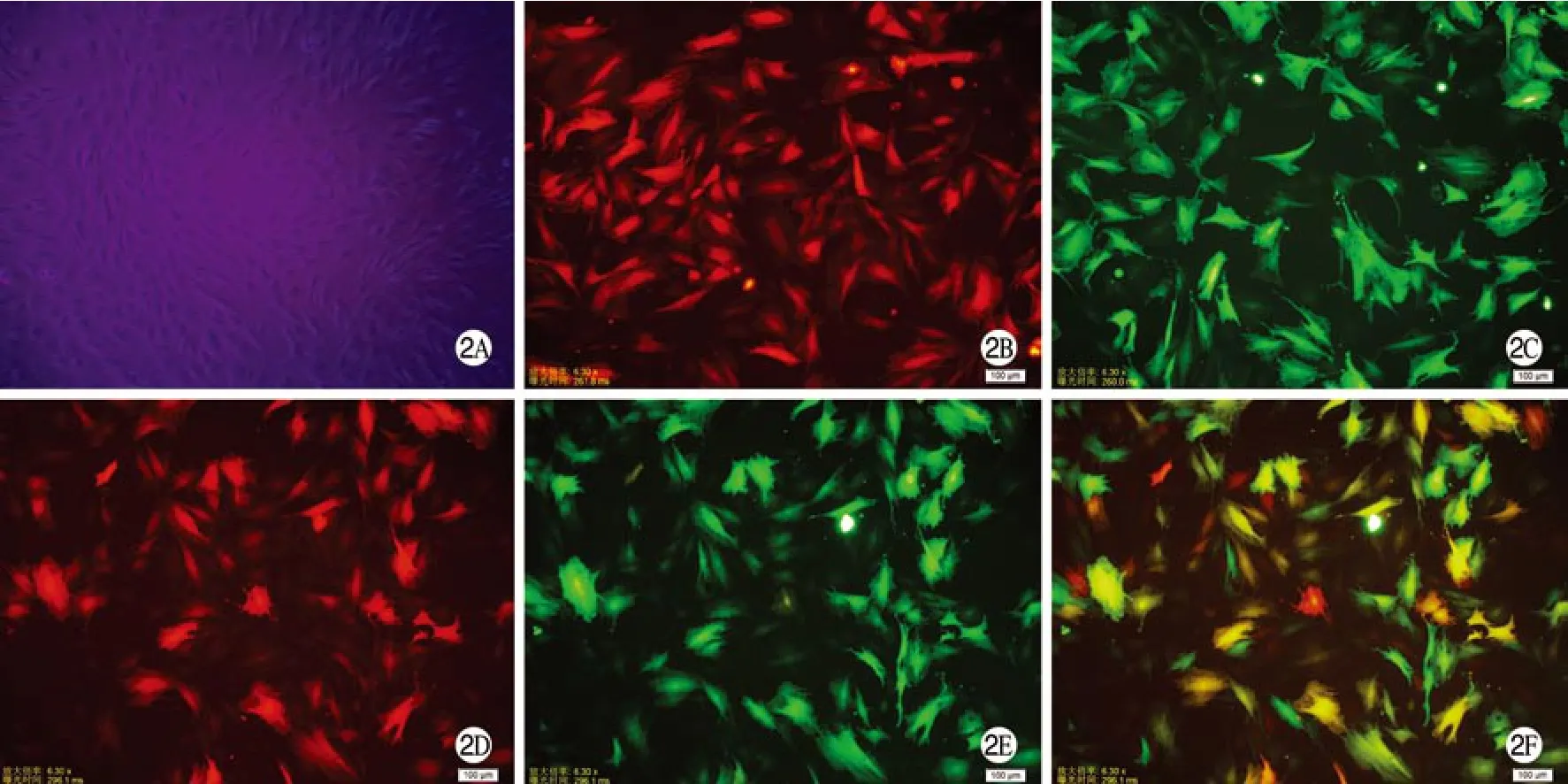
图 2 荧光显微镜观察各组GFP和RFP表达Fig. 2 Expression of GFP and RFP detected by fluorescence microscopy A: non-transfected BMSCs (×100); B: NGFβ transfected BMSCs under green fluorescence (×400); C: HIF-1αtransfected BMSCs under blue fluorescence (×400); D: NGFβ/HIF-1αdouble transfected BMSCs under green fluorescence (×400); E: same view of D under blue fluorescence (×400); F: overlapping D and E, the co-express GFP and RFP of BMSCs are yellow (×400)
4 Western blot检测转染后BMSCs的HIF1-α表达 BMSCs经两种慢病毒载体转染后1 d,未转染组与 NGFβ转染组无HIF1-α表达,HIF1-α转染组和NGFβ/HIF1-α双重转染组均表达HIF1-α。见图4。
5 原代培养大鼠皮质神经元生长情况 原代培养的神经元6 h后开始贴壁,1 d后镜下多数细胞已经贴壁生长,细胞大小不一,多呈圆形,有少数细胞可见1 ~ 2个小突起(图5);3 d后,神经元胞体增大,形态多样,突起变多。
6 神经元厌氧共培养并检测目标蛋白NGFβ的表达量 BMSCs共培养能增加神经元培养层中的NGFβ;NGFβ转染后,NGFβ的表达多于未转染组(P<0.05)。HIF-1α的表达量:HIF-1α转染共培养能增加神经元培养层中的HIF-1α。VEGF的表达量:BMSCs共培养能增加神经元培养层中的VEGF;D组与B组有统计学差异(P<0.05),说明HIF-1α转染能增加VEGF的表达。见表1。
7 Image pro-Plus测量神经元轴突长度 神经元与BMSCs厌氧共培养48 h后,倒置相差显微镜观察神经元生长情况:B、C、D、E 4组轴突长度明显大于A组(P<0.05),说明BMSCs与神经元共培养能够促进神经元轴突的生长;B组的轴突长度大于A组(P<0.05),说明BMSCs共培养能促进轴突的生长;C、D两组与B组相比有统计学差异(P<0.05),说明NGFβ转染的BMSCs和HIF-1α转染的BMSCs对神经元轴突生长的促进作用大于未转染的BMSCs;E组与C、D两组相比有统计学差异(P<0.05),说明NGFβ/HIF-1α双重转染的BMSCs对神经元轴突生长的促进作用大于单一转染的BMSCs,NGFβ和HIF-1α可能存在协同作用。见图6、图7。
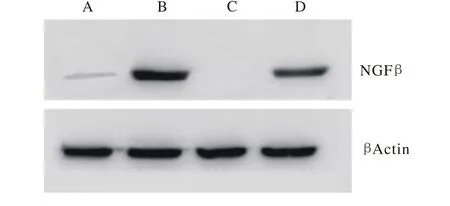
图 3 Western blot检测转染后BMSCs的NGFβ表达Fig. 3 Expression of NGFβof transfected BMSCs detected by Western blot A: non-transfected group; B: NGFβ transfected group; C: HIF-1αtransfected group; D: NGFβ/ HIF-1αdouble transfected group
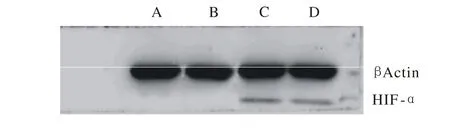
图 4 Western blot检测转染后BMSCs的HIF-1α表达Fig. 4 Expression of HIF-1αof transfected BMSCs detected by Western blot A: non-transfected group; B: NGFβ transfected group; C: HIF-1αtransfected group; D: NGFβ/ HIF-1αdouble transfected group
图 5 神经元培养1 d (×200)Fig. 5 Neurons cultured for 1 day (× 200)
表1 ELISA检测培养上清中NGFβ、HIF-1α、VEGF的表达Tab. 1 Expression of NGF β, HIF-1 α, VEGF detected by ELISA (±s, n=6)
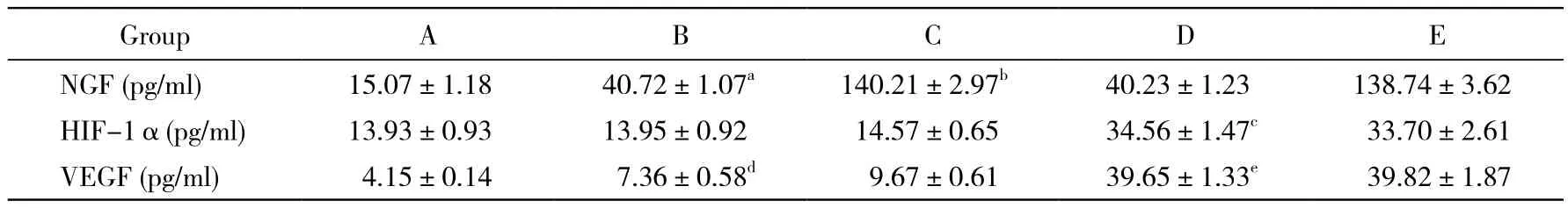
表1 ELISA检测培养上清中NGFβ、HIF-1α、VEGF的表达Tab. 1 Expression of NGF β, HIF-1 α, VEGF detected by ELISA (±s, n=6)
aP<0.05, vs group A;bP<0.05, vs group B;cP<0.05, vs group B;dP<0.05, vs group A ;eP<0.05, vs group B
GroupABCDE NGF (pg/ml)15.07±1.1840.72±1.07a140.21±2.97b40.23±1.23138.74±3.62 HIF-1α(pg/ml)13.93±0.9313.95±0.9214.57±0.6534.56±1.47c33.70±2.61 VEGF (pg/ml)4.15±0.147.36±0.58d9.67±0.6139.65±1.33e39.82±1.87
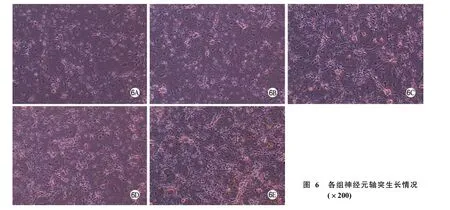
图 6 各组神经元轴突生长情况(×200)Fig. 6 Growth of neuron axon in each group detected by light microscopy (×200) A: neuron cultured alone; B: neuron co-cultured with BMSCs; C: neuron co-cultured with NGFβ transfected BMSCs; D: neuron co-cultured with HIF-1αtransfected BMSCs; E: neuron co-cultured with NGFβ/HIF-1αdouble transfected BMSCs
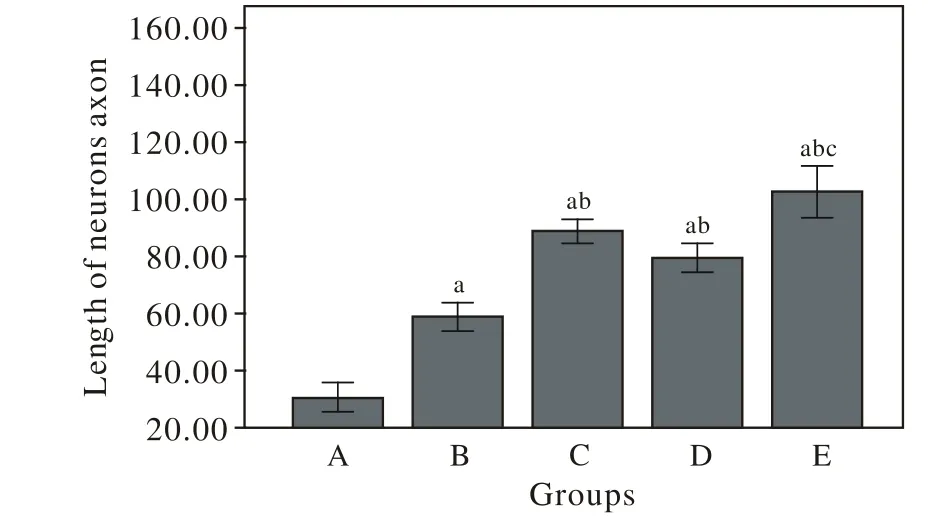
图 7 各组神经元轴突长度单因素方差分析结果 (±s, n=20)Fig. 7 Results of one-way ANOVA of neurons axon length in each group (±s, n=20)aP<0.05, vs group A;bP<0.05, vs group B;cP<0.05, vs group C and group D
讨 论
NGF是神经营养因子家族中的重要成员,在周围神经生长发育的过程和保持中枢神经胆碱能神经元功能方面发挥着重要作用,在促进轴突再生方面也发挥重要作用[12]。Sharma[13]研究了NGF在大鼠发育过程中的表达情况,结果表明,在脊髓组织中NGF受体的RNA表达量很低,在正常情况下不能对NGF产生应答反应。De Laporte等[14]应用Northern斑点杂交的方法研究了大鼠脊髓损伤后NGF受体RNA的表达情况,结果显示,在脊髓损伤后4 d,受损区域的NGF受体RNA表达量显著增多;7 d时表达量达到峰值,为正常情况下的6倍左右;28 d时,其表达量仍然维持在正常水平的4倍左右。本实验中,我们构建了表达NGFβ的慢病毒载体,Western blot结果显示,NGFβ转染的BMSCs成功表达了目的基因NGFβ。
HIF-1是一个螺旋-环-螺旋结构的转录因子,在哺乳动物生长发育过程中起重要作用。随着细胞氧浓度降低,HIF-1转录活性和HIF-1α表达呈指数增加。HIF-1是由HIF-1α和HIF-1β亚基组成的异源二聚体[15]。其中HIF-1α亚基的表达和激活与细胞氧浓度密切相关。在缺氧条件下,HIF-1α能够激活促红细胞生成素、葡萄糖转运体、糖酵解酶、VEGF等的基因转录过程,这些蛋白可以提高细胞的氧输送和促进代谢适应低氧环境的能力。本实验中,我们构建了表达HIF-1α的慢病毒载体,Western blot结果显示,HIF-1α转染的BMSCs成功表达了目的基因HIF-1α;神经元培养上清液ELISA结果显示,D组的HIF-1α和VEGF的含量大于B组,说明HIF-1α能够上调VEGF的表达,与前人研究结果相吻合。神经元轴突长度测量结果显示,D组的神经元轴突长度大于B组,说明微环境中存在的HIF-1α能够提高神经元对抗缺氧环境的能力,促进轴突的生长。
Malgieri等[16]的研究表明,移植BMSCs具有降低神经元脱髓鞘,减少神经抑制分子,促进轴突再生,引导轴突生长的作用。本实验中Image pro-Plus测量神经元轴突长度的结果显示,B组轴突长度与A组相比,有明显差异,说明BMSCs能够促进轴突的生长,与前人研究结果一致。Lujan等[17]的研究表明,在脊髓损伤后出现NGF受体RNA的显著增高与运动和感觉神经的传导通路受损相关,其原因在于脊髓损伤后增加NGF可抑制神经元进一步发生坏死和凋亡,在保护神经元方面发挥了重要作用。在本实验中,神经元轴突长度的测量结果显示,C组的轴突长度大于B组,说明NGFβ能够促进神经元轴突的生长,与前人的研究结果相符。HIF-1α作为氧含量调控通路中重要的蛋白质,通过启动靶基因中低氧作用元件,促使低氧相关基因进行转录并翻译保护蛋白,进而使组织和细胞在缺血和缺氧的环境中耐受性增强[18]。在本实验中,NGFβ/HIF-1α双重转染的BMSCs与神经元共培养组,在厌氧环境下,神经元轴突的生长情况好于单独转染NGFβ和HIF-1α的BMSCs组,这一点证实了我们的推测:NGFβ和HIF-1α可能发挥协同作用,促进神经元轴突再生。但是,对于两者如何发挥协同作用,以及相互作用的机制尚不明确,有待进一步的研究。
1 Tator CH. Review of treatment trials in human spinal cord injury: Issues, difficulties, and recommendations[J]. Neurosurgery,2006, 59(5): 957-982.
2 Fehlings MG, Vawda R. Cellular treatments for spinal cord injury:the time is right for clinical trials[J]. Neurotherapeutics, 2011, 8(4):704-720.
3 Tetzlaff W, Okon EB, Karimi-Abdolrezaee SA, et al. A systematic review of cellular transplantation therapies for spinal cord injury[J]. J Neurotrauma, 2011, 28(8, SI): 1611-1682.
4 Sun C, Zhang H, Li J, et al. Modulation of the major histocompatibility complex by neural stem cell-derived neurotrophic factors used for regenerative therapy in a rat model of stroke[J]. J Transl Med, 2010, 8: 77.
5 Ratcliffe PJ, O'Rourke JF, Maxwell PH, et al. Oxygen sensing,hypoxia-inducible factor-1 and the regulation of mammalian gene expression[J]. J Exp Biol, 1998, 201(Pt 8):1153-1162.
6 Chen MH, Ren QX, Yang WF, et al. Influences of HIF-lα on Bax/ Bcl-2 and VEGF expressions in rats with spinal cord injury[J]. Int J Clin Exp Pathol, 2013, 6(11): 2312-2322.
7 Sato K, Morimoto N, Kurata T, et al. Impaired response of hypoxic sensor protein HIF-1 alpha and its downstream proteins in the spinal motor neurons of ALS model mice[J]. Brain Res, 2012, 1473:55-62.
8 Ding JY, Kreipke CW, Schafer PA, et al. Synapse loss regulated by matrix metalloproteinases in traumatic brain injury is associated with hypoxia inducible factor-1 alpha expression[J]. Brain Res, 2009,1268: 125-134.
9 Lu XM, Shu YH, Qiu CH, et al. Protective effects and anti-apoptotic role of nerve growth factor on spinal cord neurons in sciatic nerveinjured rats[J/OL]. http://www.maneyonline.com/doi/abs/10.11 79/1743132814Y.0000000333?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%3dpubmed
10 Zhang Y, Gao FY, Wu DS, et al. Lentiviral mediated expression of a NGF-soluble Nogo receptor 1 fusion protein promotes axonal regeneration[J]. Neurobiol Dis, 2013, 58: 270-280.
11 Beaudoin GM 3rd, Lee SH, Singh D, et al. Culturing pyramidal neurons from the early postnatal mouse hippocampus and cortex[J]. Nat Protoc, 2012, 7(9):1741-1754.
12 魏昌秀,代宏,陈松林.脑源性神经营养因子基因修饰骨髓间质干细胞移植痴呆大鼠大脑皮质及海马tau蛋白、β-淀粉样蛋白及神经元超微结构的变化[J] .中国组织工程研究与临床康复,2010,14(45):8421-8425.
13 Sharma HS. Selected combination of neurotrophins potentiate neuroprotection and functional recovery following spinal cord injury in the rat[J]. Acta Neurochir Suppl, 2010, 106:295-300.
14 De Laporte L, Huang A, Ducommun MM, et al. Patterned transgene expression in multiple-channel bridges after spinal cord injury[J]. Acta Biomater, 2010, 6(8): 2889-2897.
15 Lemus-Varela ML, Flores-Soto ME, Cervantes-Munguia R, et al. Expression of HIF-1 alpha, VEGF and EPO in peripheral blood from patients with two cardiac abnormalities associated with hypoxia[J]. Clin Biochem, 2010, 43(3): 234-239.
16 Malgieri A, Kantzari E, Patrizi MP, et al. Bone marrow and umbilical cord blood human mesenchymal stem cells: state of the art[J]. Int J Clin Exp Med, 2010, 3(4): 248-269.
17 Lujan HL, Palani G, Dicarlo SE. Structural neuroplasticity following T5 spinal cord transection: increased cardiac sympathetic innervation density and SPN arborization[J]. Am J Physiol Regul Integr Comp Physiol, 2010, 299(4): R985-R995.
18 Celik M, Gokmen N, Erbayraktar S, et al. Erythropoietin prevents motor neuron apoptosis and neurologic disability in experimental spinal cord ischemic injury[J]. Proc Natl Acad Sci U S A, 2002,99(4): 2258-2263.
Effect of NGFβ/HIF-1α double transfected BMSCs on neuron axonal regeneration
ZHUANG Pei-yuan, LYU Gang, FAN Zhong-kai, LI Yong-ming, ZHANG Yu-qiang, JIA Zhi-qiang
First Affiliated Hospital of Liaoning Medical College, Jinzhou 121000, Liaoning Province, China
LYU Gang. Email: ganglv-sy@163.com; FAN Zhong-kai. Email: flanzz@163.com
ObjectiveTo observe the improvement of axonal regeneration microenvironment affected by NGFβ/HIF-1α double gene transfected bone marrow mesenchymal stem cells, and provide information about neuron axonal regeneration in microenvironment.MethodsLentiviral vector encoding NGFβ and HIF-1α were constructed and MOI were used to transfect BMSCs, then the expression of NGFβ and HIF-1α were detected by using western blot. Co-culture system with transwell double plates which include neurons and transfected BMSCs were constructed and then it was put in anaerobic tank for 48 hours, the expression of NGFβ, HIF-1α and VEGF in culture medium were detected by ELISA and the length of axons were measured by using Image pro-Plus software. There were five groups in this study, Group A: neuron without BMSCs; Group B: neuron with BMSCs; Group C: neuron with NGFβ transfected BMSCs; Group D: neuron with HIF-1α transfected BMSCs; Group E: neuron with NGFβ/HIF-1α double transfected BMSCs.ResultsThe transfection efficiency of Le-RFP-NGF and Le-GFP-HIF-1α was 84.83% and 89.63%, respectively. Western blot analysis showed that transfected BMSCs could express the target protein NGFβ and HIF-1α. ELISA analysis of the co-culture system showed that the expression of NGFβ in Group C and Group E was significantly higher than in Group A and Group B (P<0.05), the expression of HIF-1α in Group D and Group E was significantly higher than in Group A and Group B (P<0.05). The expression of VEGF in Group D and Group E was significantly higher than in Group A and Group B. Image pro-Plus measurement showed that axon length of Group C, Group D and Group E was greater than that of Group A and Group B (P<0.05), furthermore, axon length of Group E (neuron with NGFβ/HIF-1α double transfected BMSCs) was greater than that of Group C and Group D (P<0.05).ConclusionThe axons co-cultured with NGFβ/HIF-1α double transfected BMSC grow well and NGFβ, HIF-1α and VEGF, which play important roles in neuronal survival, are highly expressed in the coculture environment.
R 338.1
A
2095-5227(2014)11-1141-06
10.3969/j.issn.2095-5227.2014.11.017
时间:2014-07-31 09:59 网络出版地址:http://www.cnki.net/kcms/detail/11.3275.R.20140731.0959.001.html
2014-05-15
国家自然科学基金项目(81101421)
Supported by the National Natural Science Foundation of China(81101421)
庄培袁,男,在读硕士。研究方向:脊髓损伤与修复。Email: obey0305@126.com
吕刚,男,主任医师,教授,博士生导师。Email: ganglv-sy@163.com;范仲凯,男,副主任医师,副教授,硕士生导师。Email: flanzz@163.com
