K-ras基因突变型晚期大肠癌患者一线化疗及靶向治疗疗效分析
2014-07-07夏学明毛志远张婷婷王李杰
夏学明,毛志远,张婷婷,苏 丹,王李杰,白 莉
解放军总医院 肿瘤内一科,北京 100853
K-ras基因突变型晚期大肠癌患者一线化疗及靶向治疗疗效分析
夏学明,毛志远,张婷婷,苏 丹,王李杰,白 莉
解放军总医院 肿瘤内一科,北京 100853
目的探讨K-ras基因突变型晚期大肠癌患者一线化疗及联合靶向治疗方案的疗效。方法回顾性分析2008年1月-2013年12月本院收治的经病理确诊的55例K-ras基因突变型晚期大肠癌患者的临床及病理特征,并行疗效观察及生存分析。结果随访至2013年12月31日,55例中45例(81.8%)死亡,中位总生存期为14.4个月,中位无进展生存期为5.7个月,1年生存率为66%。在客观缓解率方面,奥沙利铂组客观缓解率(objective response rate,ORR) (32%)较伊立替康组ORR(23.1%)高,伊立替康+ BEV组ORR(37.5%)较伊立替康组ORR(23.1%)高,但差异均无统计学意义;在疾病控制率方面,伊立替康+BEV组治疗疾病控制率(disease control rate,DCR)(100%)较伊立替康组DCR(84.6%)高,但亦无统计学差异。结论K-ras突变型患者使用以奥沙利铂为主的化疗方案更有利于客观缓解率的提高;化疗联合贝伐珠单抗对于K-ras突变型患者生存期的延长显示出一定作用。
K-ras基因;大肠癌;化学疗法;靶向治疗
大肠癌是全球最常见的恶性肿瘤之一,在我国大肠癌的发病率有逐渐增高的趋势,死亡率仅次于肺癌和肝癌,为恶性肿瘤第3位[1-2]。约40%的大肠癌患者确诊时已是晚期,而行根治性手术的患者中约50%会复发、转移。尽管化学治疗方案的改进、分子靶向治疗药物的应用以及各种细胞免疫治疗等正在逐渐改善大肠癌的预后,但是晚期大肠癌的预后仍不理想,尤其是K-ras基因突变型患者预后更差。本文针对K-ras基因突变型晚期大肠癌患者,探讨其临床病理特征与预后的关系、分析各种一线化疗及联合靶向治疗的疗效,为K-ras突变型大肠癌的预后判断及治疗方案的选择提供一定的理论依据,从而在一定程度上提高晚期大肠癌的整体治疗效果。
资料和方法
1 资料 收集2008年1月- 2013年12月本院收治、经病理确诊的K-ras基因突变型晚期大肠癌患者81例,其中55例被纳入本研究。纳入标准:经病理确诊为大肠癌、K-ras基因状态为突变型,临床分期为Ⅳ期、Karnofsky评分≥70分,随访资料完整,具有正常的肝肾功能和血常规指标,签署知情和化疗同意书者。排除标准:术前进行过新辅助化疗或放疗、器官移植、妊娠或哺乳者。收集的临床资料包括性别、年龄、病灶部位、病理类型、K-ras基因状态,转移器官个数、远处转移部位、化疗及靶向治疗方案、病情进展及死亡时间。
2 分组与治疗方法 分别选择奥沙利铂联合氟尿嘧啶类或伊立替康联合氟尿嘧啶类的化疗方案进行晚期一线化疗或联合贝伐珠单抗进行靶向治疗。具体用法:使用奥沙利铂85 mg/m2d1或伊立替康180 mg/m2d1联合氟尿嘧啶类药物:5-氟尿嘧啶(5-Fu) 400 mg/m2静推d1 + 5-Fu 2 400 mg/m2持续静滴46 h +亚叶酸钙400 mg/m2d1,14 d为1周期或口服卡培他滨1.0 g/m2,每日2次,d1 ~ 14,21 d为1疗程;贝伐珠单抗注射液(bevacizumab,BEV) 5 mg/kg,静脉滴注,于化疗当天使用,每2周1次。稳定和有效的患者继续给予原方案化疗,直至病情进展、出现不能耐受的毒性或患者拒绝接受化疗。其中入选伊立替康组13例,包括FOLFIRI方案10例,XELIRI方案3例;奥沙利铂组25例,包括FOLFOX方案18例,XELOX方案7例;伊立替康+ BEV组8例;奥沙利铂+ BEV组9例。各组基线资料见表1。
3 疗效评价及随访方式 入组患者接受治疗后,每周行血常规检查,每周期行肝肾功能及心电图检查,每1.5个月行胸、腹、盆腔CT、浅表淋巴结超声等常规检查,必要时行MRI、骨扫描及PET-CT扫描,复查入组患者肿瘤变化,再进行疗效判定。患者化疗不超过15个周期,平均6个化疗周期。疗效评价标准:按RECIST1.1版制定的抗肿瘤药物近期客观疗效评价标准,分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、稳定(stability of disease,SD)以及进展(progress of disease,PD)。客观缓解率(objective response rate,ORR)为(CR + PR)的例数占所有病例的百分比,疾病控制率为(disease control rate,DCR)为(CR + PR + SD)的例数占所有病例的百分比;以ORR及DCR作为近期疗效的评价指标。总生存时间(overall survival,OS)的定义以患者开始行一线化疗的日期为起点,以月为计算单位,到患者死亡或随访结束时间(2013年12月31日);无进展生存时间(progress free survival,PFS)的定义以患者开始行一线化疗的日期为起点,以月为计算单位,肿瘤复发或患者死亡的时间为截止日期。至统计截止日期仍存活或未进展者作为删失值处理。以OS及PFS作为远期疗效的评价指标。随访方式为电话随访。
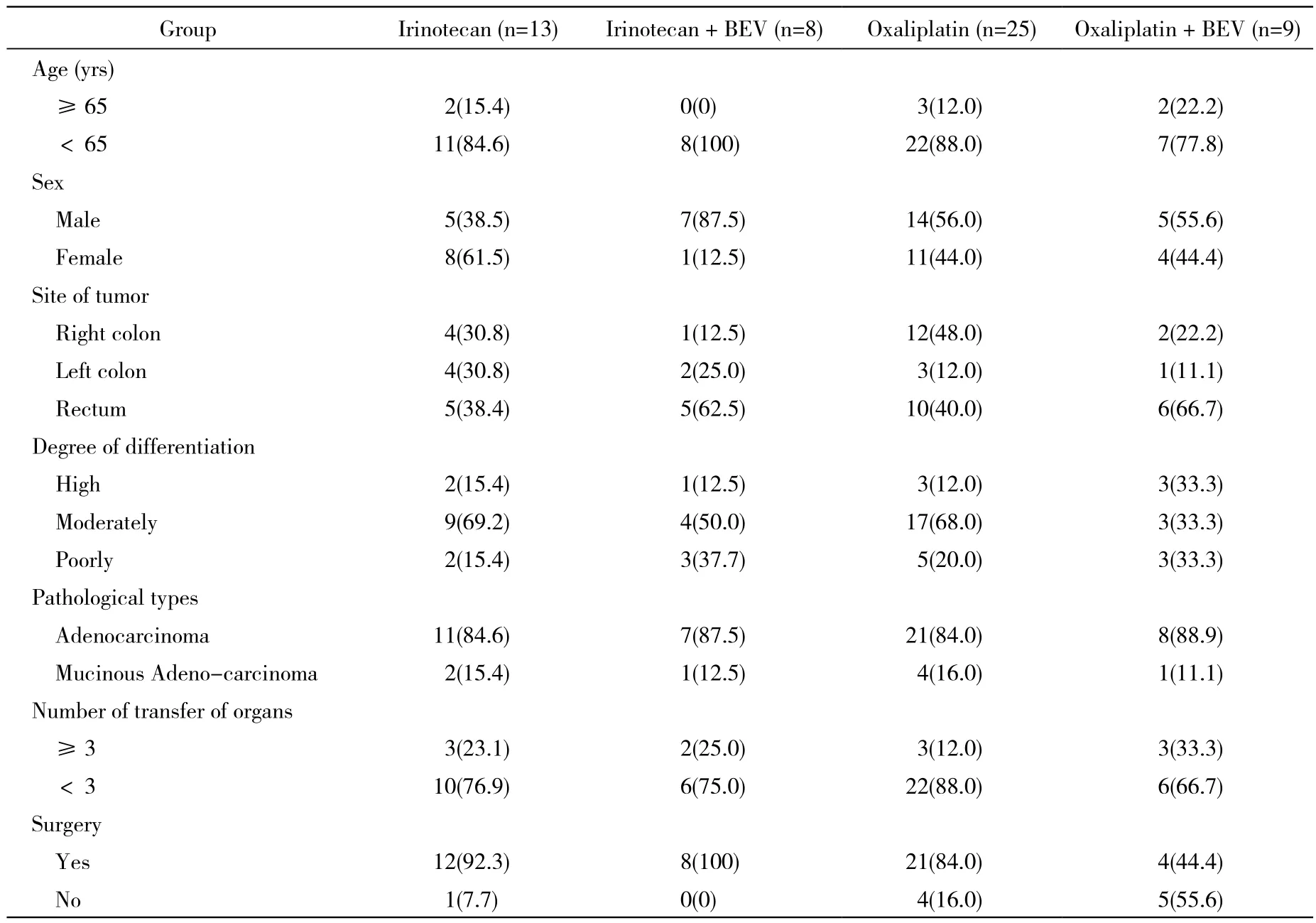
表1 55例大肠癌患者临床资料Tab. 1 Clinical parameters of 55 patients included in this study (n,%)
4 统计学方法 采用SPSS13.0统计软件分析数据。率的比较采用χ2检验,采用Kaplan-Meier乘积极限法绘制生存曲线,Log-rank检验进行生存时间的单因素分析,P<0.05为差异有统计学意义。
结 果
1 临床特征 55例中,男性30例,女性25例;年龄24 ~ 72岁,中位年龄53岁;病灶部位在近端结肠(回盲部、升结肠、横结肠)19例(34.5%),远端结肠(降结肠、乙状结肠)10例(18.2%),直肠26例(47.3%);病理类型中腺癌44例(80%),黏液腺癌2例(3.6%),腺癌和黏液腺癌混合6例(11%),其他癌3例;单器官转移43例(78.2%),多器官转移12例(21.8%);肝转移37例,肺转移20例,骨转移4例,腹腔转移10例;10例原发病灶未行手术切除,19例在发现远处转移前曾行辅助化疗。
2 K-ras基因突变位点分布 55例中,12位点突变37例(67.3%)(分别为G→A19例,G→T7例,其余11例不明确),13位点突变11例(20%)(G→A6例,其余5例不明),61位点突变2例(3.6%)(A→T2例),不明位点突变5例(9.1%)。
3 近期疗效 4组方案(伊立替康组,伊立替康+ BEV组,奥沙利铂组,奥沙利铂+ BEV组)治疗的ORR分别为23.1%(3/13)、37.5%(3/8)、32%(8/25)和11.1%(1/9);DCR分别为84.6%(11/13)、100% (8/8)、76%(19/25)和66.7%(6/9)。各组比较差异均无统计学意义。见表2。
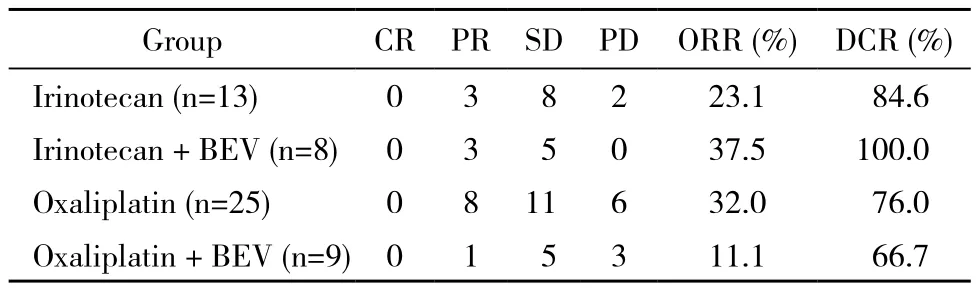
表2 不同化疗方案近期疗效比较Tab. 2 Recent efficacy of different chemotherapy regimens
4 远期疗效 截止2013年12月31日,55例患者中,45例(81.8%)死亡,中位总生存期(median overall survival,mOS)为14.4个月,中位无进展生存期(median progress free survival,mPFS)为5.7个月,1年生存率为66%。4组方案(伊立替康组,伊立替康+ BEV组,奥沙利铂组,奥沙利铂+ BEV组)治疗的mPFS分别为6.5个月、5.7个月、6.7个月、3.5个月;mOS分别为13.1个月、18.4个月、13.7个月、14.4个月。各组差异均无统计学意义(P>0.05)。见图1,图2。
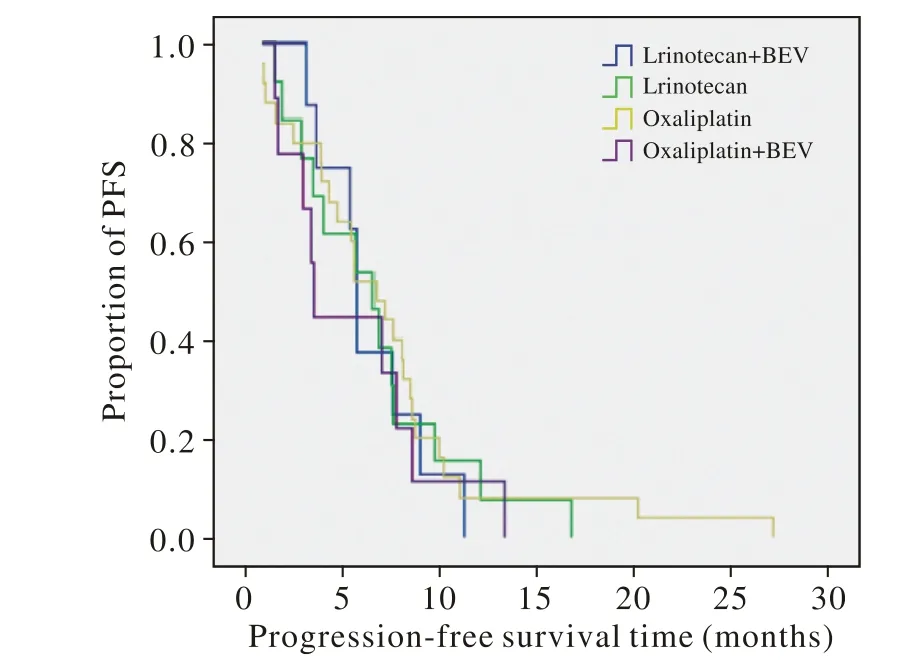
图 1 化疗及靶向治疗对PFS的影响Fig. 1 Effect of chemotherapy and targeted therapy on PFS
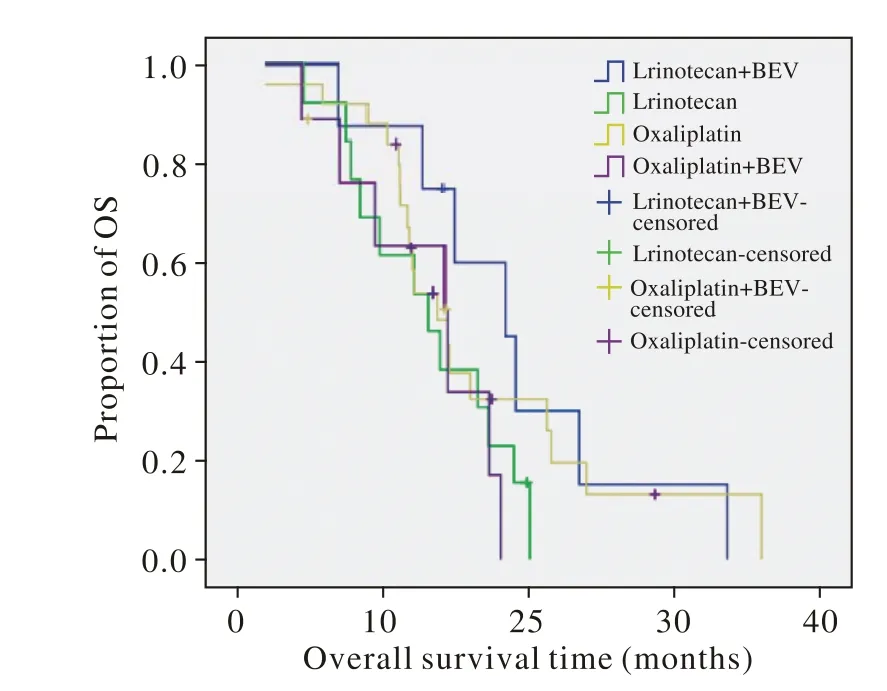
图 2 化疗及靶向治疗对OS的影响Fig. 2 Effect of chemotherapy and targeted therapy on OS
讨 论
虽然大肠癌的发生、发展机制目前尚未完全清楚,但K-ras基因突变在大肠癌中发挥重要的作用已达成共识。该基因突变以点突变为主,常见于12、13密码子,其他密码子突变较为少见。K-ras基因编码具有GTP酶活性的Ras蛋白,该蛋白在ERK信号途径介导细胞对内皮生长因子的反应并在细胞的增殖、分化及凋亡中发挥重要作用,K-ras基因发生突变时,Ras蛋白结构发生改变,与GTP的结合力减弱,GTP酶活性降低,使之失去信息转导作用,导致细胞处于无节制的分裂和增殖状态,最终发生癌变[3]。目前国内外报道显示大肠癌原发灶中K-ras突变率为30% ~ 50%,其中12、13密码子突变>95%,12密码子突变率高于13密码子[4-6]。本组55例K-ras基因突变型患者中,12位点突变67.3%,13位点突变20%,61位点突变3.6%,不明位点突变9.1%,此结果与上述文献报道类似。同时从CRYSTAL研究得知一线应用FOLFIRI化疗方案时,K-ras野生型患者较突变型患者更能获益,ORR分别为39.7%和36.1%,mPFS分别为8.4个月和7.7个月,mOS分别为20个月和16.7个月[7]。而后来的OPUS研究则提示一线应用FOLFOX化疗方案时,K-ras突变型患者较野生型患者有获益趋势,ORR分别为49%和37%,mPFS分别为8.6个月和7.2个月[8]。本研究中的疗效略低于上述临床研究,且伊立替康组与奥沙利铂组比较无论是mPFS(6.5个月vs 6.7个月)还是mOS(13.1个月vs 13.7个月),差异均无统计学意义,但奥沙利铂组客观缓解率较伊立替康组高(32% vs 23.1%),故对于K-ras基因突变型患者,一线化疗以奥沙利铂为主的化疗方案更有利于客观缓解率的提高,这与上述临床研究在K-ras突变型患者中FOLFOX方案对FOLFIRI方案ORR为49%和36.1%一致。
K-ras基因突变是大肠癌中最常见的癌基因突变之一,与预测患者抗EGFR靶向治疗疗效有关。Liè vre等[9]和Khambata-Ford等[10]的研究以及Jonker等[11]进行的国际Ⅲ期临床实验研究表明,检测大肠癌的K-ras基因状态可以预测患者对西妥昔单抗治疗的敏感性,野生型患者可从中获益,而突变型则不能获益。该结论亦被CRYSTAL及OPUS研究证实。因K-ras基因突变型患者不能从化疗联合西妥昔单抗靶向治疗中获益,故对于这部分患者行化疗联合贝伐珠单抗治疗值得研究。本研究提示一线化疗方案是否联合靶向治疗对PFS无明显影响。而对OS的生存分析中,伊立替康+ BEV组较伊立替康组OS(18.4个月vs 13.1个月)延长,提示针对K-ras突变型晚期大肠癌患者,化疗联合贝伐珠单抗对生存期的延长显示出一定作用。在近期疗效方面,本研究亦提示伊立替康+ BEV组客观缓解率较伊立替康组高(37.5% vs 23.1%);伊立替康+ BEV组疾病控制率亦较伊立替康组高(100% vs 84.6%)。虽在客观缓解率及疾病控制率方面均无统计学差异,但亦提示K-ras突变型晚期大肠癌患者行化疗联合贝伐珠单抗治疗对于近期疗效的改善有一定意义。
综上所述,K-ras突变型患者使用以奥沙利铂为主的化疗方案更有利于客观缓解率的提高;化疗联合贝伐珠单抗对于K-ras突变型患者生存期的延长显示出一定作用。由于各组间的某些不均衡性,以及样本例数少和观察期短等因素,本研究所得结论还需进一步研究验证。
1 赖少清,鞠凤环,王贵齐,等.2004 - 2008年704例大肠癌临床流行特征[J].中国肿瘤,2010,19(2):111-113.
2 Jemal A, Siegel R, Ward E, et al. Cancer statistics, 2009[J]. CA Cancer J Clin, 2009, 59(4):225-249.
3 Marshall CJ. Small GTPases and cell cycle regulation[J]. Biochem Soc Trans, 1999, 27(4):363-370.
4 Poehlmann A, Kuester D, Meyer F, et al. K-ras mutation detection in colorectal cancer using the Pyrosequencing technique[J]. Pathol Res Pract, 2007, 203(7): 489-497.
5 Shen H, Yuan Y, Hu HG, et al. Clinical significance of K-ras and BRAF mutations in Chinese colorectal cancer patients[J]. World J Gastroenterol, 2011, 17(6): 809-816.
6 Mannan A, Hahn-Strömberg V. K-ras mutations are correlated to lymph node metastasis and tumor stage, but not to the growth pattern of colon carcinoma[J]. APMIS, 2012, 120(6): 459-468.
7 Van Cutsem E, Köhne CH, Láng I, et al. Cetuximab plus irinotecan, fluorouracil, and leucovorin as first-line treatment for metastatic colorectal cancer: updated analysis of overall survival according to tumor KRAS and BRAF mutation status[J]. J Clin Oncol, 2011, 29(15): 2011-2019.
8 Bokemeyer C, Bondarenko I, Makhson A, et al. Fluorouracil,leucovorin, and oxaliplatin with and without cetuximab in the firstline treatment of metastatic colorectal cancer[J]. J Clin Oncol,2009, 27(5):663-671.
9 Lièvre A, Bachet JB, Le Corre D, et al. KRAS mutation status is predictive of response to cetuximab therapy in colorectal cancer[J]. Cancer Res, 2006, 66(8): 3992-3995.
10 Khambata-Ford S, Garrett CR, Meropol NJ, et al. Expression of epiregulin and amphiregulin and K-ras mutation status predict disease control in metastatic colorectal cancer patients treated with cetuximab[J]. J Clin Oncol, 2007, 25(22): 3230-3237.
11 Jonker DJ, O'Callaghan CJ, Karapetis CS, et al. Cetuximab for the treatment of colorectal cancer[J]. N Engl J Med, 2007, 357(20):2040-2048.
First-line chemotherapy and targeted therapy efficacy analysis in advanced colorectal cancer patients with K-ras gene mutations
XIA Xue-ming, MAO Zhi-yuan, ZHANG Ting-ting, SU Dan, WANG Li-jie, BAI Li
Department of Oncology, Chinese PLA General Hospital, Beijing 100853, China
BAI Li. Email: baili_0795@163.com
ObjectiveTo explore the efficacy of first-line chemotherapy and targeted therapy in advanced colorectal cancer patients with K-ras gene mutations.MethodsClinical data about 55 advanced colorectal cancer patients with K-ras gene mutations who
therapy in our hospital from January 2008 to December 2013 were retrospectively analyzed.ResultsFollow-up was done till December 31, 2013, of the 55 patients, 45 patients (81.8%) died, the median overall survival (mOS) was 14.4 months, the median progression free survival (mPFS) was 5.7 months, and the 1-year survival rate was 66%. In terms of objective response rate, the firstline chemotherapy Oxaliplatin group had a better ORR compared with Irinotecan group (32% vs.23.1%), while the Irinotecan + BEV group had a better ORR compared with Irinotecan group (37.5% vs.23.1%), but the difference was not statistically significant. In terms of disease control rate, the Irinotecan + BEV group had a better DCR compared with Irinotecan group (100% vs.84.6%) with no statistically significant difference.ConclusionOxaliplatin-based chemotherapy is more conductive to improve objective response rate for K-ras gene mutations patients, chemotherapy combined with bevacizumab shows some effect on prolonging survival time of K-ras gene mutations patients.
K-ras gene; colorectal cancer; chemotherapy; targeted therapy
R 735.3+4
A
2095-5227(2014)11-1101-04
10.3969/j.issn.2095-5227.2014.11.006
时间:2014-07-15 09:51 网路出版地址:http://www.cnki.net/kcms/detail/11.3275.R.20140717.1754.003.html
2014-05-07
夏学明,男,在读硕士,医师。研究方向:胃肠道肿瘤。Email: xia_xueming@126.com
白莉,女,博士,主任医师,教授,博士生导师。Email: baili_0795@163.com
