CYP2D6*10基因型与接受他莫昔芬治疗乳腺癌患者的生存率的相关性研究
2014-07-07魏影,徐喆
魏 影,徐 喆
(安徽省马鞍山市妇幼保健院药剂科,安徽 马鞍山 243011)
CYP2D6*10基因型与接受他莫昔芬治疗乳腺癌患者的生存率的相关性研究
魏 影,徐 喆
(安徽省马鞍山市妇幼保健院药剂科,安徽 马鞍山 243011)
目的 研究 CYP2D6*10基因型对接受他莫昔芬(tamoxifen,TAM)治疗乳腺癌患者的生存率相关性的影响。方法 选择该院乳腺外科2008—2003年收治的257名接受 TAM治疗乳腺癌患者。调查 TAM使用情况和生存状态等相关资料;采集患者外周静脉血5 mL或石蜡切片用于DNA提取;用PCR技术检测CYP2D6*10基因多态性;查明CYP2D6*10基因多态性与患者的生存率相关性的关系。结果 该次研究中,携带CYP2D6*10/*10患者占15%(38/257),CYP2D6野生型(Wt)/* 10患者占41%(105/257)和CYP2D6Wt/Wt占44%(114/257)。各CYP2D6*10基因型的临床病理参数之间没有相关性差异。在中国CYP2D6*10/*10基因型对接受TAM治疗乳腺癌患者的DFS和OS的影响CYP2D6Wt/Wt和CYP2D6Wt/*10基因型是类似(P>0.05),不存在相关性。结论 研究结果显示,CYP2D6*10基因型与接受 TAM治疗乳腺癌患者的生存率之间没有相关性。
CYP2D6;CYP2D6*10;乳腺癌;他莫昔芬
乳腺癌辅助内分泌治疗是乳腺癌综合治疗中的重要方式,TAM又名三苯氧胺,为人工合成的非胆固醇类抗雌激素药物,是内分泌辅助治疗乳腺癌的基础药物。TAM与雌激素受体结合后,诱导改变受体的三维空间构型,阻止受体与DNA上雌激素有关反应成分相结合,使转录等过程不能正常进行,阻止雌激素发挥作用,抑制激素依赖性乳腺肿瘤细胞的生长,达到治疗乳腺癌的作用[1]。
CYP2D6是催化 TAM生成 4-羟-N-去甲基他莫昔芬(Endoxifen)的关键酶。CYP2D6由 497个氨基酸组成,有100多种等位基因变异,这些变异可以产生体内酶活性的差异变化。CYP2D6变异等位基因引起其酶活性的下降,所以导致乳腺癌患者对 TAM辅助治疗和预防效果下降。现在主要研究的是CYP2D6*2,*3,*4,*5,*6,*7,*8,*9,*10,*12,*14,*17,*29,*41和*XN,其中患者中普遍存在CYP2D6*5和CYP2D6*10(100C>T),Endoxifen代谢转化率活性较低[1-3]。
中国人中CYP2D6对最常见的等位基因是CYP2D6* 10突变率为57%,基因突变引起酶活性降[4]。CYP2D6 Wt/Wt和 CYP2D6 Wt/*10对 Endoxifen的催化活性高于CYP2D6*10/*10。CYP2 D6基因多态性与TAM引发不良反应,研究表明接受 TAM辅助治疗乳腺癌患者,引起癌症复发率和潮红等不良反应发生率升高[5]。在本研究旨在了解CYP2D6*10基因多态性与接受 TAM治疗的乳腺癌患者临床生存率的相关性。
1 资料与方法
1.1 研究对象 选择本院乳腺外科 2008—2003年收治的267名乳腺癌病人,平均年龄 58.4岁。收集受试者临床资料:姓名、年龄、肿瘤大小、临床分期等。
1.2 纳入标准 受试者纳入标准:(1)女性;(2)经病理切片确诊为原发乳腺恶性肿瘤;(3)ER为阳性;(4)乳腺癌TNM分期为 0~IV期;(5)服用2~5年TAM(20 mg· d-1),无服用其它药物。
1.3 方法
1.3.1 标本收集及基因组 DNA提取 对入选患者,采集其外周静脉血3 mL,EDTA抗凝,用常规苯酚-氯仿法提取血液样本 DNA,-80℃保存。对于无法采集外周静脉血的患者收集其石蜡组织切片,用 Invitrogen purelink genomic DNA kit提取 DNA,-80℃冰箱保存。
1.3.2 PCR扩增 根据NCBI基因库中CYP2D6的 DNA序列,设计CYP2D6*10引物序列,引物由上海生工合成。上游引物:5'-CCA TTT GGT AGT GAG GCA GGT AT-3';下游引物:5'-CACCAT CCA TGT TTG CTT CTG GT-3'。20 μL PCR反应体系:10×PCR buffer 2 μL,d NTP(2.5 mM)1 μL,上下游引物各 (10 μmol·L-1)0.5 μL,Taq DNA polymerase(5 U·μL-1)0.5 μL,DNA模板(100 ng)2.0 μL,ddH2O至20 μL。PCR扩增条件:95℃预变性10 min,95℃ 30 s、57℃ 45 s、72℃45 s,循环35次,最后72℃延伸10 min,4℃保温。10 μL PCR产物,加入 HphⅠ限制性内切酶(上海生工公司购买)37℃ 1 h。结果取5 μL PCR产物,于2.5%琼脂糖凝胶(含有溴化乙锭),在紫外灯下观察产物。
1.4 统计学分析 采用 SPSS 18.0软件进行统计学分析,χ2检验,t检验分别验证入选人群是否符合 Hardy-Weinberg遗传平衡定律,并比较各组及各亚组基因型频率和等位基因频率,用 Logistic回归模型计算优势比(OR)及 95%置信区间(95%CI)表明不同基因型组对生存率的风险。统计检验均为双侧概率检验,P<0.05差异有统计学意义。
2 结果
2.1 CYP2D6*10基因型和患者的特点 入选的257患者平均年龄为58.4岁。114名患者为CYP2D6 Wt/Wt,大约为44.36%;105名患者为CYP2D6 Wt/*10,大约为40.85%;38名患者为CYP2D6*10/*10,大约为14.79%。经 Hardy-Weinberg遗传平衡定律检验,其等位基因在两组分布符合遗传平衡,样本具有群体代表性。患者其他基本情况见表1。

表1 CYP2D6*10基因型和患者的特点[n(%)]
2.2 CYP2D6*10基因多态性对患者无病生存率的影响本次研究发现,CYP2D6*10/*10对接受TAM治疗乳腺癌患者的无病生存率(Disease-free survival,DFS)的影响与CYP2D6Wt/Wt和CYP2D6Wt/*10基因型是类似,无统计学有意义(P>0.05),具体见图1。将 CYP2D6*10基因各基因型纳入 Logistic回归分析,结果见表2。

图1 CYP2D6*10基因型对患者的 DFS的影响
2.3 CYP2D6*10基因多态性对患者总生存率的影响 本次研究发现,CYP2D6*10/*10对接受 TAM治疗乳腺癌患者的总生存率(Overall survival,OS)的影响与 CYP2D6Wt/Wt和CYP2D6Wt/*10基因型是类似,无统计学有意义(P >0.05)具体见图2。将CYP2D6*10基因各基因型纳入Logistic回归分析,结果见表2。

图2 CYP2D6*10基因型对患者的 OS的影响
3 讨论
目前研究发现 CYP2D6的基因突变超过100种,基因突变可以引起酶的活性及数量的变化,从而造成人类对特定药物代谢及疗效的差异,且呈现明显的个体及种族差异。在白种人中,CYP2D6*3,*4和*5是无效等位基因突变型。在接受TAM治疗的乳腺癌患者中,CYP2D6*4/*4基因型患者的复发率较高。另一组研究显示,在德国携带 CYP2D6*4,*5 和*41等位基因型患者具有更高的复发率和更短 DFS[6]。另一方面,有两项研究报道正好相反,携带CYP2D6*4等位基因患者有更好的治疗效果[7]。也有研究报道,接受TAM治疗的乳腺癌患者的 OS与 CYP2D6*4缺乏相关性[8]。
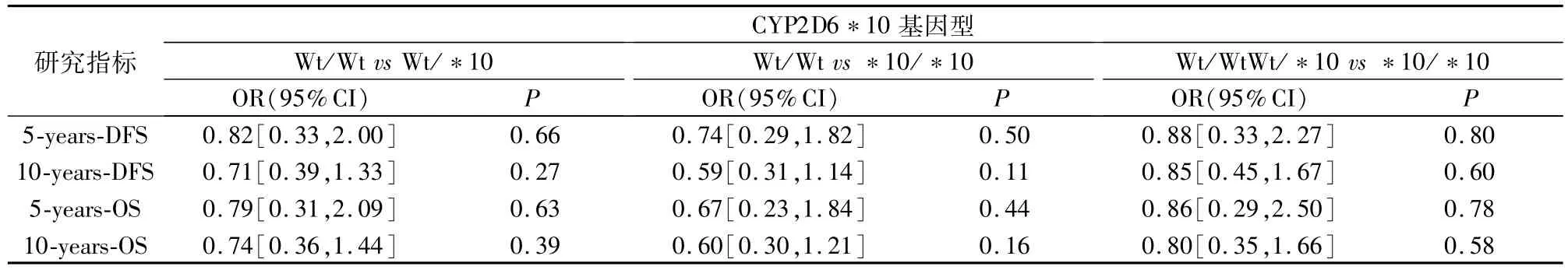
表2 CYP2D6*10基因型与患者生存率相关性的 Logistic回归分析
亚洲人群中最常见的突变体是 CYP2D6*10,其主要的突变位点是C100>T,使其代谢酶的表达活性降低。体外实验证明 CYP2D6*10突变型纯合子产生一种不稳定的代谢酶,其半衰期更短,活性更低。韩国研究发现,每天服用TAM的总剂量为20 mg,共计 8周以上的乳腺癌患者,携带CYP2D6*10/*10型患者的稳态 Endoxifen的血浆浓度明显低于其他基因型的患者。一项有关中国人乳腺癌患者的研究显示[9]:在 TAM治疗的乳腺癌患者中,与 CYP2D6Wt/*10型或 Wt/Wt型患者相比,*10/*10型的患者临床预后较差。在韩国接受 TAM治疗的转移性乳腺癌人群中,CYP2D6*10/*10基因频繁是最好[10]。同时有报道,对中国接受 TAM治疗的乳腺癌患者的DFS进行研究,发现携带CYP2D6*10/*10基因型的患者最差。报道的CYP2D6* 10的基因型与接受 TAM治疗乳腺癌患者的DFS具有相关性。在另方面,CYP2D6*10的基因型与接受 TAM治疗乳腺癌患者缺乏相关性。同时发现 CYP2D6*10的基因型与接受 TAM治疗乳腺癌患者的 DFS无相关性。
研究发现,对携带 CYP2D6*4/*4基因型的患者 Endoxifen的血药浓度,比 CYP2D6*4野生型低。在 CYP2D6 *10/*10患者血浆中 Endoxifen和4-羟基他莫昔芬浓度较低[11]。然而,TAM和 endoxifen对乳腺癌患者的最佳治疗浓度尚存在争议。Oxford研究发现,高剂量的 TAM(30~40 mg·d-1)与正常剂量(20 mg·d-1)相比在 DFS和 OS没有显著差异。此外,,低剂量的 TAM(1和 5 mg·d-1)与标准剂量(20 mg·d-1)对 Ki-67的表达基本一致。因此,这表明,可能低剂量的 TAM对乳腺癌患者也有治疗效果。虽然CYP2D6*10/*10基因型患者的 Endoxifen血浆浓度显示偏低,但可能仍然有足够的活性物质对乳腺癌患者产生一定 的疗 效[12]。
本次研究,因为病例相对较少,复发或死亡病例的数量有限,可能是很难准确估计 CYP2D6*10基因型与接受TAM治疗乳腺癌患者的生存率的相关性。本次研究认为,在中国CYP2D6*10/*10基因型对接受 TAM治疗乳腺癌患者的DFS和OS的影响CYP2D6Wt/Wt和CYP2D6Wt/* 10基因型是类似(P>0.05),可能不存在相关性,需要进一步研究。
[1] 濮之晨,汪五三,徐 喆,等.基因多态性对他莫昔芬治疗乳腺癌的影响与个体化用药进展[J].安徽医药,2013,17(7):1083-1086.
[2] Choi CI,Bae JW,Lee YJ,et al.Effects of CYP2C19 Genetic Polymorphisms on Atomoxetine Pharmacokinetics[J].J Clin Psychopharmacol,2014,34(1):139-142.
[3] 杨海霞.中药益气健脾和胃法治疗乳腺癌术后化疗胃肠道不良反应临床疗效观察[J].安徽医药,2013,17(11):1967-1968.
[4] 朱弘艳.乳腺癌术后并发症的预防及处理[J].安徽医药,2013,17(1):107-108.
[5] Chamnanphon M,Pechatanan K,Sirachainan E,et al.Association of CYP2D6 and CYP2C19 polymorphisms and disease-free survival of Thai post-menopausal breast cancer patients who received adjuvant tamoxifen[J].Pharmgenomics Pers Med,2013,24(6):37-48.
[6] 王红群,李道旺,吴正升.536例乳腺癌的临床病理特征及预后分析[J].安徽医药,2013,17(9):1536-1538.
[7] Zheng T,Su CH,Zhao J,et al.Effects of CYP3A5 and CYP2D6 genetic polymorphism on the pharmacokinetics of diltiazem and its metabolites in Chinese subjects[J].Pharmazie,2013,68(4):257-560.
[8] Jin TB,Ma LF,Zhang JY,et al.Polymorphisms and phenotypic analysis of cytochrome P450 2D6 in the Tibetan population[J].Gene,2013,527(1):360-365.
[9] 濮之晨,吴 敏.两种剂量福美司坦治疗晚期乳腺癌系统评价Meta分析[J].长治医学院学报,2013,27(4):264-268.
[10]Zhong Y,Zheng X,Miao Y,et al.Effect of CYP2D6*10 and APOE polymorphisms on the efficacy of donepezil in patients with Alzheimer's disease[J].Am J Med Sci,2013,345(3):222-226.
[11]Jager NG,Koornstra RH,Vincent AD,et al.Hot flashes are not predictive for serum concentrations of tamoxifen and its metabolites [J].BMC Cancer,2013,13(1):612.
[12]陈 樱,王本忠,郭真理.乳腺癌基因研究的新进展[J].安徽医药,2012,16(9):1217-1220.
Association between CYP2D6*10 genotype and survival of breast cancer patients receiving tamoxifen treatment
WEI Ying,XU Zhe
(Department of Pharmacology,Ma’anshan Municipal Health Hospital For Women and Children,Ma’anshan,Anhui 243011,China)
Objective To explore the association between between CYP2D6*10 genotype and survival of breast cancer patients receiving tamoxifen(TAM)treatment.Methods Basic clinical feature,survival state and blood samples,paraffin sections were collected from 257 breast cancer patients receiving TAM treatment.CYP2D6*10 allele of breast cancer patients were checked by means of Polymerase Chain Reaction(PCR).We observed the association between CYP2D6*10 genotype and survival of breast cancer patients receiving tamoxifen(TAM)treatment.Results Fifteen percent(38/257)of the patients carried the CYP2D6*10/*10 genotype,41% (105/257)the CYP2D6 wild-type(Wt)/*10 genotype and 44% (114/257)the CYP2D6 wt/wt genotype.There were no discernible correlations between clinicopathologic parameters and the CYP2D6*10 genotype.We determined whether there was a correlation between the CYP2D6*10 genotype and survival and found out that the clinical outcome for patients carrying the CYP2D6*10/*10 genotype was similar to those with other genotypes.Conclusions Our results suggest that the CYP2D6*10 genotype is unlikely to have any clinical significance for prognosis of breast cancer patients receiving adjuvant TAM treatment.
CYP2D6;CYP2D6*10;breast cancer;tamoxifen
10.3969/j.issn.1009-6469.2014.05.057
2013-11-15,
2014-01-15)
