茚酮化合物合成方法研究进展
2014-07-05柴凤兰徐海云
柴凤兰,徐海云
(河南化工职业学院,河南 郑州 450042)
茚酮化合物合成方法研究进展
柴凤兰,徐海云
(河南化工职业学院,河南 郑州 450042)
茚酮化合物广泛存在于许多天然产物中,这类化合物具有多种生理活性,是重要的有机合成中间体,广泛应用于医药、农药、染料的合成等。本文重点介绍了环化法合成茚酮化合物,其中分子内傅雷德尔-克瑞福斯(Friedel-Crafts)环化法是茚酮化合物的经典合成法,该法优点是技术成熟,后处理较简单,易于工业化,但该方法产生大量的含铝废液,对环境造成污染。同时,文章对近年来出现的新的茚酮化合物合成方法,如重排法、光化法等进行了对比讨论,新方法与经典合成法相比,具有条件温和、步骤少、产物纯度高等优点,但受到所用原材料等条件的限制,其工业化进程不易实现。通过对近十几年来茚酮化合物合成方法的系统化讨论,指出开发绿色环保、原子经济、易于工业化的新的茚酮化合物合成方法是今后研究的重点。
茚酮;合成;环化法;还原;光化学
茚酮化合物是一类很重要的有机化合物,其基本结构包括1-茚酮、2-茚酮、1,2-茚二酮、1,3-茚二酮和茚三酮,如图1所示。
茚酮化合物广泛存在于医药的活性分子和某些天然产物如海藻中,茚酮特别是取代茚酮类化合物是许多重要药物的合成前体,广泛应用于新药、特效药的研发[1-2],如以5,6-二甲氧基-1-茚酮为原料合成的茚酮类似物donepezil (如图2所示)可以用于治疗老年痴呆症[3],已获FDA批准上市;Leoni等合成的茚酮类似物indanocine (如图3所示),发现该物质具有细胞毒性和细胞生长抑制活性,在对正常的非增殖细胞不产生损害的情况下,能够诱导多药耐药癌变细胞在稳定期发生凋亡,这在肿瘤治疗方面具有很重要应用前景[4]。
2008年,Saxena等[5]合成了一系列的茚酮类似物(如图4所示)。这些化合物都展现了比较好的抗肿瘤活性,特别是化合物2在很高的浓度对人类正常红细胞也没有毒性,因此这些化合物可以作为抗癌先导物。
从植物(如藤春、苔藓、海藻)或微生物(如海绵、链霉菌)等分离得到的天然茚酮类化合物[6-10],能很好地抑制人血管内皮因子生长的生物活性,在调节肿瘤血管生成方面有良好的应用前景[11]。
同时,茚酮类化合物是非常重要的有机合成中间体,其具有很高的经济价值广泛用于精细有机化工生产中,如染料、光致变色、有机发光等材料的制备[12-13]。因此,茚酮类化合物在生物医学及工业上有非常重要的用途。
鉴于茚酮类化合物在药物化学和有机精细化工生产方面的重要应用,探索茚酮类化合物的合成方法研究成为有机化学等学科工作者研究的热门领域之一,受到了广泛的关注。下面就近十几年来关于茚酮类化合物的合成方法研究进行总结对比讨论,以促进茚酮化合物合成研究。
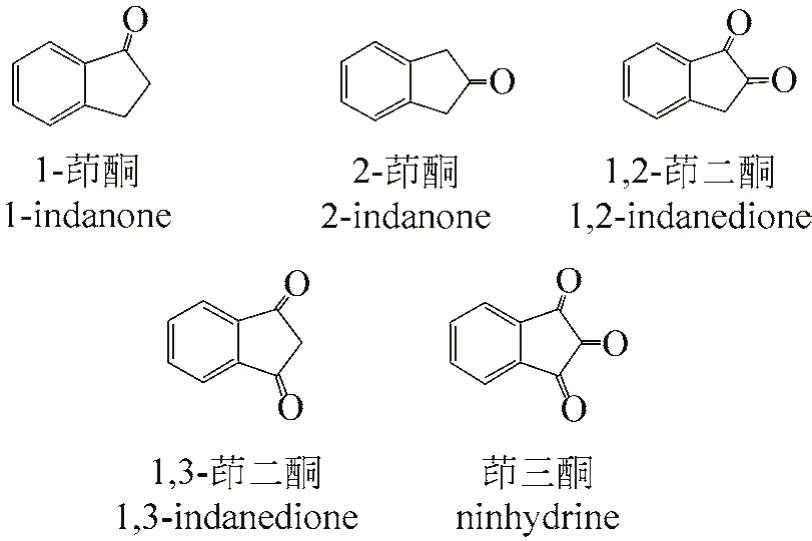
图 1 茚酮化合物的基本结构

图 2 donepezil

图 3 indanocine

图4 一些茚酮衍生物
1 分子内傅雷德尔-克瑞福斯(Friedel-Crafts)环化法
傅雷德尔-克瑞福斯(Friedel-Crafts)酰基化反应(简称傅-克酰化反应)是指芳香烃在无水AlCl3、ZnCl2或FeCl3等路易斯酸催化下,芳环上的氢原子被烷基或酰基所取代的酰化反应,被广泛应用于芳香酮等有机中间体的制备[14-15]。芳环上取代基对傅克酰化反应影响很大,当芳环上有强吸电子基(如—NO2、—SO3H、—COR)时,不发生傅-克酰化反应。
2008年,戴立言等[16]报道了傅-克环化法合成非甾体抗炎药舒林酸的中间体6-氟-2-甲基茚酮。该中间体以对氟氯苄与甲基丙二酸二乙酯为原料,通过缩合,再经碱性水解、脱羧、SOCl2酰氯化,最后进行分子内Friedel-Crafts酰基化反应得到,反应的总收率57.0%。如图5所示。
该方法合成路线简单,原料便宜易得,操作简便,产品纯度较好,收率较高。
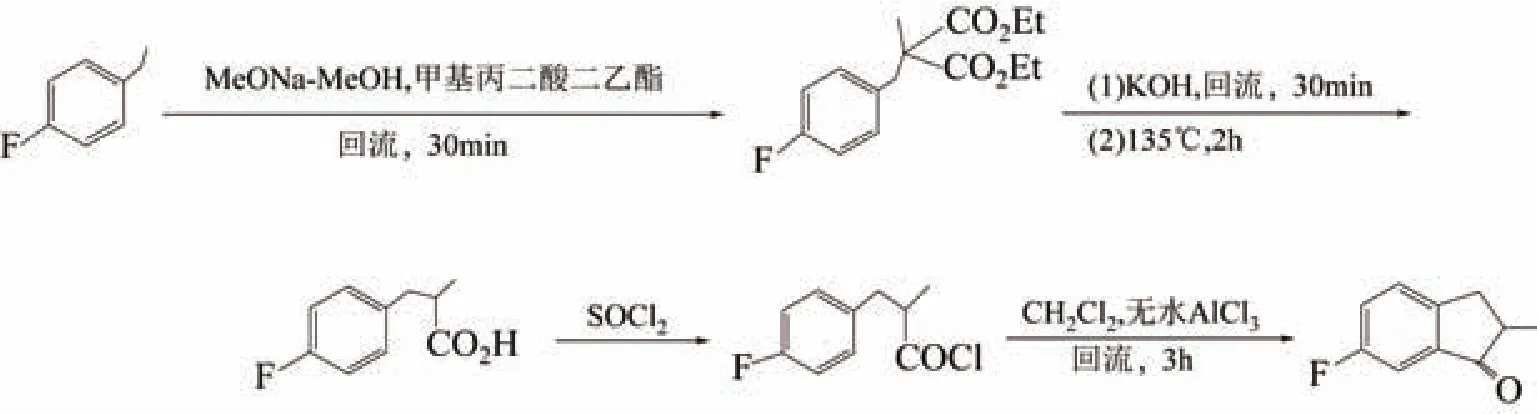
图5 6-氟-2-甲基-1-茚酮合成路线
2010年,张桂玲等[17]报道了6-氯-1-茚酮的合成。该合成方法基本同6-氟-2-甲基茚酮的合成。先由对氯氯苄和丙二酸二乙酯缩合,然后依次进行水解、脱羧,最后通过Friedel-Crafts酰基化反应得到产物6-氯-1-茚酮,纯度99%,总收率62%。如图6所示。
同时,该报道又对合成条件进行了优化。在缩合时,分别对对氯氯苄的滴加速度和混合液的温度进行了优化,实验表明:在充分搅拌条件下,温度为0~5℃,对氯氯苄的滴加速度为1.0mL/min时,收率最高。在进行碱性水解时,温度为50~60℃时反应最好,温度过低,碱性水解不完全;温度过高,水解产物不易纯化。在脱羧反应时,回流加热要比直接加热得到的脱羧产物收率高、纯度高,这是因为通过溶剂回流方法进行加热脱羧,化合物受热均匀,不易损失产品,但这种方式加热时间较长;而采用直接加热化合物脱羧,由于化合物受热不均匀,导致化合物局部过热,易于产生副产物,产物的纯度和收率都会较回流加热有所降低。特别是在最后一步酰基化时,在无水A1C13的催化下要比多聚磷酸(PPA)环化时产生的废液要少得多,大大减少了后处理过程,使酰化反应的收率高达85.2%。
该合成路线原料廉价易得,反应条件简单,后处理方便,纯度高,收率高,可以考虑工业化。
2012年,潘成学等[18]也报道了由傅-克环化法来合成5,6-二取代-1-茚酮酯化合物。该报道从芳基酮出发,首先与丙二酸缩合,再还原得到芳基丙酸,后者与(COCl)2反应制成酰氯后,在无水A1C13的催化下发生Friedel-Crafts酰基化反应得到产物5,6-二取代-1-茚酮酯化合物,如图7所示。
该方法操作简单,后处理比较方便,产率比较高,且可进一步合成多取代茚酮类化合物。

图6 6-氯-1-茚酮合成路线

图 7 5,6-二取代-1-茚酮酯合成路线
2012年,Ki-Jun Hwang等[19]分别以无水AlCl3、ZnCl2和FeCl3为催化剂催化合成5,7-二甲氧基-1-茚酮化合物,如图8所示。实验表明,无水AlCl3的催化效果最好,产率可达95%;ZnCl2次之; FeCl3没有催化效果。
分子内傅雷德尔-克瑞福斯(Friedel-Crafts)环化法是合成茚酮的一个相对成熟的传统的方法,但是该方法由于使用无水氯化铝,在生产过程中会产生大量的废铝盐,适用于小批量的实验室操作,不适合于大规模的工业化生产。
2 Nazarov环化法
Nazarov环化反应,即纳扎罗夫环化反应,是指二乙烯基酮类化合物在质子酸(如磷酸、硫酸)或路易斯酸(如氯化铝)作用下重排为环戊烯酮衍生物的一类有机化学反应。
2003—2004年间,Frontier及其合作者[20-21]利用三氟乙酸铜或铱配合物为催化剂催化的Nazarov环化反应,高产率合成手性茚酮类化合物,如图9所示。
2007年,朱宏伟[22]利用三氟乙酸铜为催化剂催化串联Nazarov环化亲电氟化反应,立体选择性合成含氟的1-茚酮衍生物,并对合成含氟茚酮类衍生物的方法进行了研究,实验发现,催化剂以三氟乙酸铜为最佳,氟化剂以NFSI最好,合成反应如图10所示。
2012年,潘成学等[18]以三氟化硼乙醚为催化剂催化的Nazarov环化法合成多取代茚酮类化合物,突破了传统方法采用的三氯化铝等路易斯酸和甲磺酸、三氟甲磺酸等强质子酸为催化剂的限制,合成方法简单,产率较高,可以达到80%,如图11
所示。
3 多聚磷酸(PPA)环化法

图 8 5,7-二甲氧基-1-茚酮的合成

图 9 手性多取代1-茚酮合成路线
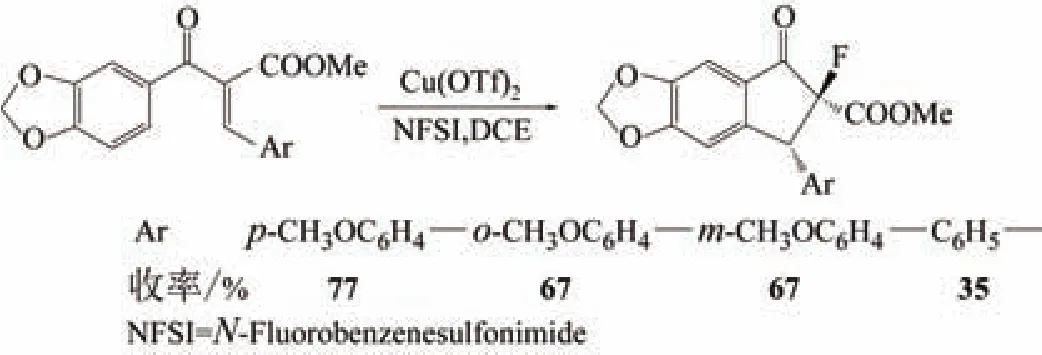
图 10 含氟的1-茚酮衍生物合成路线
2010—2011年,王晓琴、张宜凡等[23-24]以藜芦醛与丙二酸为原料,经Knoevenagel反应、选择性还原,最后通过PPA环化法得到5,6-二甲氧基-1-茚酮,收率达75%左右,反应如图12所示。
2013年周德军等[25]以2-(3,5-二甲氧基苄基)丙二酸二乙酯为原料采用PPA环化法一步合成了5,7-二甲氧基-1-茚酮,产物收率可达85%,该合成方法原料易得,对设备要求不高,后处理相对简单,易于工业化生产;该作者比较了各种酸对反应的催化效果,结果发现,以浓硫酸和浓盐酸为催化剂反应几乎不进行,而以磷酸为催化剂,反应收率仅有65%。该作者同时提出了该反应的机理,如图13所示。
以上两种方法所用原料来源广泛,廉价易得,且反应条件比较温和,避免了高温高压等危险操作,降低了合成的危险性,具备规模化生产的潜力。但这种方法后处理相对较麻烦,产生较多的废酸,对环境影响较大,产率较低,一般在80%以下。

图11 多取代1-茚酮合成路线
4 Pinacol重排法
Pinacol重排是指取代的邻二醇在酸(Lewis酸或稀硫酸等)的催化下发生特殊的分子内部重排,加热失去一分子水,生成醛和酮的反应,羟基位于脂环上的邻二醇化合物重排则生成扩环脂肪酮、螺环酮。取代的邻二醇为片呐醇,重排生成的酮称为片呐酮。
2012年,潘成学等[18]以1-芳基-5,6-二甲氧基茚为原料,先经四氧化锇氧化成邻二醇,再通过Pinacol重排法得到2-茚酮产物,反应如图14所示,其中产物a的产率为70%,产物b的产率高达86%。
该合成方法可以以比较大的投料量投入反应,且具有原料价廉易得、操作简单、反应步骤少、产率高等优点,但是所用的氧化剂四氧化锇对皮肤和呼吸道有强烈的刺激作用。

图13 5,7-二甲氧基-1-茚酮合成机理
5 酯缩合法

图14 取代2-茚酮合成路线
(s)-5-氯-2-甲氧羰基-2-羟基-1-茚酮是合成手性杀虫剂茚虫威的重要中间体。手性杀虫剂茚虫威只有s-异构体时才具有生物活性[26-27]。因而,(s)-5-氯-2-甲氧羰基-2-羟基-1-茚酮的合成则是茚虫威全合成的关键步骤。2001年Annis G D等利用酯缩合反应合成5-氯-2-甲氧羰基-1-茚酮,然后以辛克宁为手性催化剂、叔丁基过氧化氢(TBHP)为氧化剂进行不对称羟基化反应合成了(s)-5-氯-2-甲氧羰基-2-羟基-1-茚酮[28]。合成反应如图15所示。
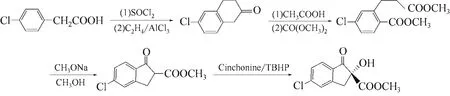
图15 (s)-5-氯-2-甲氧羰基-2-羟基-1-茚酮合成路线
6 光化学方法
利用光化学方法合成茚酮环是最近几年出现的新方法。该方法特点是条件温和、反应快、产率较高。2009—2012年,张俊杰等[29-30]报道了通过一种光化学方法来合成取代茚酮。该合成是通过光诱导,光解产物吸收光子后,形成单线激发态,经过系间串越生成三线态,然后发生分子内1,5-氢转移,进而形成Z/E两种构型的烯醇式激发态,其中E构型的烯醇式经过重排,发生分子内重排反应,得到取代茚酮化合物。该作者根据反应结果对光化学法合成茚酮环的反应机理进行了推测,如图16所示。
2011年,Stacko Peter等[31]利用光化学方法合成了抗恶性细胞增生的药物indanorine,该化合物是 indanocine的类似物,具有很好的临床应用前景。合成路线如图17所示。
光化学方法合成取代茚酮,具有条件温和、方法简单、反应迅速、光反应的产率比较高、产物比较容易分离纯化、绿色环保等优点,避免了传统方法需要高温条件的缺点,克服了烷基的迁移现象。但是,在反应中需要保证单色光源,妨碍了该方法的工业化应用。
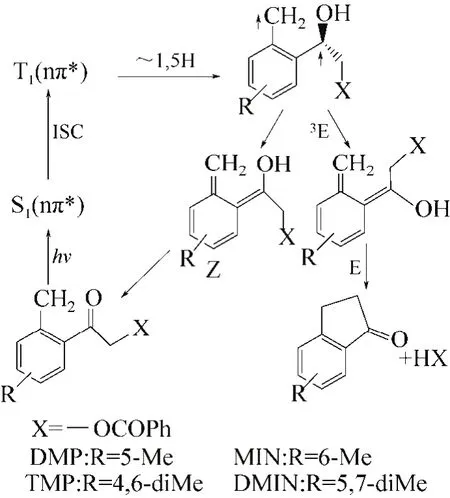
图16 光化学法合成1-茚酮衍生物机理
7 结 语
茚酮类化合物存在于天然产物、农药、医药、染料、氨基显色剂及其他多种精细化学品中间体的分子结构中,特别是近年来,具有抗恶性肿瘤等生理活性的茚酮类化合物的合成研究成为了热点,这更加促进了茚酮类化学的发展。目前,茚酮类化合物的合成方法主要是利用傅-克酰基化反应,该方法工艺成熟,产率较高,但是由于使用无机铝盐作为催化剂,大量生产会带来较大的环境污染,因此,进一步探索高效、无污染的绿色合成方法合成具有生理活性的茚酮类药物分子是茚酮类化合物研究发展的趋势。总之,茚酮类化合物的研究不仅具有学术意义,也具有很高的实用价值。

图17 药物indanorine合成路线
[1] Kundu K,McCullagh J V,Morehead A T. Hydroacylation of 2-vinyl benzaldehyde systems:An efficient method for the synthesis of chiral 3-substituted indanones[J].J. Am. Chem. Soc.,2005,127(46):16042-16043.
[2] Cui D M,Zhang C,Kawamura M,et al. Synthesis of 1-indanones by intramolecular Friedel–Crafts reaction of 3-arylpropionic acids catalyzed by Tb(OTf)3[J].Tetrahedron Lett.,2004,45(8):1741-1745.
[3] Sheng R,Xu Y,Hu C,et al. Design,synthesis and AChE inhibitory activity of indanone and aurone derivatives[J].Eur. J. Med. Chem.,2009,44(1):7-17.
[4] Leoni L M,Hamel E,Genini D,et al. Indanocine,a microtubule-binding indanone and a selective inducer of apoptosis in multidrug-resistant cancer cells[J].J. Natl. Cancer Inst.,2000,92 (3):217-224.
[5] Saxena H O,Faridi U,Srivastava S,et al. Gallic acid-based indanone derivatives as anticancer agents[J].Bioorg. Med. Chem. Lett.,2008,18(14):3914-3918.
[6] 杨念云,谢宁,植飞. 藤春中生物碱的研究[J]. 中国药科大学学报,1999,30(3):171-173.
[7] Ernst-Russell M A,Chai C L L,Wardlaw J H,et al. Euplectin and coneuplectin,new naphthopyrones from the lichen flavoparmelia euplecta[J].J. Nat. Prod.,2000,63(1):129- 131.
[8] Senaiar R S,Teske J A,Young D D,et al. Synthesis of indanonesviasolid-supported[2+2+2] cyclotrimerization[J].J. Org. Chem.,2007,72(20):7801-7804.
[9] Catozzi N,Wasnaire P,Taylor R J K. An efficient 1,2,4-triazine-based route to the louisianin alkaloids[J].Tetrahedron Lett.,2008,49(18):2865-2868.
[10] Beukes D R,Davies-Coleman M T,Kelly-Borges M. et al. Dilemmaones A-C,unusual indole alkaloids from a mixed collection of south african sponges[J].J. Nat. Prod.,1998,61(5):699-701.
[11] Mueller D,Davis R A,Duffy S,et al. Antimalarial activity of azafluorenone alkaloids from the Australian tree mitrephora diversifolia[J].J. Nat. Prod.,2009,72(8):1538-1540.
[12] EI-Azhary A A. A DFT study of the geometries and vibrational spectra of indene and some of its heterocyclic analogues,benzofuran,benzoxazole,bensothiophene,benzothiazole,indole and indazole[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,1999,55(12):2437-2446.
[13] Borin A C,Serrano-Andrés L. An ab initio study of the low-lying 1A′electronic states of indene[J].J. Mol. Struct.:Theochem.,1999,464 (1-3):121-128.
[14] 魏荣卿,汪海萍,沈斌,等. 硝基苯对傅克酰基化反应制备羧基化聚苯乙烯的影响[J]. 化工学报,2005,56(7):1230-1235.
[15] 吴纯鑫,李晚霞,李阳阳,等. 基于F-C反应的天然产物大豆黄素合成工艺[J]. 化工学报,2011,62(5),1377-1381.
[16] 戴立言,贺电,王晓钟,等. 合成6-氟-2-甲基茚酮的新方法[J].合成化学,2008,16(5):614-616.
[17] 张桂玲,罗绪强. 6-氯-1-茚酮的合成[J]. 化学研究,2010,21(3):50-52.
[18] 潘成学,蒋祥柳,张洪彬. 茚酮化合物的合成研究[J]. 广西师范大学学报,2012,30(2):71-77.
[19] Hwang Ki-Jun,Shin Young-Min,Kim Dae-Hyuk,et al. Synthesis ofversatile 1-indanones and their conversion to 1,2-naphthoquinones,key precursors for the construction of perylenequinone core[J].Bull. Korean Chem. Soc.,2012,33(9):3095-3098.
[20] He W,Sun X,Frontier A J. Polarizing the Nazarov cyclization:Efficient catalysis under mild conditions[J].J. Am. Chem. Soc.,2003,125(47):14278-14279.
[21] Janka M,He W,Frontier A J,et al. Efficient catalysis of Nazarov cyclization using a cationic iridium complex possessing adjacent labile coordination sites[J].J. Am. Chem. Soc.,2004,126(22):6864-6865.
[22] 朱宏伟. 催化串联Nazarov环化/亲电氟化反应-立体选择性合成含氟1-茚酮衍生物[D]. 天津:天津大学,2007.
[23] 王晓琴,彭新生,何明华. 5,6-二甲氧基-1-茚酮的合成研究[J]. 广州化工,2010,38(4):79-81.
[24] 张宜凡,周淑琴,熊叶娟,等. 5,6-二甲氧基-1-茚酮与1-苄基-4-氯甲基哌啶的合成[J]. 应用化工,2011,40 (2):274-277.
[25] 周德军,松谷裕二. 一种有效合成5,7-二甲氧基-1-茚酮的方法[J].化学通报,2013,76(3):286-288 .
[26] Lahm G P,McCann S F,Harrison C R,et al. Evolution of the sodium channel blocking insecticides:The discovery of indoxacarb[M]. Washington D C:American Chemical Society Press,2000:20-34.
[27] Sekhon B S. Chiral pesticides bhupinder singh sekhon[J].J. Pest. Sci.,2009,34(1):1-12.
[28] Annis G D,McCann S F,Shapiro R. Preparation of arthropodicidal oxadiazines:US,6232489B1[P]. 2001-02-05
[29] 张俊杰,刘桂芳,李红霞. 一种光化学合成取代茚酮的有效方法[J].化学通报,2009(4):377-380.
[30] 王帅,董伟兵,孟繁博,等. 6-甲基-1-茚酮的光敏化合成与纯化[J].河北联合大学学报:自然科学版,2012,34(1):36-39.
[31] Štacko P,Šolomek T,Klán P. Electronic-state switching strategy in the photochemical synthesis of indanones fromo-methyl phenacyl epoxides[J].Org. Lett.,2011,13(24):6556-6559.
Progress of synthesis of indanones
CHAI Fenglan,XU Haiyun
(Henan Vocational College of Chemical Technology,Zhengzhou 450042,Henan,China)
:Indanones are found in a large number of natural products. Indanones possess a variety of physiological activity and are utilized as important intermediates in organic synthesis of medicines,pesticides and dyes. The cyclization method for the synthesis of indanone is discussed,and intramolecular Friedel-Crafts cyclization is the classical process of indanone synthesis. The advantages of this method are mature technology,simple post-processing and easy industrialization; its disadvantages are a large number of scrap liquid including aluminium,which pollute the environment. Meanwhile,the recent methods (e.g. rearrangement and photochemical method) for the synthesis of indanones are reviewed. Compared with the classical synthesis methods,the recent methods have advantages of mild conditions,fewer steps,and high purity of indanones. But the new methods are not easy to achieve industrialization due to limitation of raw materials and other conditions. The focus of indanone synthesis in the future is to develop green processes of atom economy and easy industrialization.
indanone;synthesis;cyclization method;reduction;photochemistry
O 625.42
A
1000-6613(2014)11-3045-08
10.3969/j.issn.1000-6613.2014.11.035
2014-02-25;修改稿日期:2014-04-09。
河南省高等院校自然科学研究计划项目(2011A150009)。
及联系人:柴凤兰(1968—),女,博士,教授,主要从事有机合成和有机催化研究。E-mail flc0603@sohu.com。
