新型丝素蛋白支架复合兔髓核细胞体内初步构建组织工程髓核的研究
2014-07-05赵家宁徐宝山超杨强马信龙张春秋李秀兰张
赵家宁徐宝山 曾 超杨 强马信龙张春秋李秀兰张 扬
新型丝素蛋白支架复合兔髓核细胞体内初步构建组织工程髓核的研究
赵家宁1徐宝山2△曾 超1杨 强2马信龙2张春秋3李秀兰2张 扬2
目的 探讨新型丝素蛋白多孔支架复合经PKH26标记的兔髓核细胞初步构建组织工程髓核的可行性。方法消化分离兔髓核细胞,培养获取P1代细胞,对P1代髓核细胞行番红O以及Ⅱ型胶原免疫组织化学染色;PKH26标记兔髓核细胞,MTT法检测标记前后髓核细胞增殖情况,将标记后的细胞接种支架,体外培养4 d后,将细胞-支架复合物植入裸鼠皮下,体内培养12周后,进行活体荧光成像技术检测、HE染色、甲苯胺蓝染色、番红O染色和Ⅱ型胶原免疫组化染色。结果P1代髓核细胞番红O染色阳性,Ⅱ型胶原免疫组织化学染色阳性;标记后细胞荧光强度分布均匀,标记前后髓核细胞光密度(OD)值比较差异无统计学意义(P>0.05);活体成像技术显示裸鼠皮下植入的细胞-支架复合体呈现强烈荧光;HE染色见多孔支架内壁有大量髓核细胞填满并分泌大量细胞外基质;甲苯胺蓝染色、番红O染色及Ⅱ型胶原免疫组化染色均呈阳性,细胞周围大量细胞外基质分泌。结论以新型丝素蛋白多孔支架复合兔髓核细胞经体内培养形成的类髓核样组织,可用于组织工程化髓核的构建。
丝素蛋白;组织工程;免疫组织化学;髓核;PKH26
椎间盘退变性疾病是骨科常见病,其大多起源于髓核组织的退变。髓核组织一旦出现退变,便难以逆转。目前治疗方法一般采取脊柱融合、全间盘置换或髓核置换手术等,但这些方法仅能在一定程度上缓解症状,并不能完全恢复椎间盘的功能[1-2]。近年来,组织工程技术成为一种修复退变椎间盘的新方法[3]。髓核组织工程的目标是重建包括材料及细胞的复杂结构并用以替代退变的髓核,其中支架材料的选择是组织工程研究的关键[4]。丝素作为一种天然蛋白质,具有无抗原性、化学性能稳定及生物学相容性良好等优点而被广泛应用[5]。本实验以丝素蛋白为材料制备多孔支架,并复合PKH26标记的兔髓核细胞体内构建组织工程髓核,探讨丝素蛋白多孔支架复合兔髓核细胞体内长期培养构建组织工程髓核的可行性。
1 材料与方法
1.1 实验对象 新西兰大白兔5只,雄性,3~4周龄(280~300 g),由天津市天津医院动物房提供;裸鼠4只,雄性,6周龄,由天津市血液病研究所动物实验室提供。
1.2 试剂和仪器 FD-1冷冻干燥机(北京博医康技术公司),速眠新注射液、戊巴比妥钠(军事医学科学院),DMEM培养基、胎牛血清(GIBCO公司,美国),EDTA、胰蛋白酶、二甲基亚砜(DMSO)、甲苯胺蓝染液、番红花O染液、Ⅱ型胶原酶(Sigma公司,美国),鼠抗人Ⅱ型胶原抗体(博士德,武汉),CO2培养箱(Hera-cell公司,德国),恒温摇床(Heidolph公司,德国),IX53倒置显微镜、荧光显微镜(OLYMPUS公司,日本),MRX-HD全自动酶标分析仪(Biotek公司,美国),细胞培养瓶(Corning公司,美国)。
1.3 兔髓核原代细胞分离和培养 将新西兰白兔处死后,取其T5~L5间脊柱,切除周围组织,尖刀切开纤维环前侧,用无菌小刮匙将髓核刮出,随即放入含有10万U/L青霉素的Hank’s液漂洗2遍,将其剪碎成约1 mm3的碎块,加入浓度为0.2%的Ⅱ型胶原酶,与髓核组织以3∶1体积充分混合,37℃消化5 h,至髓核组织基本消化完全,用200目滤网过滤,收集细胞悬液,1 000 r/min离心7 min,弃上清,用含10%胎牛血清(FBS)的高糖DMEM重悬细胞沉淀,调整细胞密度为1×105/mL,接种至细胞培养瓶,在37℃、5%CO2的培养箱中培养,每3 d换1次10%FBS高糖DMEM。
1.4 细胞学及免疫组织化学染色 待兔髓核原代细胞长满瓶底80%后,消化传代,得到P1代细胞悬液,将细胞浓度调整为1×104/mL,用吸管将细胞悬液滴加在预先放置于24孔板底的玻片上,置于37℃、5%CO2培养箱中培养,每隔1日滴加完全培养液1.5 mL。镜下观察,至细胞长满玻片30%左右,弃培养液,用Hank’s冲洗2遍,滴加4%多聚甲醛固定20 min,PBS缓冲液再冲洗3遍,晾干,进行番红O及Ⅱ型胶原免疫组织化学染色。
1.5 髓核细胞的PKH26标记 取P1代髓核细胞约2×107个,1 000 r/min离心7 min,用不含胎牛血清的高糖DMEM洗涤,1 000 r/min再次离心7 min,除去上清,重复3次,用1 mL Diluent C溶液将细胞沉淀重悬并与1 mL浓度为6×10-6mol/L的PKH26染料混匀,室温孵育5 min后加入2 mL山羊血清终止反应,然后加入4 mL 10%FBS高糖DMEM,1 000 r/ min离心7 min,去上清,反复洗涤2次,标记后的细胞作爬片,剩余接种支架。
1.6 标记前后髓核细胞MTT检测 取标记后的髓核细胞悬液,调至密度2×104个/mL,接种至96孔培养板,分别培养1、3、5、7 d。每组取4孔,每孔加入25 μL MTT溶液,置37℃、5%CO2培养箱培养4 h后弃,每孔加入100 μL DMSO,待蓝紫色结晶物溶出后,于酶联免疫检测仪测定在570 nm波长处的光密度(OD)值,同法以标记前髓核细胞作为对照组。
1.7 细胞支架复合体的制备 在之前的研究中,本课题组已成功制备出直径5 mm,高3 mm的新型丝素蛋白多孔支架[6]。将灭菌消毒后的丝素蛋白多孔支架置于48孔板中,用高糖DMEM在37℃、5%CO2培养箱中浸泡24 h。接种时,用滤纸吸除支架水分。P1代髓核细胞悬液调以1×107/mL浓度注射入支架中央部,然后将细胞-支架复合体置入37℃、5% CO2培养箱中孵育4 h,沿壁加入2 mL 10%FBS高糖DMEM,置于培养箱中培养4 d。
1.8 细胞-支架复合体裸鼠皮下植入实验及评估
1.8.1 皮下植入实验 选用10%水合氯醛以0.3 mg/g剂量麻醉,裸鼠背部常规碘伏消毒,脊柱两侧上下各切开大小约为8 mm的切口,共4个,分离裸鼠皮下组织并将2个细胞-支架复合体植入下方切口皮下。同时在上方切口皮下植入2个不含标记细胞的空白支架,作为对照组,见图1。
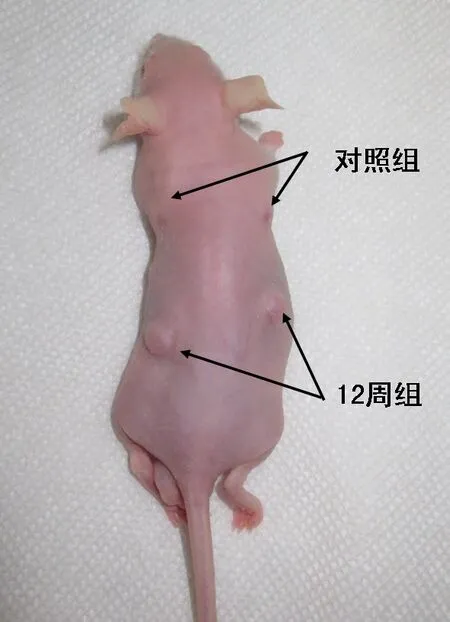
Fig.1 Subcutaneous implantation in nude mice图1 裸鼠皮下植入
1.8.2 活体荧光成像系统分析评估 细胞-支架复合体裸鼠皮下植入12周后,经乙醚麻醉,置于Xenogen IVIS 200活体成像系统内观察。裸鼠侧卧位于成像系统内,系统自动分析成像结果。
1.8.3 组织学及免疫组织化学 样本经10%中性福尔马林溶液固定12 h,乙醇梯度脱水,二甲苯透明,石蜡包埋,5 μm切片,再经脱蜡、乙醇水化等处理后,进行HE、番红O、甲苯胺蓝染色及Ⅱ型胶原免疫组化染色,封片后于光镜下观察。
1.9 统计学方法 采用SPSS 13.0软件包进行统计学处理。实验数据以均数±标准差(±s)表示,采用两独立样本资料t检验,P<0.05为差异有统计学意义。
2 结果
2.1 细胞学及免疫组织化学染色 P1代髓核细胞番红O染色为阳性,见图2A。Ⅱ型胶原免疫细胞化学染色呈阳性,见图2B。
2.2 髓核细胞的PKH26标记 PKH26标记后的P1代兔髓核细胞在荧光显微镜下呈现红色荧光且分布均匀,见图3。
2.3 标记前后髓核细胞MTT检测 兔髓核细胞PKH26标记前后,第1、3、5、7天OD值比较差异均无统计学意义(t分别为0.056、1.479、1.608、2.002,P>0.05,n=5),表明标记前后髓核细胞增殖无明显差异,见图4。

Fig.4 Nucleus pulposus cells before and after labeling detected by MTT assay图4 标记前后髓核细胞MTT检测
2.4 活体荧光成像分析 裸鼠皮下植入12周后,活体荧光成像可见实验组中髓核支架部位强烈荧光,且荧光强度由内向外逐步减弱,而对照组支架部位未见荧光,见图5A。裸鼠体内取出细胞-支架复合体可见支架完整,表面光滑富有色泽,见图5B。

Fig.5 Nude mice in vivo fluorescence imaging and cell-scaffold complexes图5 裸鼠活体荧光成像及细胞-支架复合物大体观
2.5 组织学及免疫组织化学 HE染色见多孔支架内壁有大量髓核细胞填满并分泌细胞外基质,见图6A;番红花O染色、甲苯胺蓝染色及Ⅱ型胶原免疫组化染色均为阳性,见图6B、C、D。
3 讨论
3.1 丝素蛋白在组织工程中的应用 组织工程主要包括生物支架材料、种子细胞和生物活化因子3个重要部分,其中支架材料为种子细胞提供一种良好的微环境供其黏附、生长以及增殖,同时支架自身逐渐降解吸收,最后被新生的组织替代[7]。丝素蛋白作为一种良好的细胞生长介质,以其良好的生物相容性及可降解性,利于细胞的黏附及生长繁殖,在组织工程中广泛应用[8]。Wang等[9]研究发现间充质干细胞在丝素支架上具有成软骨特性并且能在支架上黏附、增殖、分泌蛋白多糖及Ⅱ型胶原。Feng等[10]运用一种新型纳米纤维支架在体外和大鼠体内原位移植中再生了髓核样组织。Chang等[11]将牛的纤维环细胞接种在丝素蛋白多孔支架上,经过体外8周培养后发现纤维环细胞可在丝素蛋白多孔支架上黏附、增殖并分泌大量细胞外基质。苗宗宁等[12]将成软骨方向诱导后兔骨髓间充质干细胞与丝素蛋白材料复合培养,植入兔股骨髁间软骨缺损处,12周后发现丝素蛋白支架材料已逐步被吸收,复合体与周围软骨组织色泽相近。本实验以丝素蛋白结合石蜡致孔等技术制备三维多孔支架。HE染色观察支架多孔结构明显,扫描电镜观察支架呈多孔结构,且大孔之间贯通性良好,利于髓核细胞迁入多孔支架内,同时也能实现营养成分与新陈代谢产物之间的转运。
3.2 PKH26标记兔髓核细胞 PKH26荧光标记是组织工程中常用的一种细胞标记技术,在构建组织工程软骨[13]和神经[14]等方面应用广泛。它以其操作简便、标记迅速以及不影响细胞生物学功能等优点广泛运用于体内示踪。同时,其作为一种亲脂性染料,能够不可逆地结合细胞膜,并在荧光显微镜下呈现红色荧光。丁晓明等[15]用PKH26标记牛尾椎间盘髓核细胞,分别培养1、7、14、28 d,经MTT、PCR检测等证实经PKH26标记后,牛尾髓核细胞形态、表型、增殖及蛋白表达无影响。
实验中笔者以适当的标记浓度对兔髓核细胞进行了荧光标记,标记后的细胞在镜下显示荧光强烈并且均匀,MTT检测显示了细胞标记前后生长曲线无明显差异,表明PKH26对兔髓核细胞的活性和增殖无影响。裸鼠体内植入12周后,将其进行活体荧光成像检测,发现对照组未显现荧光,而实验组显示支架部分有明显荧光,表明接种的髓核细胞在裸鼠体内大量存活。采用空白支架作为对照,排除了实验中支架非特异性荧光显色的可能。
3.3 细胞-支架复合物的体内培养 髓核组织呈胶状,具有高度黏弹性[16]。其含水丰富,主要包含髓核细胞、蛋白聚糖以及胶原3种成分[17]。髓核细胞能够维持髓核组织功能及结构的稳定,同时能够分泌大量的细胞外基质,如蛋白多糖、胶原等。裸鼠皮下植入12周后,细胞-支架复合物HE染色示支架内部大量髓核细胞填充,并分泌大量细胞外基质,说明细胞与支架生物相容性良好,并能在体内生长增殖。番红花O染色及甲苯胺蓝染色呈阳性,说明细胞-支架复合物体内培养12周后,仍能大量分泌蛋白多糖。Ⅱ型胶原免疫组化染色阳性表明髓核细胞在支架上分泌Ⅱ型胶原。髓核细胞所分泌的基质与正常髓核组织的细胞外基质成分相同。
综上所述,三维丝素蛋白多孔支架以其高孔隙率及良好的孔间贯通性为细胞提供了一个合适生长环境,且对髓核细胞增殖无影响。丝素蛋白多孔材料复合兔髓核细胞体内培养形成的类似髓核的组织,可用于组织工程化髓核的构建。

Fig.2 The staining for the P1 generation nucleus pulposus cells(inverted phase contrast microscope×100)图2 P1代髓核细胞染色(倒置相差显微镜×100)

Fig.3 The P1 generation of PKH26 labeled nucleus pulposus cells(fluorescence microscope×100)图3 PKH26标记的P1髓核细胞(荧光显微镜×100)
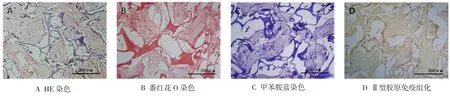
Fig.6 The histology and immunohistochemistry detection of cell-scaffold complexes(inverted phase contrast microscope×100)图6 细胞-支架复合体的组织学及免疫组织化学检测(倒置相差显微镜×100)
[1]Xu BH,Ma XL,Xia Q,et al.Percutaneous transforaminal endoscopic spine system in lumbar discectomy for disc herniation[J].Tianjin Med J,2014,42(5):470-472.[徐宝山,马信龙,夏群,等.椎间孔镜TESSYS技术治疗腰椎间盘突出症效果分析[J].天津医药, 2014,42(5):470-472.]doi:10.3969/j.issn.0253-9896.2014.05.019.
[2]Iatridis JC,Nicoll SB,Michalek AJ,et al.Role of biomechanics in intervertebral disc degeneration and regenerative therapies:what needs repairing in the disc and what are promising biomaterials for its repair[J].Spine J,2013,13(3):243-262.doi:10.1016/j. spinee.2012.12.002.
[3]Yang X,Li X.Nucleus pulposus tissue engineering:a brief review [J].Eur Spine J,2009,18(11):1564-1572.doi:10.1007/s00586-009-1092-8.
[4]Xu HW,Xu BS,Yang Q,et al.Fabrication and analysis of a novel tissue engineered composite biphasic scaffold for annulus fibrosus and nucleus pulposus[J].Chinese Journal of Reparative and Reconstructive Surgery,2013,27(4):475-480.[许海委,徐宝山,杨强,等.新型一体化纤维环-髓核双相支架的制备与评估[J].中国修复重建外科,2013,27(4):475-480.]doi:10.7507/1002-1892. 20130108.
[5]Kasoju N,Bora U.Silk fibroin in tissue engineering[J].Adv Healthc Mater,2012,1(4):393-412.doi:10.1002/adhm.201200097.
[6]Zeng C,Zhu MF,Xu BS,et al.Evaluation of the compatibility of silk fibroin porous scaffolds with rabbit nucleus pulposus cells[J]. Orthopedic Journal of China,2013,21(23):2402-2407.[曾超,朱美峰,徐宝山,等.丝素蛋白多孔支架与兔髓核细胞生物相容性的研究[J].中国矫形外科,2013,23(21):2402-2407.]doi:10.3977/j. issn.1005-8478.2013.23.15.
[7]Baillargeon AL,Mequanint K.Biodegradable polyphosphazene biomaterials for tissue engineering and delivery of therapeutics[J]. Biomed Res Int,2014,2014:761373.doi:10.1155/2014/761373.
[8]Wang Y,Rudym DD,Walsh A,et al.In vivo degradation of threedimensional silk fibroin scaffolds[J].Biomaterials,2008,29(24-25): 3415-3428.doi:10.1016/j.biomaterials.2008.05.002.
[9]Wang Y,Kim UJ,Blasioli DJ,et al.In vitro cartilage tissue engineering with 3D porous aqueous-derived silk scaffolds and mesenchymal stem cells[J].Biomaterials,2005,26:7082-7094.doi: 10.1016/j.biomaterials.2005.05.022.
[10]Feng G,Zhang Z,Jin X,et al.Regenerating nucleus pulposus of the intervertebral disc using biodegradable nanofibrous polymer scaffolds[J].Tissue Eng Part A,2012,18(21-22):2231-2238.doi: 10.1089/ten.TEA.2011.0747.
[11]Chang G,Kim HJ,Kaplan D,et al.Porous silk scaffolds can be used for tissue engineering annulus fibrosus[J].EurSpine J,2007, 16(11):1848-1857.doi:10.1007/s00586-007-0364-4.
[12]Miao ZN,Pan YH,Zhu JZ,et al.Constructing tissue engineered cartilage with silk fibroin compound bone marrow mesenchymal stem cells[J].Journal of Clinical Rehabilitative Tissue Engineering Research,2008,12(27):5243-5247.[苗宗宁,潘宇红,祝建中,等.丝素蛋白支架材料复合骨髓间充质干细胞构建组织工程化软骨[J].中国组织工程研究与临床康复,2008,12(27):5243-5247.] doi:10.3321/j.issn:1673-8225.2008.27.008.
[13]Ude CC,Sulaiman SB,Min-Hwei N,et al.Cartilage regeneration by chondrogenic induced adult stem cells in osteoarthritic sheep model[J].PLoS One,2014,9(6):e98770.doi:10.1371/journal. pone.0098770.
[14]Zhao B,Sun X,Li X,et al.Improved preparation of acellular nerve scaffold and application of PKH26 fluorescent labeling combined with in vivo fluorescent imaging system in nerve tissue engineering [J].NeurosciLett,2013,556:52- 57.doi:10.1016/j.neulet.2013.10.021.
[15]Ding XM,Xu BS,Wu YH,et al.An experimental study on bovine nucleus pulposus cells labelled with PKH26 in vitro[J].Tianjin Med J,2014,42(9):849-852.[丁晓明,徐宝山,伍耀宏,等.PKH26荧光标记牛尾髓核细胞的实验研究[J].天津医药,2014,42(9):849-852.]doi:10.3969/j.issn.0253-9896.2014.09.001.
[16]Chan WC,Au TY,Tam V,et al.Coming together is a beginning: the making of an intervertebral disc[J].Birth Defects Res C Embryo Today,2014,102(1):83-100.doi:10.1002/bdrc.21061.
[17]Roughley PJ.Biology of intervertebral disc aging and degeneration: involvement of the extracellular matrix[J].Spine,2004,29:2691-2699.doi:10.1097/01.brs.0000146101.53784.b1.
(2014-07-11收稿 2014-07-31修回)
(本文编辑 李鹏)
Preliminary Construction of Tissue Engineering Nucleus Pulposus Combining Silk Fibroin Porous Scaffold with Rabbit Nucleus Pulposus Cells
ZHAO Jianing1,XU Baoshan2△,ZENG Chao1,YANG Qiang2,MA Xinlong2,ZHANG Chunqiu3,LI Xiulan2,ZHANG Yang21 Tianjin Medical University,Tianjin 300070,China;2 Tianjin Hospital;3 Tianjin University of Technology
△
E-mail:xubaoshan99@126.com
ObjectiveTo investigate the feasibility of construction of tissue engineering nucleus pulposus by combining the novel silk fibroin porous scaffold with PKH26 labeled rabbit nucleus pulposus cells.MethodsRabbit nucleus pulposus cells were isolated and cultured,then the passage 1 nucleus pulposus cells were stained with safranin O and typeⅡcollagen immunohistochemical staining.The isolated rabbit nucleus pulposus cells were labeled with PKH26.MTT assay was used for examining the proliferation of the nucleus pulposus cells before and after labeling.Labeled cells were inoculated in the scaffold,cultured for 4 days and then the cell-scaffold complexes were implanted subcutaneously into nude mice. After 12 weeks of in vivo culture,the cell-scaffold complexes were detected by in vivo imaging technology,H&E staining, toluidine blue staining,safranin O staining and collagen typeⅡimmunohistochemical staining.ResultsSafranin O staining and typeⅡcollagen immunohistochemical staining of the passage 1 nucleus pulposus cells were positive.The fluorescence intensity of labeled cell was distributed,and the difference of OD value of nucleus pulposus cells was not statistically significant before and after labeling(P>0.05).The in vivo imaging technique showed a strong fluorescencea in porous scaffold.H&E staining of cell-scaffold complexes showed that the scaffolds were filled with a large number of nucleus pulposus cells and large amount of extracellular matrix.Toluidine blue staining,safranin O staining and typeⅡcollagen immunohistochemical staining were positive,and large amount of extracellular matrix was secreted around the cells.ConclusionThe new silk fibroin porous scaffold with rabbit nucleus pulposus cells in vivo culture formed nucleus pulposus like tissue,which can be used for construction of tissue engineering nucleus.
silk fibroins;tissue engineering;immunohistochemistry;nucleus pulposus;PKH26
R329-33,R349.89
A
10.3969/j.issn.0253-9896.2014.11.006
国家自然科学基金资助项目(81272046,31300798,31000432);中国博士后科学基金项目(2011M500530,2012T50221);天津市卫生局科技基金(2013KR16)
1天津医科大学研究生院(邮编300070);2天津市天津医院;3天津理工大学
△通讯作者 E-mail:xubaoshan99@126.com
