无羁萜-3β-醇抑制自身免疫性脑脊髓炎的作用研究
2014-07-05郭喜霞杨静黄宁万仁玲李昭辉许高威尹雅玲
郭喜霞杨 静黄 宁万仁玲李昭辉许高威尹雅玲△ 李 鹏
无羁萜-3β-醇抑制自身免疫性脑脊髓炎的作用研究
郭喜霞1杨 静2黄 宁1万仁玲1李昭辉1许高威1尹雅玲1△李 鹏1
目的 研究无羁萜-3β-醇对实验诱导的豚鼠自身免疫性脑脊髓炎(AE)的抑制作用。方法用25、50 和100 mg∕kg剂量的无羁萜-3β-醇对实验诱导的AE豚鼠进行灌胃8周。分别检测血浆CD4+∕CD8+,白细胞介素(IL)-1、2、6、10,血浆神经肽Y(NPY)、β-内啡肽(β-EP),脑组织转化生长因子(TGF)-β、基质金属蛋白酶(MMP)-2、一氧化氮合酶(NOS)及白细胞分化抗原CD3的含量。光镜观察豚鼠大脑神经元形态学变化,电镜观察神经元超微结构变化,免疫荧光观察NOS在神经元的表达。结果无羁萜-3β-醇抑制实验诱导的AE豚鼠CD4+∕CD8+的升高,抑制血浆IL-1、2、6、10的含量升高,抑制血浆NPY升高及β-EP降低,抑制大脑TGF-β降低和MMP-2、CD3升高以及NOS在神经元胞质内的表达,并维持神经元的正常形态。结论无羁萜-3β-醇具有抑制AE的作用。
脑脊髓炎,自身免疫性,实验性;白细胞介素类;受体,细胞因子;神经肽Y;转化生长因子β;基质金属蛋白酶2;一氧化氮合酶;抗原,CD;神经元;无羁萜-3β-醇
自身免疫性脑脊髓炎(autoimmune encephalomyelitis,AE)是由CD4+T淋巴细胞介导的慢性变态反应性疾病,临床上常出现神经功能进行性障碍、肌肉无力、肢体瘫痪等症状[1]。目前,AE在临床上尚无特殊药物治疗方法,常用肾上腺皮质激素抗免疫治疗,同时联合使用ATP、辅酶A、腺苷、胞二磷胆碱等药物,以促进神经功能的恢复。有学者报道,无羁萜-3β-醇具有抗氧化[2]、抗炎、抗免疫作用[3],可能在治疗免疫系统疾病方面发挥一定的作用[4]。本研究在实验诱导的AE豚鼠模型基础上,观察无羁萜-3β-醇对AE的作用。
1 材料与方法
1.1 材料
1.1.1 实验动物 清洁级雄性英国种短毛豚鼠,5周龄,体质量 220~250 g,购自河南省实验动物中心,许可证号为SYXK-豫-005-0012。动物房温度18~20℃,环境洁净度5 000~8 000级,相对湿度40%~50%,换气次数20次∕h,气流速度0.15~0.2 m∕s,多级定向控制空气压差10%~15%,自动定时器控制7:00—19:00为光照期、19:00—07:00为黑暗期,常规豚鼠饲料及二次净化水饲养。
1.1.2 药品试剂 无羁萜-3β-醇(长沙丽欣生物制剂有限公司);醋酸泼尼松(武汉述元科技发展有限公司);脑组织转化生长因子(TGF)-β、基质金属蛋白酶(MMP)-2、白细胞分化抗原CD3一抗及辣根过氧化酶标记二抗(碧云天生物技术研究所);一氧化氮合酶(NOS)一抗及荧光标记二抗(Sigma公司);白细胞介素(IL)-1、2、6、10 ELISA试剂盒(南京建成生物工程研究所);血浆神经肽Y(NPY)、β-内啡肽(β-EP)放射免疫试剂盒(武汉博士德生物工程有限公司)。
1.1.3 主要仪器 FACScan型流式细胞仪、γ计数仪(美国Becton-Dickinson公司);Synergy H4全功能酶标仪(美国伯腾仪器有限公司);尼康90I荧光显微镜(日本尼康公司)。
1.2 方法
1.2.1 AE豚鼠模型制备 (1)豚鼠全脊髓匀浆制备:豚鼠腹腔注射5 mL∕kg氯胺酮麻醉,在无菌操作下,清理皮毛,依次打开腹腔、胸腔,剪断两侧肋骨,用钝头针从左心室进针穿至主动脉。先用生理盐水灌注600 mL,再用4%多聚甲醛灌注固定。组织剪经头部沿枕骨大孔处剪断,剥取脑和脊髓并去掉脊膜与马尾后称质量,按照1∶3质量比加入生理盐水并制备成25%的豚鼠全脊髓匀浆。完全弗氏佐剂和豚鼠全脊髓匀浆以1∶2充分乳化制备成稳定的豚鼠全脊髓匀浆抗原乳剂待用。(2)AE模型制备:豚鼠腹腔注射5 mL∕kg氯胺酮麻醉,将豚鼠全脊髓匀浆抗原乳按照1 mL∕kg的剂量皮下注入豚鼠两个后足垫皮内,同时左后肢足背皮下注射2 mL∕kg百日咳原浆液,诱导AE模型。免疫后每笼6只常规饲养。
1.2.2 实验设计与分组 30只实验豚鼠按照随机数字表分5组,每组6只,实验中AE模型全部成功。(1)正常对照组:后足垫皮内注射等量生理盐水(1 mL∕kg)。(2)AE模型组:按照本实验操作规定,后足垫皮内注射豚鼠全脊髓匀浆抗原乳剂(1 mL∕kg)。(3)醋酸泼尼松组:在AE模型组基础上,当日灌胃醋酸泼尼松2 mg∕(kg·d),灌胃持续8周。(4)无羁萜-3β-醇低、中、高浓度组:在AE模型组基础上,当日分别灌胃无羁萜-3β-醇25、50、100 mg∕(kg·d),灌胃持续8周。第8周后,5 mL∕kg乙醚麻醉豚鼠,内眦采血,加肝素抗凝,取组织,甲醛或戊二醛固定,或液氮冻存以待指标检测。
1.2.3 血浆CD4+、CD8+含量及CD4+∕CD8+检测 取100 μL抗凝血加入20 μL抗豚鼠CD4+及CD8+抗体均匀混合,室温避光20 min后加入溶血素2 mL,继续避光20 min;3 000 r∕min离心5 min后弃去上清液,用流式细胞仪检测CD4+、CD8+含量及CD4+∕CD8+值。
1.2.4 血浆IL-1、2、6、10含量检测 按照ELISA试剂盒操作说明要求操作。酶标仪450 nm单波长下读取标准管及测试管光密度(OD)值,采用SPSS14.0拟合直线并读取相应数值,求出血浆IL-1、2、6、10含量。
1.2.5 血浆NPY、β-EP含量检测 按照放射免疫试剂盒说明书要求操作。测试样本在4℃冰箱过夜24 h,加入分离剂并充分混匀。室温放置20 min后4℃恒温3 000 r∕min离心20 min,弃去上清液。在γ计数仪上检测血浆NPY、β-EP的含量。
1.2.6 脑组织TGF-β、MMP-2、NOS、CD3检测 按照免疫组化试剂盒说明书要求操作。组织抗原和一抗、二抗结合后显色,通过计算机辅助显微计数,在200倍光镜下,每张切片随机读取5~10个视野,每个视野计数50个胞浆呈棕黄色的阳性细胞,对TGF-β、MMP-2、NOS、CD3进行半定量检测。
1.2.7 神经元形态观察 取甲醛固定组织块,石蜡包埋,制作3~4 μm厚切片,经HE染色后在光学显微镜下观察。取液氮冻存组织块,戊二醛固定,制作0.5 mm3电镜切片,经透射电镜下观察。
1.2.8 NOS在神经元胞质内的表达 取液氮冻存组织块,制作冰冻切片。分别用1∶800的NOS一抗以及荧光标记的二抗孵育,荧光显微镜下观察。
1.3 统计学方法 采用SPSS 14.0统计软件分析数据,计量资料以均数±标准差(±s)表示。组间比较用单因素方差分析,多重比较采用SNK-q法;P<0.05为差异有统计学意义。
2 结果
2.1 血浆CD4+、CD8+含量及CD4+∕CD8+值检测 与正常对照组比较,AE模型组CD4+细胞数明显升高,CD8+细胞数明显降低,CD4+∕CD8+比值升高;醋酸泼尼松与无羁萜-3β-醇明显抑制AE豚鼠CD4+升高、CD8+降低、CD4+∕CD8+升高,见表1。
Tab.1 Comparison of the plasma CD4+,CD8+cell count and the CD4+/CD8+value among five groups表1 各组血浆CD4+、CD8+细胞数以及CD4+/ CD8+比较 (n=6,±s)
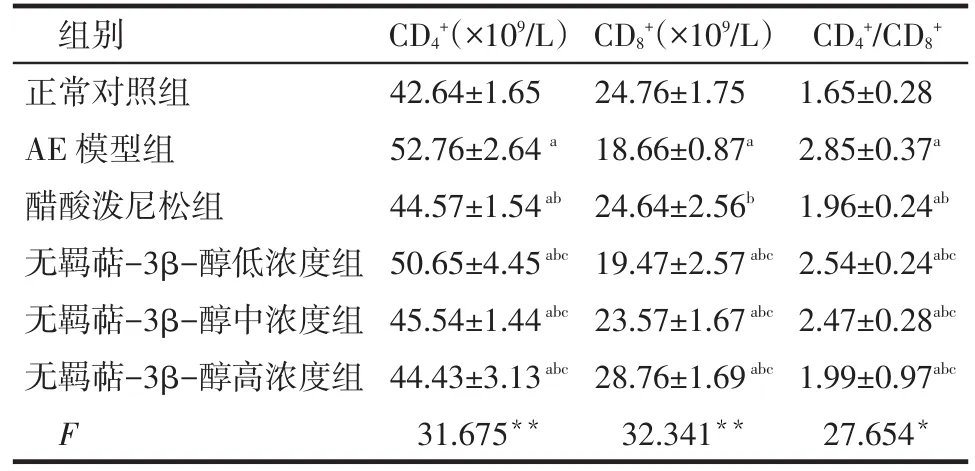
Tab.1 Comparison of the plasma CD4+,CD8+cell count and the CD4+/CD8+value among five groups表1 各组血浆CD4+、CD8+细胞数以及CD4+/ CD8+比较 (n=6,±s)
*P<0.05,**P<0.01;a与正常对照组比较,b与AE模型组比较,c与醋酸泼尼松组比较,P<0.05;表2~4同
组别正常对照组AE模型组醋酸泼尼松组无羁萜-3β-醇低浓度组无羁萜-3β-醇中浓度组无羁萜-3β-醇高浓度组F CD4+(×109∕L)42.64±1.65 52.76±2.64a44.57±1.54ab50.65±4.45abc45.54±1.44abc44.43±3.13abc31.675**CD8+(×109∕L)24.76±1.75 18.66±0.87a24.64±2.56b19.47±2.57abc23.57±1.67abc28.76±1.69abc32.341**CD4+∕CD8+1.65±0.28 2.85±0.37a1.96±0.24ab2.54±0.24abc2.47±0.28abc1.99±0.97abc27.654*
2.2 血浆IL-1、IL-2、IL-6、IL-10的含量检测 与正常对照组比较,AE模型组外周血IL-1、IL-2、IL-6、IL-10含量明显升高;醋酸泼尼松与无羁萜-3β-醇可明显降低外周血IL-1、IL-2、IL-6、IL-10含量,见表2。
2.3 血浆NPY、β-EP的含量检测 与正常对照组比较,AE模型组外周血神经递质NPY含量明显升高、β-EP含量明显降低;醋酸泼尼松与无羁萜-3β-醇可明显抑制外周血神经递质NPY含量升高、β-EP含量降低,见表3。
Tab.2 Comparison of plasma levels of IL-1,IL-2, IL-6,IL-10 among five groups表2 各组血浆IL-1、IL-2、IL-6、IL-10的含量比较(n=6,ng∕L,±s)
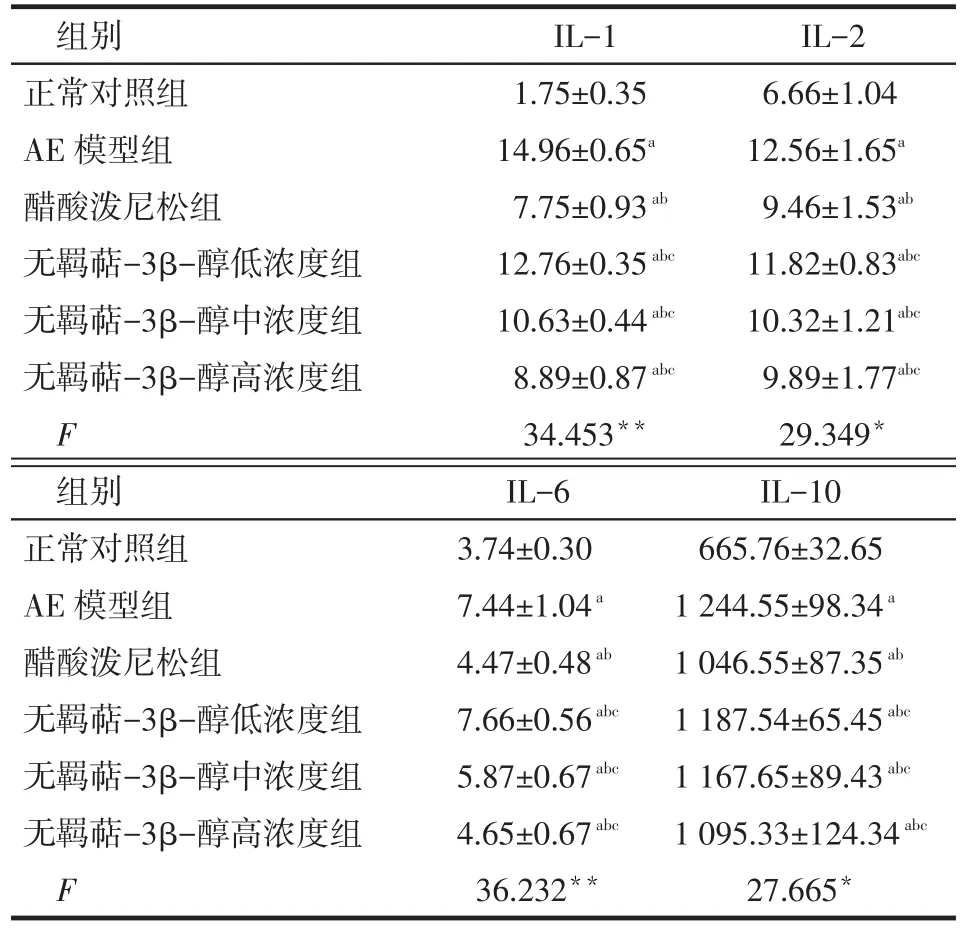
Tab.2 Comparison of plasma levels of IL-1,IL-2, IL-6,IL-10 among five groups表2 各组血浆IL-1、IL-2、IL-6、IL-10的含量比较(n=6,ng∕L,±s)
组别正常对照组AE模型组醋酸泼尼松组无羁萜-3β-醇低浓度组无羁萜-3β-醇中浓度组无羁萜-3β-醇高浓度组F IL-1 1.75±0.35 14.96±0.65a7.75±0.93ab12.76±0.35abc10.63±0.44abc8.89±0.87abc34.453**IL-2 6.66±1.04 12.56±1.65a9.46±1.53ab11.82±0.83abc10.32±1.21abc9.89±1.77abc29.349*组别正常对照组AE模型组醋酸泼尼松组无羁萜-3β-醇低浓度组无羁萜-3β-醇中浓度组无羁萜-3β-醇高浓度组F IL-6 3.74±0.30 7.44±1.04a4.47±0.48ab7.66±0.56abc5.87±0.67abc4.65±0.67abc36.232**IL-10 665.76±32.65 1 244.55±98.34a1 046.55±87.35ab1 187.54±65.45abc1 167.65±89.43abc1 095.33±124.34abc27.665*
Tab.3 Comparison of the plasma neurotransmitter content of NPY and β-EP among five groups表3 各组血浆神经递质NPY、β-EP的含量比较 (n=6,ng∕L,±s)
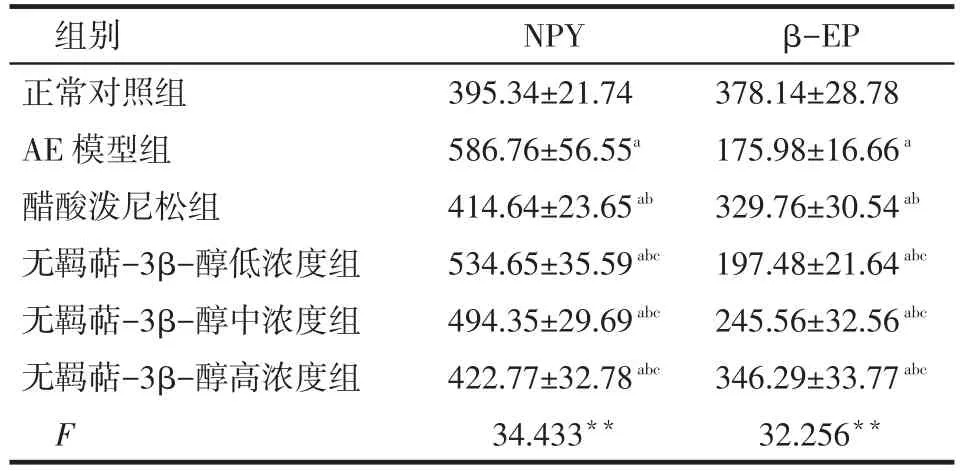
Tab.3 Comparison of the plasma neurotransmitter content of NPY and β-EP among five groups表3 各组血浆神经递质NPY、β-EP的含量比较 (n=6,ng∕L,±s)
组别正常对照组AE模型组醋酸泼尼松组无羁萜-3β-醇低浓度组无羁萜-3β-醇中浓度组无羁萜-3β-醇高浓度组F NPY 395.34±21.74 586.76±56.55a414.64±23.65ab534.65±35.59abc494.35±29.69abc422.77±32.78abc34.433**β-EP 378.14±28.78 175.98±16.66a329.76±30.54ab197.48±21.64abc245.56±32.56abc346.29±33.77abc32.256**
2.4 脑组织 TGF-β、MMP-2、NOS、CD3含量检测 与正常对照组比较,AE模型组豚鼠脑组织TGF-β降低,MMP-2、NOS、CD3升高;醋酸泼尼松与无羁萜-3β-醇可明显抑制豚鼠脑组织TGF-β降低和MMP-2、NOS、CD3升高,见表4。
2.5 神经元形态 (1)光镜下:AE豚鼠大脑皮质神经元肿胀,并有炎细胞浸润,部分神经元胞体变小或呈三角形,基质疏松伴明显微空泡形成;醋酸泼尼松与无羁萜-3β-醇明显抑制神经元凋亡现象,见图1。(2)电镜下:AE豚鼠大脑皮质神经元皱缩、膜结构不清;胞核固缩,染色质聚集成团、异染色质增多,高尔基体增多,线粒体肿胀,嵴融合并出现空泡变性。醋酸泼尼松与无羁萜-3β-醇明显抑制神经元凋亡现象,见图2。
2.6 NOS在神经元内表达 AE豚鼠大脑皮质神经元胞质内荧光高表达,醋酸泼尼松与无羁萜-3β-醇明显抑制AE豚鼠大脑皮质神经元胞质内荧光表达,见图3。
Tab.4 Comparison of the TGF-β,MMP-2,NOS,CD3 content in brain tissue among five groups表4 各组脑组织TGF-β、MMP-2、NOS、CD3含量比较 (n=6,ng∕L,±s)
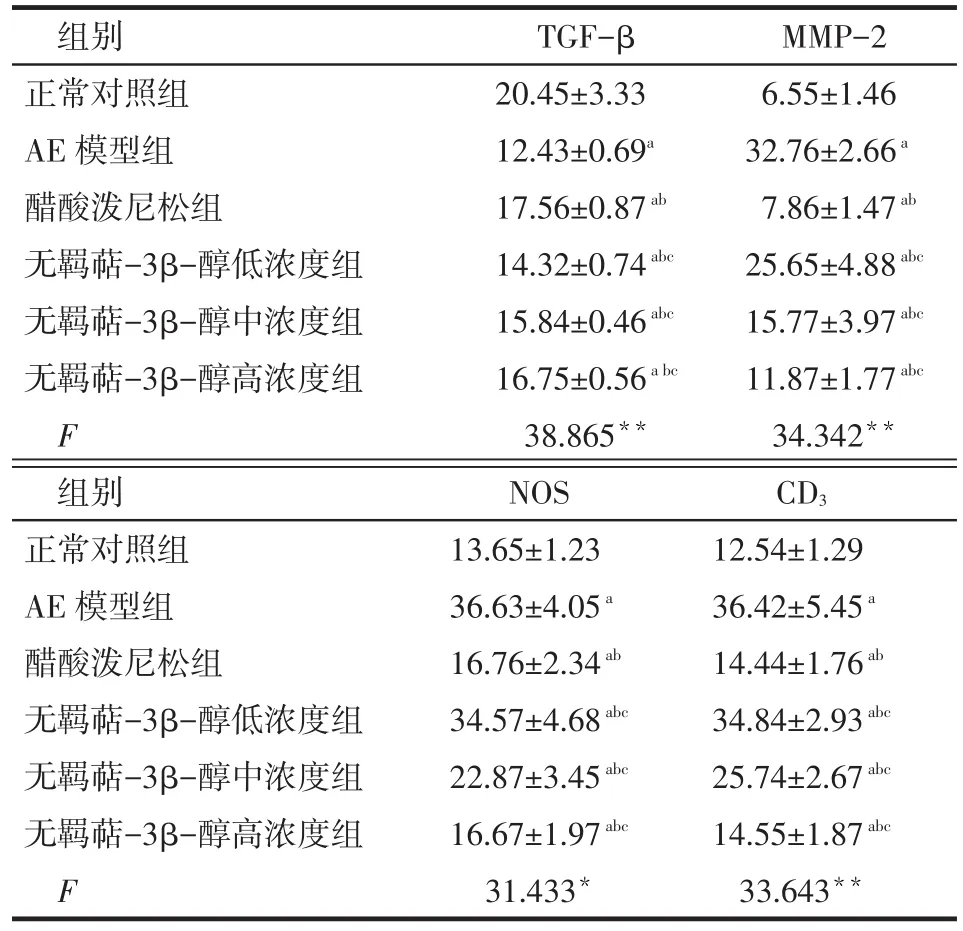
Tab.4 Comparison of the TGF-β,MMP-2,NOS,CD3 content in brain tissue among five groups表4 各组脑组织TGF-β、MMP-2、NOS、CD3含量比较 (n=6,ng∕L,±s)
组别正常对照组AE模型组醋酸泼尼松组无羁萜-3β-醇低浓度组无羁萜-3β-醇中浓度组无羁萜-3β-醇高浓度组F TGF-β 20.45±3.33 12.43±0.69a17.56±0.87ab14.32±0.74abc15.84±0.46abc16.75±0.56a bc38.865**MMP-2 6.55±1.46 32.76±2.66a7.86±1.47ab25.65±4.88abc15.77±3.97abc11.87±1.77abc34.342**组别正常对照组AE模型组醋酸泼尼松组无羁萜-3β-醇低浓度组无羁萜-3β-醇中浓度组无羁萜-3β-醇高浓度组F NOS 13.65±1.23 36.63±4.05a16.76±2.34ab34.57±4.68abc22.87±3.45abc16.67±1.97abc31.433*CD312.54±1.29 36.42±5.45a14.44±1.76ab34.84±2.93abc25.74±2.67abc14.55±1.87abc33.643**
3 讨论
3.1 AE的常规药物治疗及缺点 AE在儿童中的发病概率较高,患者常出现神经功能进行性障碍、肌肉无力、肢体瘫痪等症状。糖皮质激素具有抑制免疫应答、抗炎、抗病毒、抗休克作用,是目前治疗AE的常用药物[5]。但是,长期使用肾上腺皮质激素可引起皮质功能亢进、糖尿病、骨质疏松、感染加重等不良反应。因此,临床上在使用糖皮质激素缓冲治疗的同时,往往联合使用ATP、辅酶A、腺苷、胞二磷胆碱等药物,以促进神经功能的恢复。此外,少量多次输注健康人新鲜血浆也有助于提高患者的免疫功能,有益于预防AE感染和恢复。
3.2 无羁萜-3β-醇的抗AE作用 有学者报道,无羁萜-3β-醇具有一定的抗氧化[2]、抗炎、抗免疫作用[3],而AE是由CD4+T淋巴细胞介导的慢性变态反应性疾病,因此,本研究选用醋酸泼尼松作对照药物,醋酸泼尼松具有上调抗炎细胞因子以及抑制促炎细胞因子表达的作用。本研究显示,100 mg∕(kg·d)无羁萜-3β-醇抑制AE的作用与2 mg∕(kg·d)醋酸泼尼松效果接近。
AE是由CD4+T淋巴细胞介导的自身免疫性疾病[6],阻断或抑制CD4+T淋巴细胞能够有效防治AE发生[7]。研究表明,在AE的缓解期CD4+∕CD8+比值呈明显下降趋势,CD4+T淋巴细胞、CD8+T淋巴细胞以及CD4+∕CD8+比值可作为AE发展状态及评定药物疗效的重要指标[8]。本研究显示,无羁萜-3β-醇抑制AE豚鼠外周血CD4+升高、CD8+降低、CD4+∕CD8+升高。
阿片受体β-EP在免疫应答过程中起到免疫抑制的作用[9-10]。本研究结果显示,无羁萜-3β-醇抑制外周血神经递质NPY含量升高、β-EP含量降低。MMP-2直接攻击血管基底膜,引起炎细胞浸润。CD3仅存在于T细胞表面,参与T细胞的信号转导。本研究结果显示,无羁萜-3β-醇抑制豚鼠脑组织TGF-β降低和MMP-2、NOS、CD3升高。
此外,形态学观察发现,AE豚鼠大脑皮质神经元凋亡明显,无羁萜-3β-醇明显抑制神经元凋亡现象。TGF-β对细胞的生长、分化和免疫功能都有重要的调节作用。
3.3 NO信号通路的影响 NOS参与调节NO生成,NO是先天性免疫应答的调节性效应分子,作为一种信息传递物质维持正常的生理功能[11-13]。本研究通过免疫荧光发现,NOS在AE豚鼠大脑皮质神经元胞质内荧光高表达,2 mg∕(kg·d)的醋酸泼尼松与100 mg∕(kg·d)-1的无羁萜-3β-醇明显抑制AE豚鼠大脑皮质神经元胞质内NOS荧光表达。因此,无羁萜-3β-醇有可能通过影响NO信号通路对AE产生作用,其具体的药物作用机制有待进一步研究。
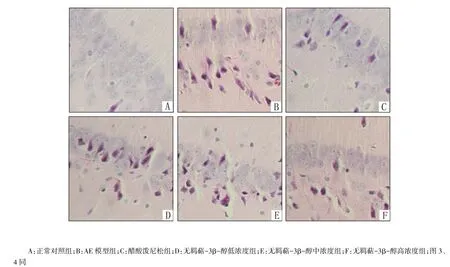
Fig.1 Light microscope image of guinea pig brain neurons图1 豚鼠大脑神经元光镜图像(HE×400)
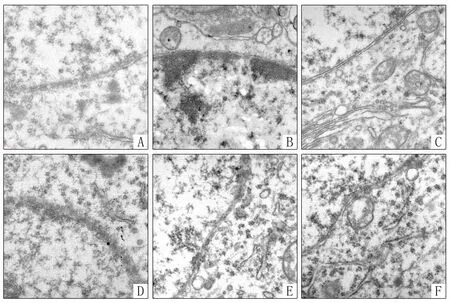
Fig.2 Electron microscopy image of guinea pig brain neurons图2 豚鼠大脑神经元电镜图像(×12 000)
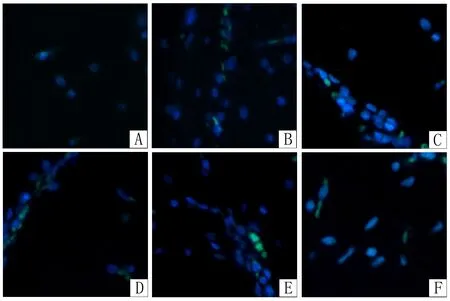
Fig.3 NOS expression in the neuronal cytoplasm图3 免疫荧光显微镜下观察NOS在神经元胞质内的表达(×400)
[1]Pasichna EP,Donchenko HV,Burlaka AP,et al.Use of vitamins for correction of the functional state of cytochrome P450 systems in experimentalallergic encephalomyelitis[J].Ukr Biokhim Zh,2013,85 (5):137-148.
[2]Tian GX,Zhu XQ,Chen Y,et al.Huperzine A inhibits CCL2 production in experimental autoimmune encephalomyelitis mice and in cultured astrocyte[J].Int J Immunopathol Pharmacol,2013,26(3): 757-764.
[3]Yang HH,Son JK,Jung B,et al.Epifriedelanol from the root bark of Ulmus davidiana inhibits cellular senescence in human primary cells[J].Planta Med,2011,77(5):441-449.
[4]Zhang C,Liang H,Tu G,et al.A new natural azulene-type pigment from Oreocnide frutescens[J].Fitoterapia,2010,81(7):849-851.doi: 10.1016∕j.fitote.2010.05.008.
[5]Lin CL,Wang CC,Chang SC,et al.Antioxidative activity of polysaccharide fractions isolated from Lycium barbarum LinnAEus[J].Int J Biol Macromol,2009,45(2):146-151.doi:10.1016∕j.ijbiomac. 2009.04.014.
[6]Luo Q,Li Z,Yan J,et al.Lycium barbarum polysaccharides induce apoptosis in human prostate cancer cells and inhibits prostate cancer growth in a xenograft mouse model of human prostate cancer[J]. J Med Food,2009,12(4):695-703.doi:10.1089∕jmf.2008.1232.
[7]Amagase H,Sun B,Nance DM.Immunomodulatory effects of a standardized Lycium barbarum fruit juice in chinese older healthy human subjects[J].J Med Food,2009,12(5):1159-1165.doi: 10.1089∕jmf.2008.0300.
[8]Shin T,Ahn M,Moon C,et al.Erythropoietin and autoimmune neuroinflammation:lessons from experimental autoimmune encephalomyelitis and experimental autoimmune neuritis[J].Anat Cell Biol,2012, 45(4):215-220.doi:10.5115∕acb.2012.45.4.215.
[9]Guo C,Liu N,Li X,et al.Effect of acupotomy on nitric oxide synthase and beta-endorphin in third lumbar vertebrae transverse process syndrome model rats[J].J Tradit Chin Med,2014,34(2):194-198. [10]Mohammad MG,Hassanpour M,Tsai VW,et al.Dendritic cells and multiple sclerosis:disease,tolerance and therapy[J].Int J Mol Sci, 2012,14(1):547-562.doi:10.3390∕ijms14010547.
[11]Gelderblom M,DAEhn T,Schattling B,et al.Plasma levels of neuron specific enolase quantify the extent of neuronal injury in murine models of ischemic stroke and multiple sclerosis[J].Neurobiol Dis, 2013,59:177-182.doi:10.1016∕j.nbd.2013.07.017.
[12]Wei J,Huang Q,Huang R,et al.Asiatic acid from Potentilla chinensis attenuate ethanol-induced hepatic injury via suppression of oxidative stress and Kupffer cell activation[J].Biol Pharm Bull,2013,36 (12):1980-1989.
[13]Gu B,Zeng Y,Yin C,et al.Sinomenine reduces iNOS expression via inhibiting the T-bet IFN-γ pathway in experimental autoimmune encephalomyelitis in rats[J].J Biomed Res,2012,26(6):448-455.doi:10.7555∕JBR.26.20110114.
(2014-01-29收稿 2014-05-21修回)
(本文编辑 李鹏)
Inhibition Effect of Non Custodial Terpenes-3 β-Alcohol to Autoimmune Encephalomyelitis
GUO Xixia1,YANG Jing2,HUANG Ning1,WAN Renling1,LI Zhaohui1,XU Gaowei1,YIN Yaling1△,LI Peng1
1 Xinxiang Medical University,Henan 453003,China;2 Puyang medical school,Henan△
E-mail:hnxxlp@163.com
ObjectiveTo study the inhibition effect of non custodial terpenes-3 β-alcohol to experimentally induced autoimmune encephalomyelitis in guinea pigs.MethodsDifferent doses(25 mg∕kg,50 mg∕kg and 100 mg∕kg)of non custodial terpenes-3 β-alcohol were given to the experimentally induced autoimmune encephalomyelitis model of guinea pigs by gavage for 8 weeks.Plasma levels of CD4+∕CD8+,IL-1,IL-2,IL-6,IL-10,neuropeptide Y(NPY),beta endorphin(β-EP),transforming growth factor-β(TGF-β),matrix metalloproteinase(MMP-2),nitric oxide synthase(NOS)and leukocyte differentiation antigen CD3were assessed.The brain neuron morphology changes was observed under light microscopy while its ultrastructure changes was observed under electron microscope.NOS expression in neurons was observed through immunofluoresce technology.ResultsNon custodialterpenes-3β-alcohol inhibited the increase of plasma CD4+∕CD8+,IL-1,IL-2,IL-6,IL-10,MMP-2,CD3and NPY while decrease of plasma β-EP,brain TGF-β.It also increase NOS expression in neuronal cytoplasm and maintained neuron morphology.ConclusionNon custodial terpenes-3 β-alcohol inhibited the experimental autoimmune encephalomyelitis in guinea pig.
encephalomyelitis,autoimmune,experimental;interleukins;receptors,cytokine;neuropeptide Y;transforming growth factor beta;matrix metalloproteinase 2;nitric oxide synthase;antigens,CD;neurons;non custodial terpenes-3 β-alcohol
R744.3
A
10.3969∕j.issn.0253-9896.2014.10.002
国家自然科学基金资助项目(81200836);河南省科技厅科技攻关项目(132102310247);新乡医学院重点研究领域招标课题(ZD2011-30)
1新乡医学院(邮编453003);2濮阳市卫生学校
△通讯作者 E-mail:hnxxlp@163.com
