紫菜多糖提取工艺技术及抗氧化活性研究
2014-07-02周小伟钟瑞敏
周小伟,钟瑞敏
(韶关学院英东食品科学与工程学院,广东韶关512005)
紫菜多糖提取工艺技术及抗氧化活性研究
周小伟,钟瑞敏*
(韶关学院英东食品科学与工程学院,广东韶关512005)
在单因素实验的基础上,对影响紫菜多糖提取得率的因素:提取温度、提取时间、提取料液比设计正交实验。正交实验结果显示:提取温度为80℃、料液比为1∶20、提取时间为2 h,水提醇沉紫菜多糖得率最高。实验中利用Sevag法进行脱蛋白,脱除6次后,蛋白含量从最开始的14.31%降低至6.0%,多糖含量则可以达到87.66%。体外抗氧化活性实验结果表明紫菜多糖具有较强的抗氧化活性,对·OH和DPPH·均有良好的清除效果,并呈现出明显的线性关系。其中当浓度为3mg/mL时,·OH的清除率可以达到90.9%;当浓度为2.5mg/mL时,对DPPH·清除率可以达到90%。
紫菜多糖;单因素;正交;抗氧化;红外
多糖是广泛存在于动植物和微生物中由单糖组成的天然高分子化合物。一般而言,根据来源不同,自然界中的多糖可分为动物多糖、植物多糖以及微生物多糖[1]等。近年来,随着多糖的各种功能如抗肿瘤、抗癌等开始被研究发现,对多糖进行的研究也进行得越来越频繁。目前海洋功能性多糖的研究引起人们的高度关注。紫菜属于海藻类,主要为红藻门红毛菜科植物甘紫菜的叶状体[2],是一种深受人们喜爱的食物。紫菜多糖一般主要分为紫菜胶和琼胶两大类,而二者的主要区别在于硫酸基含量的高低。
由于生长条件、成长环境等因素的影响[3],紫菜多糖的含量会出现一定程度上的差异。并且各多糖组分中单糖组成也各有差异。研究证明,紫菜多糖主要由岩藻糖、半乳糖、甘露糖、葡萄糖和木糖等组成,是一种糖醛酸含量较高的酸性杂多糖[4]。紫菜多糖的生物活性研究实验表明其具有多种生物学活性及药用价值,如降血脂、抗血栓、降血糖抗炎、抗疲劳、增强免疫、抑制肿瘤生长等作用。因此在保健品和医药中具有广阔的开发前景。近年来,紫菜多糖因其来源广泛,多糖含量高而引起研究者的兴趣。但皆停留在初级提取阶段,对其性质,生物活性功能都缺少深入的研究。
本论文在单因素实验的基础上对提取条件进行优化,以最大程度提高紫菜多糖的得率。同时,对脱蛋白后的紫菜多糖的体外抗氧化活性进行了研究。
1 材料与方法
1.1 材料与仪器
紫菜干:购于南昌大学新世纪超市。
HH-2数显恒温水浴锅:江苏金坛市亿通电子有限公司;SHZ-D(Ⅲ)循环水式真空泵;冷冻干燥机;DHG-9070A电热恒温鼓风干燥箱:上海精宏实验设备有限公司;B3200S-T超声机:必能信超声有限公司;T6紫外可见分光光度计:北京普析仪器设备有限责任公司;RE-52AA旋转蒸发仪:上海亚荣生化仪器厂;JY3001电子天平:上海衡平仪器仪表厂。
丙酮、无水乙醇、乙醚、正丁醇、氯仿、浓硫酸、苯酚、磷酸、牛血清蛋白、考马斯亮蓝G250均为分析纯。
1.2 方法
1.2.1 原料的预处理[5]
干紫菜经60℃干燥后粉碎,过80目筛子。后经无水乙醇回流2 h,以除去其中所含的小分子色素及酯类物质等。回流后的粉末依次用无水乙醇、丙酮和石油醚清洗后风干得紫菜粗粉末。
1.2.2 紫菜多糖的提取方法[6]
称取一定质量的经过预处理的紫菜粉末,按照一定的料液比加入蒸馏水后,在一定温度下水浴加热一段时间。待提取液冷去后,旋转蒸发至一定体积。静置12 h、离心、冷冻干燥后得紫菜粗多糖。
1.3 不同提取条件对紫菜多糖提取率的影响
1.3.1 不同温度对紫菜多糖提取率的影响
根据1.2.2所示的方法,分别称取5 g紫菜粉末,料液比为1∶20(g/mL),分别在65、70、75、80、85、90℃条件下,提取2 h,测定温度对紫菜多糖得率的影响。
1.3.2 不同料液比对多糖得率的影响
分别称取5 g经过预处理的紫菜粉末,控制提取温度为80℃,在料液比(g/mL)分别为1∶5、1∶10、1∶20、1∶30、1∶40的条件下,提取2 h。测定料液比对紫菜多糖得率的影响。
1.3.3 不同料液比对紫菜多糖提取率的影响
分别称取5 g经过预处理的紫菜粉末,控制料液比为1∶20(g/mL),提取温度为80℃条件下分别提取1、1.5、2、2.5、3 h,测定提取时间对紫菜多糖得率的影响。
1.4 紫菜多糖的测定方法[7-9]
实验过程中利用苯酚-硫酸[10]法测定紫菜粗多糖的含量以及纯度,以葡萄糖作为标准样品。
其中根据测定结果,紫菜多糖的得率用式(1)表示。

1.5 蛋白质的去除
采用Sevag法脱蛋白,利用考马斯亮蓝法[11]测定蛋白含量。同时测定了脱除次数对紫菜多糖纯度和含量的影响。
1.6 正交试验测定优化测定紫菜多糖的提取条件
在单因素试验的基础上,利用正交试验设计对提取紫菜多糖各影响因素进行优化。因素水平如表1所示。

表1 正交试验设计因素-水平表[12]Table 1 Factors and Levels of orthogonal experiment methodology
1.7 紫菜多糖的红外光谱测定
取干燥的紫菜粗多糖1 mg~2 mg,研成粉末,与KBr混合压片制样,红外光谱仪对样品在400 cm-1~4 000 cm-1区内进行扫描。
1.8 紫菜多糖的体外抗氧化活性研究
1.8.1 还原力的测定
实验中以VC(抗坏血酸)为对照样品[13],不同质量浓度的多糖样品溶液作为实验组。实验过程中,取样品溶液1 mL,加入2.5 mL的磷酸盐缓冲液(pH=6.6),充分混匀后加入1%的铁氰化钾溶液2.5 mL,混合均匀,后经50℃恒温水域加热20 min。待溶液冷却至室温后加入10%的三氯乙酸溶液2.5 mL。离心后,取上清液2.5 mL,加入2.5 mL蒸馏水和0.5 mL 0.1%的FeCl3溶液。于700 nm处测定吸光度,吸光度越高,说明这种反应混合物的还原性越强。
1.8.2 清除·OH活性的测定
以不同温度质量浓度多糖样品溶液为实验组[14],VC作为对照组进行实验。实验过程中向1 mL样品溶液中加入6 mmol/L FeSO4溶液1 mL,充分混匀后加入1mL浓度为6mmol/L的H2O2溶液,静置10min。后加入6mmol/L水杨酸溶液1mL,于37℃水浴中反应30min,反应完全后在3 000 r/min,室温下离心10 min。最后取上清液于波长510 nm处测其吸光度,空白对照以双蒸水代替多糖溶液。
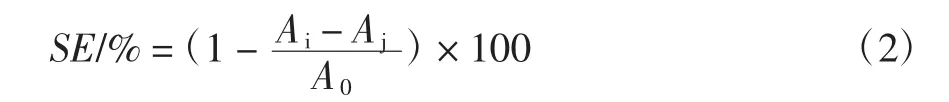
式中:SE代表清除率;Ai是样品溶液的吸光度;Aj为双蒸水代替水杨酸时样品溶液的吸光度;A0为空白对照组吸光度。
1.8.3 DPPH自由基活性的测定根据AMAROWICZ[15]的方法测定。
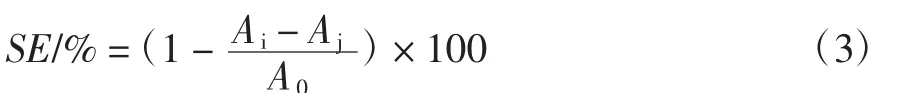
式中:SE为清除率;Ai为2 mL DPPH溶液+2 mL样品溶液吸光度;Aj为2 mL无水乙醇+2 mL样品溶液吸光度;A0为2 mLDPPH溶液+2 mL双蒸水吸光度。
1.9 统计分析
利用Origin 8.0作图,Design Expert 7.5进行数据处理。
2 结果
2.1 温度对紫菜多糖得率的影响
温度对紫菜多糖得率的影响见图1。
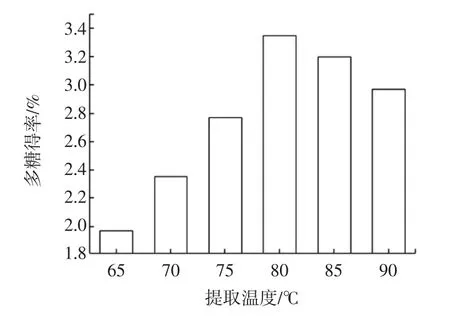
图1 温度对紫菜多糖提取率的影响Fig.1 The effect of extraction temperature on the yield of of Porphyra Polysaccharide
从图1可知,紫菜多糖的提取得率随着温度的升高先升后降。当提取温度为80℃时,得率最大。这可能是因为:多糖的提取是一个持续溶出的过程,高温有利于细胞破碎,多糖溶出,其得率上升;但当温度太高时,持续性的高温提取会破坏多糖结构,多糖发生降解,得率下降。且在实际生产工作中,过高的温度还会增加能耗和设备的投入。综合考虑实验成本等因素之后。本实验确定80℃为紫菜多糖的最佳提取温度。
2.2 料液比对紫菜多糖得率的影响
料液比对紫菜多糖得率的影响见图2。
从图2可知,随着料液比的升高,多糖得率也会相应的增高;而当料液比过高时,多糖得率并未升高反而有所降低,可能是因为多糖能与水以任意比互溶,水量越多,后续工艺中的提取液的浓缩成本和醇沉中的酒精用量就越多,提取液中多糖的浓度太低时,相同浓度的酒精就越难以将多糖沉淀出来。故在本实验中,选择1∶20(g/mL)为最佳料液比。

图2 料液比对紫菜多糖提取率的影响Fig.2 The effect of the ratio of raw materials to water on the yield of Porphyra Polysaccharide
2.3 提取时间对紫菜多糖得率的影响
提取时间对紫菜多糖得率的影响见图3。
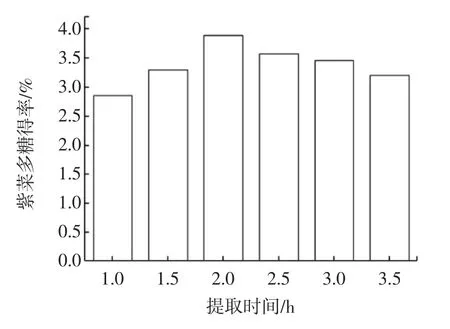
图3 提取时间对紫菜多糖提取率的影响Fig.3 The effect of extraction time on the yield of Porphyra Polysaccharide
从图3可知,提取时间太短,不利于植物细胞的破碎,样品中多糖未能充分溶出,从而降低多糖的提取率[16];提取时间太长,可能会使部分多糖在高温提取过程中被破坏或者降解,降低多糖的得率,并且冷冻干燥后的粗多糖颜色较深,影响后期的溶解和吸光度的测定,造成浪费资源,增加不必要的成本和能耗。因此,在本实验中,综合考虑成本和效率因素后,确定2 h为最佳提取时间,在此条件下紫菜多糖的得率为3.89%。
2.4 正交试验结果
正交试验结果见表2可以看出,3个因素对最终粗多糖提取率的影响大小依次为提取温度>料液比>提取时间,其中料液比对粗多糖得率的影响最为显著。同时,正交的实验结果表明,最佳的提取条件为A3B2C2,即提取时间2 h,料液比为1∶20(g/mL),提取温度80℃,在该条件下粗多糖的最终得率可以达到3.891 0%。
2.5 验证性实验
在实验的过程中,我们根据正交实验所得到的实验结果进行验证性实验,以考察较优实验条件的再现性。准确称取5 g紫菜粉末,按比例加入100 mL的蒸馏水,80℃水浴浸提120 min,使其中的多糖溶解出来,后冷却离心,收集上清液,定容至100 mL,利用苯酚-硫酸法显色,测定其吸光度,并计算多糖含量及得率,结果显示紫菜多糖得率可以达到3.95%。可以证明在此条件下,紫菜多糖的得率最高。
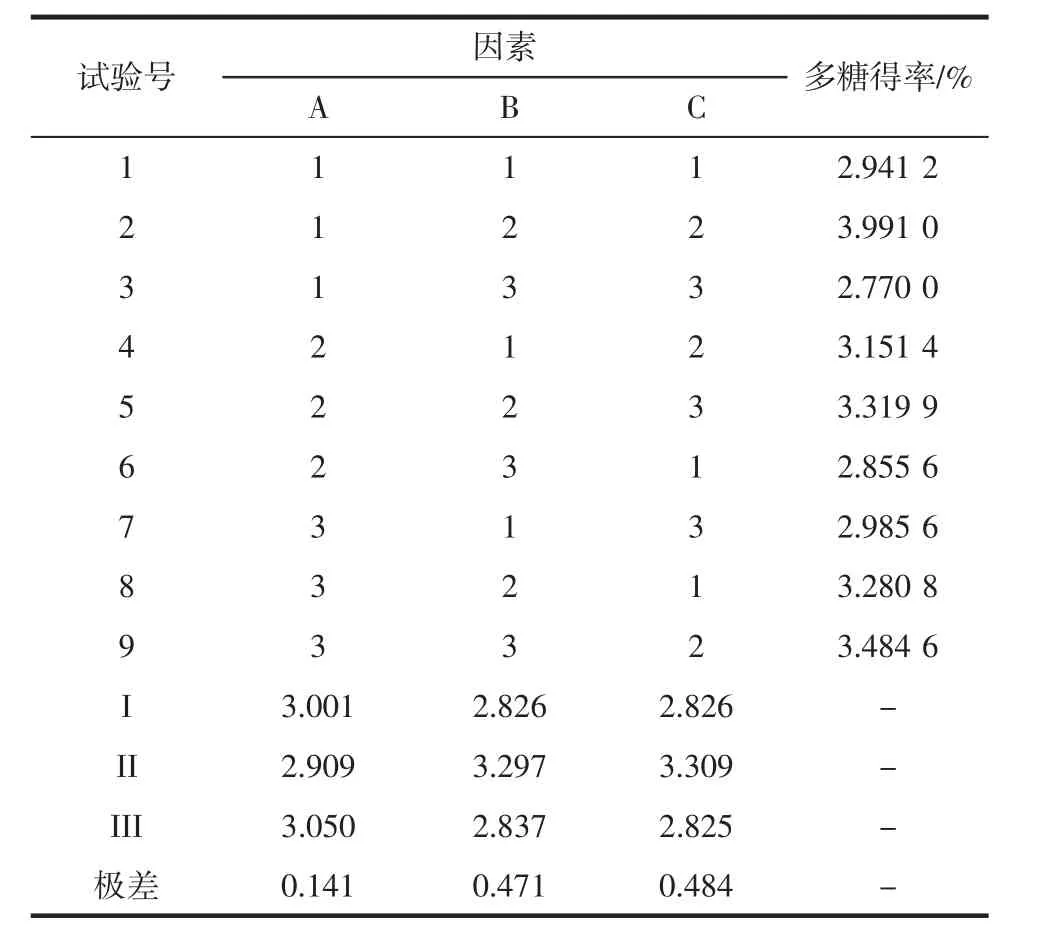
表2 正交试验设计及结果Table 2 Results of the orthogonal test
2.6 Sevag法脱除蛋白次数的测定
实验时,准确称取适量紫菜粗多糖,溶解于适量超纯水中,按样品溶液体积的1/3~1/4加入Sevag试剂,搅拌均匀后置于离心机中离心15 min,转速为6 500 r,后利用分液漏斗除去下层有机试剂以及中间层变性的蛋白质,重复该操作6次,后收集上清液,浓缩后冷冻干燥,即可得到已脱蛋白的精制多糖。测定结果见表3。
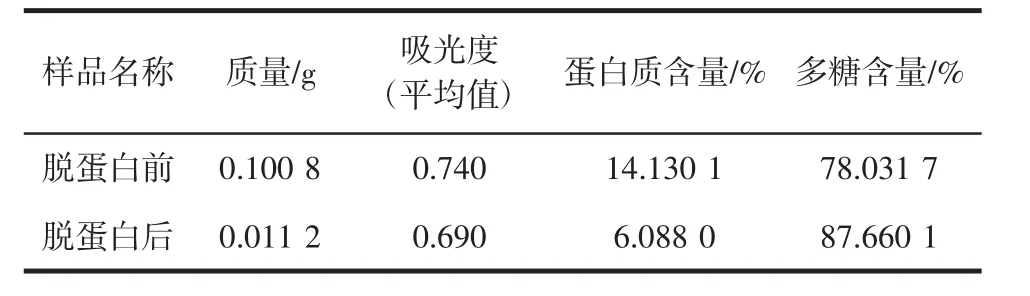
表3 经Sevag法脱蛋白的结果Table 3 The content of protein by Sevag reagent
利用Sevag试剂法除去粗多糖中的蛋白质,主要是指除去游离蛋白质。从上表结果可看出,经过Sevag试剂法脱蛋白后,紫菜多糖中的蛋白质降到6%左右,证明利用Sevag法可以较为彻底除去多糖中所含的蛋白质。而剩下的蛋白则有可能与多糖结合在一起成为蛋白复合物。而实验过程中,通过I-KI显色实验测得反应呈阴性,表明提取所得多糖中并不存在淀粉,是一种非淀粉类多糖。
2.7 紫菜多糖的红外光谱结果
紫菜多糖的红外光谱结果见图4。
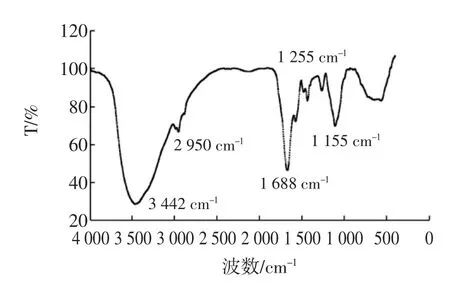
图4 紫菜多糖的红外光谱图谱Fig.4 Infrared spectrums of Porphyra Polysaccharise
从提取的粗多糖的红外光谱图中我们可以看到,其具有一般多糖在红外光谱中的特征性结构,具有以下几种特征峰[17]:3 442 cm-1的宽峰是多糖分子中-OH伸缩振动峰;2 950处的是C-H的伸缩振动峰,据此可以判断该类化合物是糖类化合物。1 255 cm-1表明其可能存在着硫酸基;1 688 cm-1处的峰形表明其存在着C=O键,证明其可能存在着与多糖相结合在一起的蛋白质。
2.8 紫菜多糖的体外抗氧化性功能
2.8.1 还原力的测定
紫菜多糖还原力的测定结果见图5。
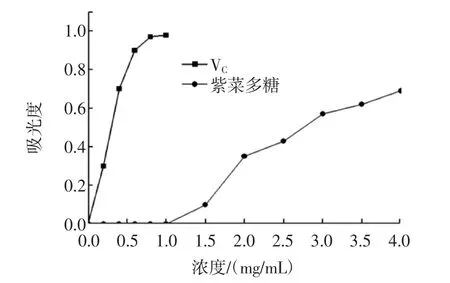
图5 紫菜多糖的还原能力Fig.5 Reducing power of Porphyra polysaccharise
由图5可以看出,紫菜多糖的还原能力有很好的量效关系,会随着质量浓度的增加呈上升趋势。当其浓度为4 mg/mL时,吸光度为0.69,证明其具有一定的还原能力。但是其还原力弱于VC。这可能因为提取到的紫菜多糖具有的还原性末端相对较少[18]。
2.8.2 紫菜多糖对·OH的清除能力的测定
紫菜多糖对·OH的清除能力的测定结果见图6,可以看出,紫菜多糖对·OH的清除能力会随着浓度的变化而随之发生变化。当浓度为3 mg/mL时,吸光度可以达到90.9%,与同等浓度的VC相接近。此外,提取到的紫菜多糖的清除·OH能力低于VC。这可能是因为·OH必须与多糖碳氢链上的氢原子结合才能够被清除,而VC由于有很强的还原性,不仅可以直接清除·OH,甚至可以抑制·OH的产生[19]。
2.8.3 紫菜多糖对DPPH·的清除能力
紫菜多糖对DPPH·的清除能力见图7。
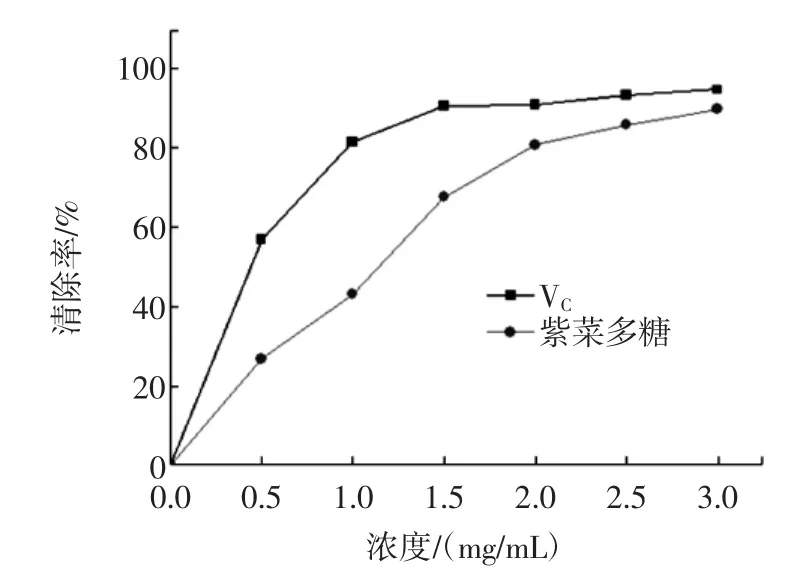
图6 紫菜多糖清除·OH的能力Fig.6 Scavenging capacity of Porphyra polysaccharise on hydroxyl free radicals
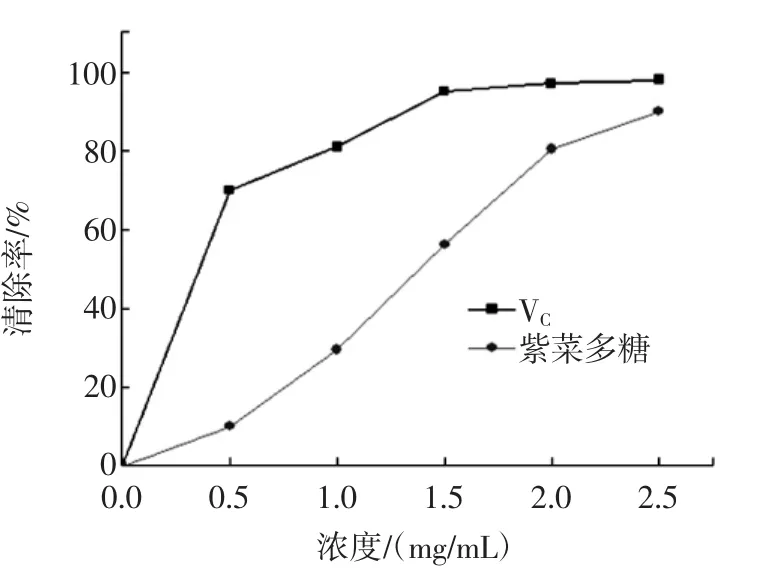
图7 紫菜多糖清除DPPH自由基能力Fig.7 Scavenging capacity of Porphyra polysaccharise against DPPH free radicals
根据图可知,紫菜多糖对DPPH的清除具有很明显的量效关系。随着紫菜浓度的不断增高,其对DPPH·的清除能力也不断增强。当质量浓度达到2.5 mg/mL时甚至与VC相近,达到90%。
3 结论
1)本实验研究了紫菜中多糖的最佳提取方法。并且对影响其提取率的几个主要因素分别进行了单因素实验。在单因素实验的基础上通过正交试验设计对其提取工艺进行优化,优化结果表明:最佳的提取温度为80℃、料液比为1∶20、提取时间为2 h。在此条件下,其得率最高,可以达到3%。
2)实验过程中利用Sevag法脱蛋白。经实验测定,脱蛋白6次时,多糖中蛋白含量最低,多糖含量最高,分别为6%和87%。
3)从实验结果可以看出,紫菜多糖具有较强的体外抗氧化活性,且与其质量浓度有着一定的关系。
[1] 张艺,刘毅.日本研究多糖的新进展[J].国际中医中药杂志,1997, 19(3):46-47
[2]刘青梅,杨性民,邓红霞,等.紫菜多糖提取分离及纯化技术研究[J].浙江大学学报:农业与生命科学版,2005,31(3):293-297
[3]吕燕,陈颢,费修绠,等.坛紫莱多糖的分离纯化和结构分析(Ⅱ)[J].南京大学学报:自然科学版,2001,37(2):240-245
[4]Wu Q,Tan Z,Liu H,et al.Chemical characterization of Auricularia auricula polysaccharides and its pharmacological effect on heart antioxidant enzyme activities and left ventricular function in aged mice[J].International journal of biological macromolecules,2010, 46(3):284-288
[5]钟葵,曾志红,林伟静,等.绿豆多糖制备及抗氧化特性研究[J].中国粮油学报,2013,28(2):93-98
[6] 达娃,戴岑,席美丽.绿豆多糖的提取工艺研究[J].陕西农业科学, 2010,56(1):23-25
[7]Huang Q,Jin Y,Zhang L,et al.Structure,molecular size and antitumor activities of polysaccharides from Poria cocos mycelia produced in fermenter[J].Carbohydrate Polymers,2007,70(3):324-333
[8]Yang X,Zhao Y,Li G,et al.Chemical composition and immunostimulating properties ofpolysaccharide biologicalresponse modifier isolated from Radix Angelica sinensis[J].Food chemistry, 2008,106(1):269-276
[9]张惟杰.复合多糖生化研究技术[M].2版.上海:上海科技出版社, 1999
[10]Zhu C,Liu X.Optimization of extraction process of crude polysaccharides from Pomegranate peel by response surface methodology[J]. Carbohydrate polymers,2013,92(2):1197-1202
[11]齐慧玲,魏绍云,王继伦,等.Sevag法去除白及多糖中蛋白的研究[J].天津化工,2000(3):20-22
[12]董如何,肖必华,方永水.正交试验设计的理论分析方法及应用[J].安徽建筑工业学院学报,2004,12(6):103-106
[13]吴亚林,黄静,潘远江.无花果多糖的分离、纯化和鉴定[J].浙江大学学报:理学版,2004,31(2):177-179,187
[14]胡喜兰,韩照祥,陶莹,等.DPPH·法测定17种植物的抗氧化活性[J].食品科技,2006,31(10):264-268
[15]Amarowicz R,Naczk M,Shahidi F.Antioxidant activity of various fractions of non-tannin phenolics of canola hulls[J].Journal of Agricultural and Food Chemistry,2000,48(7):2755-2759
[16]闵甜,吴晖,赖富饶,等.超声辅助提取绿豆皮水溶性多糖工艺优化[J].食品科学,2012(14):6-10
[17]Zou S,Zhang X,Yao W,et al.Structure characterization and hypoglycemic activity of a polysaccharide isolated from the fruit of Lycium barbarum L[J].Carbohydrate Polymers,2010,80(4):1161-1167
[18]Smirnoff N,Cumbes Q J.Hydroxyl radical scavenging activity of compatible solutes[J].Phytochemistry,1989,28(4):1057-1060
[19]谭榀新,叶涛,刘湘新,等.植物提取物抗氧化成分及机理研究进展[J].食品科学,2010(15):288-292
Study on Extraction of Porphyra Polysaccahride and its Antioxidant Properties
ZHOU Xiao-wei,ZHONG Rui-min*
(Yingdong College of Food Science and Technology,Shaoguan University,Shaoguan 512005,Guangdong,China)
On the base of single factor including extraction temperature,extraction time and the ratio of raw materials to water,experiments,the research aims to explore the suitable consideration considering the optimal conditions of extracting porphyra polysaccharide.According to the experiments,the optimal conditions for extracting porphyra polysaccharide can be as follows:extraction temperature 80℃,extraction time 2 h,the ratio of raw materials to water was 1∶20.Following this,the yield of porphyra polysaccharide could be 3%.On the next stage,Sevag has been employed to remove the obtained protein.After six times,the content of protein can be reduced from 14.31%to 6.0%whilst the content of porphyra polysaccharide can reach 87.66%.The result of antioxidant activity revealed that the extract showed good scavenging effect for·OH and DPPH·.Besides,there were obvious positive relationship between the concentration and activity of the extract.When the concentration of porphyra polysaccharide was 3 mg/mL,·OH scavenging rate can reach 90.9%;and when the concentration of porphyra polysaccharide was 2.5 mg/mL,DPPH·scavenging rate can reach 90%.
porphyra polysaccharide;single factor;orthogonal test;antioxidant property;IR
10.3969/j.issn.1005-6521.2014.19.012
2014-06-24
周小伟(1986—),男(汉),助教,硕士,研究方向:食品营养学。
*通信作者:钟瑞敏,男,教授,博士,研究方向:食品中天然产物及工艺研究。
