细胞及瘤块种植人前列腺癌裸鼠皮下移植瘤模型的比较
2014-07-02南淑良林艳端白文坤
南淑良,申 锷,林艳端,白文坤,王 玉,胡 兵
(上海交通大学附属第六人民医院超声医学科上海超声医学研究所,上海 200233)
·论 著·
细胞及瘤块种植人前列腺癌裸鼠皮下移植瘤模型的比较
南淑良,申 锷,林艳端,白文坤,王 玉,胡 兵
(上海交通大学附属第六人民医院超声医学科上海超声医学研究所,上海 200233)
目的 比较细胞悬液法及瘤块法种植裸鼠前列腺癌皮下移植瘤,以期获得使瘤体生长最快,质量最佳的种植方式。方法 采用细胞悬液及瘤块两种方式种植PC-3细胞人前列腺癌皮下移植瘤,比较两种种植方法所种植的移植瘤的成瘤率、成瘤潜伏期、瘤体形态以及移植瘤的中心坏死灶,同时对两种方法种植的皮下移植瘤进行常规病理学检查。本研究同时观察了PC-3细胞悬液浓度对于种植皮下移植瘤成瘤的影响。结果 两种方式种植的移植瘤的成瘤率差异无统计学意义,采用瘤块种植的移植瘤生长较细胞种植稍快,瘤体形态各异,较容易发生中心性坏死;细胞悬液组成瘤稍慢,瘤体较规则,多呈圆形或椭圆形,发生中心性坏死较晚,而且随着细胞浓度增高,其成瘤潜伏期明显缩短。结论 通过比较发现细胞悬液种植皮下移植瘤较瘤块种植更有优势,而且采用较高浓度细胞悬液种植可以有效缩短成瘤潜伏期,是一种较为理想的种植方式。
裸鼠;皮下移植瘤;前列腺癌PC-3细胞;瘤块
目前,前列腺癌发病率较高,其中发达国家的发病率占全球总发病率的2/3[1],在美国,前列腺癌的死亡率高居第二位[2],近年来我国前列腺癌发病率也呈上升趋势,前列腺癌严重影响老年男性的生命健康及生活质量。因此研究前列腺癌的发病机制,寻求有效的治疗措施等势在必行。建立前列腺癌理想的动物模型是阐明其发病机制、肿瘤的侵袭转移过程、肿瘤与宿主激素水平的关系以及药物基因等治疗措施有效性的实验基础。目前异种移植模型应用较多,皮下移植已广泛应用于前列腺癌发病机制及药物基因治疗领域。本研究采用人雄激素非依赖性前列腺癌PC-3细胞建立裸鼠前列腺癌皮下移植瘤,通过比较不同浓度的细胞悬液及瘤块种植的皮下移植瘤成瘤率、移植瘤生长速度及瘤体质量,旨在筛选出最佳种植方式。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 BABL/c裸鼠25只,雄性,4周龄,体重约20~25 g,SPF条件下饲养,由上海交通大学附属第六人民医院实验中心提供,生产许可证号:SCXK2008-0016,使用许可证号:SYXK011-0128。
1.1.2 实验细胞株及培养基 人前列腺癌PC-3细胞(购自上海中科院生物研究所),该细胞为雄激素非依赖性,用RPMI-1640内含10%的胎牛血清(FBS,Invitrogen)的培养基在5%CO2、37℃恒温培养箱中培养,细胞呈梭形贴壁生长。
1.2 实验方法
1.2.1 细胞悬液种植方法 取呈对数生长期的前列腺癌PC-3细胞,采用0.25%的胰酶消化,以1000r/min速度离心5 min后将其浓度分别调整为所需浓度,接种前用酒精棉球消毒裸鼠右侧背部皮肤,取0.1 ml的细胞悬液,沿皮下进针约10 mm(防止细胞悬液外漏)后将细胞悬液注入裸鼠背部皮下,在皮下形成圆形或椭圆形皮丘,迅速退针观察无细胞悬液外漏为接种成功,接种过程中裸鼠无需麻醉。
1.2.2 瘤块种植方法 先用细胞悬液接种法建立皮下移植瘤模型,选择移植瘤直径约5~7 mm,肿瘤生长旺盛且皮肤无溃破的裸鼠,颈椎脱臼法处死裸鼠,取其瘤体用生理盐水清洗3次后,取瘤体边缘活力较旺盛的组织,将其剪成约1 mm3大小的瘤块备用。然后用1%的戊巴比妥钠40 mg/kg腹腔注射麻醉裸鼠,在裸鼠右侧背部皮下做一小切口,将瘤块沿切口逐渐送入至距切口约10 mm处,每只裸鼠接种一个组织块,接种完成后缝合切口,整个接种过程在30 min之内完成。
1.3 实验分组
1.3.1 细胞悬液与瘤块种植移植瘤 细胞悬液组采用浓度为1×107/ml的PC-3细胞按照上述细胞悬液种植方法种植,瘤块组采用的瘤块为人前列腺癌PC-3细胞接种成功的皮下移植瘤,按照上述瘤块种植方法种植,5只/组,均接种成功。
1.3.2 不同浓度细胞悬液种植皮下移植瘤 将细胞悬液浓度分别调整为5×107/ml(A组)、1×108/ml(B组)、2×108/ml(C组),按照上述细胞悬液种植方法种植,5只/组,A组、B组、C组三组裸鼠最终接种的细胞数分别为5×106个/只、1×107个/只、2×107个/只,该组15只裸鼠均接种成功。
1.4 观察指标
1.4.1 细胞悬液和瘤块种植的皮下移植瘤生长情况的比较 接种后每天观察移植瘤的生长情况,在移植瘤长径约10 mm时颈椎脱臼法处死裸鼠,皮下剥离肿瘤组织,观察瘤体大体形态,切开肿瘤观察其坏死程度。
1.4.2 病理学检查 将移植瘤组织固定于10%福尔马林溶液中,石蜡包埋后切取4 μm的切片,行常规苏木精-伊红(HE)染色后于普通光学显微镜下观察。
1.4.3 观察不同浓度细胞悬液对裸鼠移植瘤成瘤的影响 接种后每天观察裸鼠的生活情况及接种部位肿瘤的生长情况,每5 d用游标卡尺测量各组瘤体的长径(a)及短径(b),按照公式V=1/2(ab2)计算肿瘤体积[3],同时观察并记录移植瘤的成瘤时间、大体形态、皮肤有无破溃及其与周围组织的关系,并共观察至种瘤后第60天,绘制移植瘤生长曲线。
2 结 果
2.1 两种方式种植的移植瘤大体观 各组裸鼠接种移植瘤后生长情况良好,成瘤率均达100%,瘤块种植的移植瘤生长速度较细胞悬液种植快,细胞悬液组在种瘤后12 d左右成瘤(图1)。从外观来看,移植瘤突出于裸鼠背部皮肤,皮下血管走行清晰可见,牵拉皮肤时可见瘤体随皮肤移动,细胞悬液种植组的移植瘤形态一般呈圆形或椭圆形(图2A),而瘤块种植的移植瘤形态各异(图2B)。颈椎脱臼法处死裸鼠后,分离移植瘤发现瘤体均有完整的包膜,剖面观移植瘤组织呈鱼肉状,在瘤体长径约10 mm时,发现细胞悬液组移植瘤中央可见微小白点状的坏死灶,瘤块组移植瘤中央可见大范围黏液状坏死灶,坏死灶长径范围约3~5 mm。
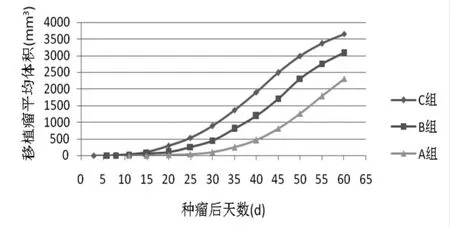
图1 不同浓度细胞悬液种植的前列腺癌皮下移植瘤生长曲线

图2 两种不同的种植方法种植的皮下移植瘤大体观
2.2 病理学观察 细胞悬液组和瘤块组所种植的移植瘤经HE染色后在光镜下观察并无明显差异,低倍镜下可见肿瘤组织内肿瘤细胞排列紊乱,呈弥漫分布状,间质成分较少,而且肿瘤组织与间质组织之间没有明显的分界(图3A);高倍镜下可见肿瘤细胞形态大小相一致,呈圆形或者椭圆形,排列为单层,细胞核体积增大,形态不规则,染色深浅不一,核质比较大,其内可见巨核细胞,核大深染(图3B)。
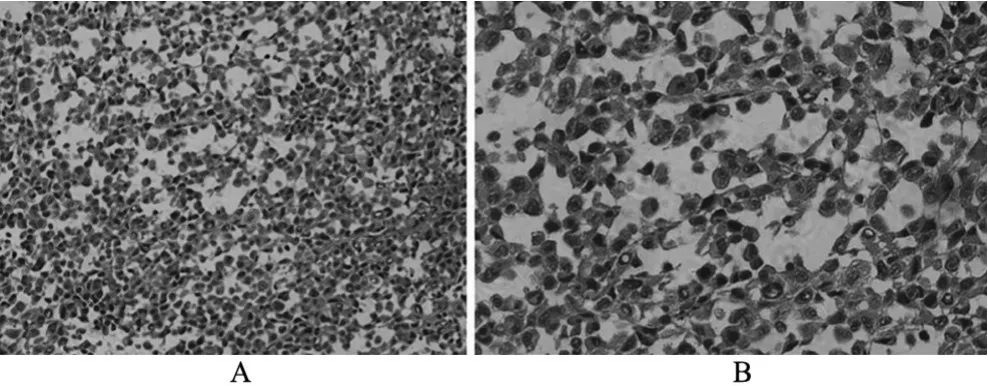
图3 前列腺癌皮下移植瘤常规病理学检查(HE染色)
2.3 不同浓度细胞悬液种植的移植瘤成瘤时间及生长情况 各组裸鼠均可成瘤,其中C组在种植后3 d即可观察到皮下移植瘤的生长,直径约0.5~1 mm,B组在一周左右可见,A组在12 d左右可见。不同浓度细胞成瘤的区别主要在于成瘤潜伏期,一旦成瘤后,其生长速度差异无统计学意义,而且移植瘤的生长呈慢-快-慢的生长模式,其生长曲线见图1。
3 讨论
研究表明[4],多数人类肿瘤可在免疫缺陷小鼠体内生长,其为活体内研究人类肿瘤生长特性及观察药物或基因等治疗效果提供了一个理想的动物模型。前列腺癌动物模型主要分4类[5]:⑴自发和诱发前列腺癌模型;⑵异种移植模型;⑶转基因小鼠模型;⑷基因敲除动物模型。每种模型各具优缺点,其中异种移植模型在目前的研究中应用较多,异种移植模型又分为原位移植和皮下移植两种模型,由于原位移植对技术要求较高,目前多用于前列腺癌转移的研究[6],而皮下移植瘤已广泛应用于前列腺癌的药物、基因以及物理方法等多种治疗措施的研究[7-8]。
有文献报道[9-10],不同的种植方法其瘤体生长速度不同,本研究中对细胞种植和瘤块种植裸鼠皮下移植瘤进行比较,发现瘤块种植的皮下移植瘤其生长速度较细胞快,考虑原因有以下两点:⑴瘤块具有肿瘤生长所必需的间质细胞及三维空间结构,间质细胞可通过旁分泌方式释放出VEGF及其他肽类细胞因子等促进肿瘤细胞的生长、侵袭及转移[11];⑵细胞成瘤存在一个成瘤潜伏期,而瘤块成瘤则跳过了这个阶段。但是瘤块种植的移植瘤形态各异(图2B),大小不等,可能与种植时所采用的瘤块形态大小有关,因此瘤块成瘤不适合于对瘤体一致性要求较高的实验,而细胞成瘤较为均匀,多呈圆形或椭圆形(图2A),有利于观察药物、基因及物理方法等多种治疗措施的治疗效果。同时本实验中还发现在瘤体体积相似时,瘤块组较细胞悬液组发生中心性坏死范围大,坏死发生早,究其原因可能是瘤块与裸鼠所建立的血管连接不足以维持整个细胞团块生长至移植瘤的形成所致[10],因瘤块周边较容易与裸鼠建立血管网络,及时提供移植瘤生长所需要的生长因子等成分,而中心不易与裸鼠建立类似的血管网络,较早发生中心性坏死;瘤块内部一旦发生坏死后,坏死组织周围新生血管容易形成血管盲端,由于长期瘀血导致周围组织发生淤血性坏死,形成恶性循环,所以瘤块成瘤所形成的坏死灶的面积较大。与之相比,细胞种植的移植瘤是逐渐形成新的血管系统,直至瘤体较大时血供不足以维持整个瘤体生长时才逐渐坏死。因此本实验研究结果提示采用细胞悬液种植的裸鼠前列腺癌皮下移植瘤实验的最佳瘤体直径约10 mm左右为宜,而瘤块种植的移植瘤则需更小即开始实验。
以往的研究多采用浓度为5×107/ml的细胞悬液种植前列腺癌皮下移植瘤,成瘤时间约为两周左右[12],成瘤较慢,我们设想增加细胞浓度是否能加速其成瘤速度,因此本实验中分别采用5×107/ml、1×108/ml、2×108/ml的三种细胞浓度将前列腺癌PC-3细胞接种于裸鼠背部皮下,结果发现随着细胞浓度增高其成瘤潜伏期明显缩短,一旦成瘤后,其生长速度无明显差异。因裸鼠本身寿命较短,而且随着肿瘤的生长,裸鼠逐渐出现萎靡、消瘦等恶病质表现,从而影响移植瘤的生长及实验结果,因此采用较高浓度(2×108/ml)的细胞悬液种植皮下移植瘤,可以明显缩短瘤体生长时间,保证裸鼠的生存质量,从而可以为实验研究提供一个更为理想的动物模型。肿瘤的生长分为血管前期和血管期[13],在移植瘤尚未形成血管时,其生长主要是依靠裸鼠皮下血管的弥散作用从组织间液获得营养,生长较慢,而移植瘤建立血供后,新生的血管网为移植瘤提供大量的营养从而使移植瘤体积迅速增大,当移植瘤体积较大时,其内部由于血供不足而发生坏死,从而使移植瘤的生长速度逐渐减慢,因此移植瘤的生长呈慢-快-慢的生长模式。
虽然瘤块种植组皮下移植瘤成瘤较细胞悬液组稍快,但是瘤块成瘤形态不规则,较早发生中心性坏死,而且增加细胞浓度可以有效的提高成瘤速度,因此采用细胞悬液种植前列腺癌皮下移植瘤是一种较好的选择。加之细胞悬液种植皮下移植瘤具有多种优点,其操作过程中无需对裸鼠进行特殊处理、无需他人协助、无需麻醉及操作过程中无出血等优点,可以大大降低移植瘤种植的难度,同时避免了手术移植易致动物感染死亡等缺点,提高了皮下移植瘤的成功率。
综上所述,高浓度细胞悬液种植裸鼠前列腺癌皮下移植瘤能够有效的缩短其成瘤潜伏期、瘤体大小形态较为均匀一致,而且具有操作简便、成瘤率高及对裸鼠损伤小等优势。因此采用高浓度PC-3细胞悬液种植裸鼠人前列腺癌皮下移植瘤可为前列腺癌基础研究提供一种较为理想的动物模型。
[1]Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[2]Siegel R,Naishadham D,Jemal A.Cancer statistics,2012[J].CA Cancer J Clin,2012,62(1):10-29.
[3]Feng S,Agoulnik IU,Truong A,et al.Suppression of relaxin receptor RXFP1 decreases prostate cancer growth and metastasis[J].Endocr Relat Cancer,2010,17(4):1021-1033.
[4]Jäger W,Moskalev I,Janssen C,et al.Ultrasound-guided intramural inoculation of orthotopic bladder cancer xenografts:a novel high-precision approach[J].PLoS One,2013,8(3):e59536.
[5]萧云备,张晓威,牛屹东,等.前列腺癌动物模型[J].实验动物学, 2010,27(6):55-58.
[6]Naiki T,Asamoto M,Toyoda-Hokaiwado N,et al.Organ specific Gst-pi expression of the metastatic androgen independent prostate cancer cells in nude mice[J].Prostate,2012,72(5):533-541.
[7]Shen ZY,Shen E,Zhang JZ,et al.Effects of low-frequency ultrasound and microbubbles on angiogenesis-associated proteins in subcutaneous tumors of nude mice[J].Oncol Rep,2013,30(2): 842-850.
[8]王晓路,刘桂珍,黄立嵩,等.5-氮杂-2'-脱氧胞苷对人前列腺癌裸鼠移植瘤生长及雄激素受体表达影响的研究[J].实用癌症杂志,2012,27(1):4-8.
[9]Guo CY,Wang XF,Xu KX,et al.Inhibitory effect of doxazosin on the growth of transplanted tumor of prostate cancer cell PC-3 in nude mice[J].Beijing Da Xue Xue Bao,2005,37(3):273-277.
[10]Gray DR,Huss WJ,Yau JM,et al.Short-term human prostate primary xenografts:an in vivo model of human prostate cancer vasculature and angiogenesis[J].Cancer Res,2004,64(5):1712-1721.
[11]Wang Y,Revelo MP,Sudilovsky D,et al.Development and characterization of efficient xenograft models for benign and malignant human prostate tissue[J].Prostate,2005,64(2):149-159.
[12]Tsuji T,Du W,Nishioka T,et al.Phellinus linteus extract sensitizes advanced prostate cancer cells to apoptosis in athymic nude mice [J].PLoS One,2010,5(3):e9885.
[13]耿 良,花宝金.肿瘤血管生成机制研究进展[J].国际肿瘤学杂志,2012,39(7):492-497.
读者·作者·编者
标准医学名词表(待续)
(本表以全国自然科学名词审定委员会公布的《医学名词》为据)
Comparison of subcutaneously xenografts model of human prostate cancer in nude mice established by cell suspension and tumor tissue.
NAN Shu-liang,SHEN E,LIN Yan-duan,BAI Wen-kun,WANG Yu,HU Bing.
Department of Ultrasound in Medicine,the Sixth People's Hospital Affiliated to Shanghai Jiao Tong University,Shanghai Institute of Ultrasound in Medicine,Shanghai 200233,CHINA
Objective To compare the different method of transplanting subcutaneously transplanted tumor in nude mice.MethodsXenograft models of human PC-3 prostate cancer in nude mice with cell suspension of different concentrations and tumor tissue were established,respectively.Then the time of tumor formation,take rates, morphological features and central tumor necrosis werecompared between the two groups.Meanwhile the histopathological features of transplanted tumor were examined,the tumor volume were measured,and the growth curve was drawn.ResultsNo significant differences were observed in take rates in tumors established from the two types of implants.The xenograft of tumor tissue group formed in an earlier time,but the shape was irregular and central necrosis occured more easily.Though the xenograft of cell suspension group formed later than tumor tissue group,the shape was regular and central necrosis occurred late.There were no significant differences in the pathological features between the two groups.With the increase of concentrations of cells,the time of tumor formation was significantly shortened.ConclusionHigh concentration cell suspension is an ideal method to implant subcutaneously transplanted tumor of prostate cancer in nude mice.
Nude mice;Subcutaneously xenograft;PC-3 human prostate cancer cells;Tumor tissue
R-332
A
1003—6350(2014)02—0157—04
2013-08-18)
10.3969/j.issn.1003-6350.2014.02.0061
国家自然科学基金(编号:81271597,81270208)
胡 兵。E-mail:binghuzz@263.com
