化学蓄热材料的开发与应用研究进展
2014-07-01杨希贤漥田光宏何兆红小林敬幸邓立生黄宏宇
杨希贤,漥田光宏,2,何兆红,小林敬幸,2,邓立生,黄宏宇†
(1. 中国科学院广州能源研究所,中国科学院可再生能源重点实验室,广州 510640;2. 日本名古屋大学,名古屋 4648603)
化学蓄热材料的开发与应用研究进展
杨希贤1,漥田光宏1,2,何兆红1,小林敬幸1,2,邓立生1,黄宏宇1†
(1. 中国科学院广州能源研究所,中国科学院可再生能源重点实验室,广州 510640;2. 日本名古屋大学,名古屋 4648603)
作为化学能与热能相互转换的核心技术,化学反应蓄热是21世纪最为重要的储能技术之一。与传统的潜热储能方式相比较而言,化学反应蓄热的能量储存密度有着数量级的提升,其在工作温度范围以及材料稳定性上的优势显著。本文针对金属氢氧化物、金属氢化物、金属碳酸盐、结晶水合物、金属盐氨合物等几种当前主要的化学蓄热材料,重点阐述了各自的应用机制和工作条件,分析了各种材料的研究现状和亟需解决的科学及应用问题,指出复合以及掺杂型材料的优化制备是化学蓄热技术未来发展的主要方向。
储能技术;化学蓄热;复合材料;反应机理
0 前 言
能量储存是解决能量供求的时间和空间匹配矛盾的有效手段,在能源危机及环境污染日益严重的今天,发展这项提高能源利用效率和保护环境的应用技术愈发紧迫。在热能储存的领域内,国内外传统的研究方向是潜热储存[1,2],但是其材料相变时出现过冷现象[3]、放热循环后相分离[4]、材料的稳定性[5]等问题始终没有得到有效解决。作为化学能与热能相互转换的核心技术,化学反应蓄热是利用化学变化中吸收、放出热量进行热能储存,是21世纪最为重要的储能技术之一。
与传统的潜热储能方式相比较,化学反应蓄热的能量储存密度有数量级的提升[6],其化学反应过程没有材料物理相变存在的问题,该体系通过催化剂或产物分离方法极易用于长期能量储存。然而,目前化学蓄热系统在国内尚未实现市场化,制约其商业化的关键问题之一是安全系数低。国外基于商用的化学储能反应通常在较高的温度条件下进行,同时会有氢气[7]这类易燃物质参与,这显然增加了化学蓄热系统整体的风险指数,技术问题的复杂化导致一次性投资过大。同时,化学蓄热材料在反应器中的传质传热效率[8]需要进一步提高,从而优化系统的整体效率。因此,寻求安全且高效的化学蓄热技术是推动我国化学储能商业化的核心问题,其广泛的应用前景对国民经济和环保事业发展具有重大的科学意义。近年来学术界围绕着该领域进行了一系列有益的探索,目前化学蓄热体系的科研工作主要集中在欧洲以及日本等,而国内对于吸附式制冷[9]以及建筑节能[10]方面的应用研究重点则在相变储能领域,对该新兴学科的应用基础研究工作相对滞后。化学蓄热材料作为化学储能的核心技术之一,主要可以分为金属氢氧化物、金属氢化物、金属碳酸盐、结晶水合物、金属盐氨合物等。本文就国内外学术界和工业界对化学储能材料的研究,分以下几个方面进行介绍和讨论。
1 金属氢氧化物的高温化学蓄热
在高温化学储能领域,关于无机氢氧化物的研究主要集中在Ca(OH)2和Mg(OH)2上(其储热机理见式(1))。西安建筑科技大学的闫秋会等[11]利用HSC模拟软件对几种金属氢氧化物反应条件下的热力学参数进行了分析,发现Ca(OH)2非常适用于大规模的太阳能储存装置。德国宇航中心报道了关于 Ca(OH)2蓄热反应动力学[12]以及构建反应器[13]方面的最新研究成果,该金属氢氧化物在反应稳定性以及蓄热性能方面表现比较突出。然而 Ca(OH)2构建的反应体系依然存在不少缺陷,尽管可以通过优化反应器改善原本较低的水渗透率[14],但反应过程中的颗粒团聚问题[15]依然困扰着该领域的科研工作者。Mg(OH)2在反应稳定性上的表现远不如Ca(OH)2[16],日本东京工业大学的Ishitobi等尝试通过添加LiCl[17]改善基于Mg(OH)2的蓄热反应体系,尽管在储能密度上有所提升,但是多次循环后其反应性能依然下降明显[18]。

基于理解蓄热反应机理在进一步设计复合材料、优化反应性能方面的重要意义,Ishitobi等[19]尝试对 LiCl/Mg(OH)2的水解-水合可逆反应机制进行探索,他认为该复合材料的水解反应分为两步并且构建了Mg(OH)2摩尔含量与两步反应速率之间的关系。然而,对于放热反应的研究,其简单地认为红外表征的数据差异是由于LiCl修饰造成的,并没有提及水合反应的关键控制步骤。Kato等[20]最新的研究表明,LiBr在三元复合材料 Mg(OH)2/膨胀石墨/LiBr的水合反应过程中扮演着催化剂的角色,从而降低了反应的活化能。类似于这种三元化学蓄热复合材料,Mg(OH)2/膨胀石墨/CaCl2[21]在化学热泵中也有所应用,研究者认为碳载体的作用在于提高传热效率以及反应稳定性,而 CaCl2对水的高吸附性则是复合材料水合速率提高的根本原因。然而上述研究仅仅就吸湿材料和活性组分的混合比例、水合反应的温度和压强等因素对复合材料宏观水合速率的影响进行了探索,水分子在复合材料上的演变历程缺乏直接的实验证据。总的来说,较高的反应温度(550 K~800 K)使得无机氢氧化物的腐蚀性问题更加突出,并且该体系传质传热效率普遍较低,这极大影响了其实际储能应用效果,需要在反应器设计以及复合蓄热材料制备的基础上进一步优化。
2 金属氢化物的高温化学蓄热
金属氢化物的蓄热原理是利用金属的吸氢性能,其在适当的温度和压力下与氢反应生成金属氢化物,同时放出大量的热能(其储热机理见式(2))。贮氢材料具备储能密度高、清洁无污染等优点,其在多次反应循环后依然能保持良好的稳定性[22]。氢气在化学蓄热反应中扮演的角色仅为工作介质,然而氢气是未来氢燃料经济的主要能源载体,金属氢化物在以后的能源系统中可以充当热力、电力生产与能量存储的枢纽。
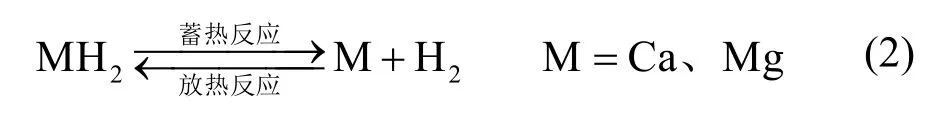
早在 20世纪 90年代,许多学者[23,24]已经对MgH2这一化学蓄热材料开展了研究,MgH2/Mg在热化学反应温度范围内可以直接产生过热蒸汽[25]。14.5 kg的Mg可以产生3.6 × 104kJ的热能,加上Mg是一种相对廉价且易得的金属,因此在商用的化学蓄热领域受到了青睐,目前以 MgH2为基的化学蓄热体系在西班牙[7]的太阳能发电应用已经趋近成熟。国内学者在这方面的研究工作主要集中在理论计算方面,西安交通大学的张早校教授[26]用CFD–Taguchi方法对基于金属氢化物的蓄热反应器进行了优化设计,上海交通大学的赵长颖教授[27]对基于 MgH2的热化学蓄热体系进行了系统的数值分析,获得了反应器内的优化参数。
由于以 MgH2为基的化学蓄热体系应用研究较为深入,在此基础上有学者尝试通过制备合金氢化物、添加过渡金属(Ni、Ti)以及过渡金属氧化物以提升反应动力学速率。澳大利亚科庭大学的Sheppard[28]利用MgNa合金替代Mg单质的方式进一步调控其反应平衡温度以及压强,MgNaH3的分解反应主要可以分成两步:第一步分解反应生成NaH、Mg以及H2;第二步则是NaH进一步分解,上述两步反应所释放的热量比例为2∶1。值得一提的是,在第一步的分解反应中,MgNaH3的反应焓较MgH2有了15%的提升。德国马普协会煤化所的Borislav等[29]发现Mg2FeH6在与MgH2同等温度条件下实现了较低平衡压力的化学蓄热,而且在超过50次反应循环后的稳定性表现非常优异,一步脱氢吸热反应后生成的产物为金属单质 Mg和 Fe。而Mg2NiH4[30]在脱氢反应后生成的产物形式是合金Mg2Ni,其可以适用于较之前的金属氢化物更低的平衡反应温度,储能密度在数千次蓄放热循环后并没有显著降低。
CaH2是一种蓄放热温度在1 175 K以上的金属氢化物,其反应焓达到MgH2的两倍以上,因此CaH2在聚光式太阳能化学蓄热方面有着广阔的应用前景。澳大利亚的EMC公司[22]利用基于CaH2的高温化学蓄热体系进行聚光式的太阳能发电,该热电联产系统的斯特林发电机持续输出功率为100 kW,反应过程中释放的氢气则是在常温条件下以钛铁氢化物的形式进行储存。然而金属氢化物主要适用于较高的温度范围(550 K~1 200 K)且反应有氢气的参与,其安全性的问题对于投资成本的控制非常不利,因此极有必要通过掺杂型金属氢氧化物的优化制备进一步调控反应温度以及氢气压强。
3 金属碳酸盐的高温化学蓄热
关于碳酸盐材料的化学蓄热研究主要集中在CaCO3[31]上,其蓄热体系的原理与金属氢氧化物、金属氢化物的类似,气相反应物则替换为 CO2(其储热机理见式(3))。
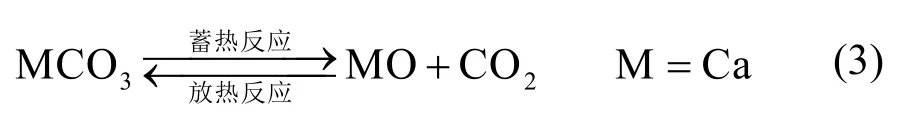
日本名古屋大学的漥田光宏等[32]对该体系蓄热过程的工作压力进行研究发现,CO2的脱附压力必须低于平衡压力的一半以获得可用的反应速率,这就对反应器的优化设计提出了更高的要求。与金属氢氧化物相比,CaCO3/CO2具有更高的分解温度和更大的储能密度,脱附的CO2必须以一个适当的方式存储,例如机械压缩等,这必然导致额外的能量损失[33]。在室温条件下,CO2所必须的液化压力在60 bar左右,因此在该压力下储存CO2可以显著降低中间储气库的体积。
基于 CaO/CO2+ PbO/CO2的复合材料化学热泵[34]在1 173 K左右进行蓄热,而放热的温度区间则提高了 100 K,热能的品位得以进一步提升。瑞典皇家理工学院的Arjmand等[35]通过基于CaO/CO2和 CaO/H2O的复合蓄热组分去调控体系的反应温度、提升该化学热泵的能量品位。然而该体系最大的弊端在于高温反应稳定性不佳,活性组分颗粒容易烧结,多次循环后性能下降明显,当CaCO3的颗粒直径大于10 μm时,其蓄放热循环将变得不完全可逆。Barker等[36]的研究表明,将CaO的颗粒直径控制在10 nm时,CaO/CO2的碳酸化则不受扩散控制,从而得以进行完全可逆的蓄放热循环反应。日本横滨国立大学的 Aihara等[37]将类似于 CaTiO3这类惰性载体引入CaO/CO2反应体系,以提高化学蓄放热循环过程的稳定性。尽管如此,关于碳酸盐化学储能的工程应用尚鲜有报道。
4 结晶水合物的低温化学蓄热
相对于其它化学蓄热材料而言,结晶水合物所具备的独特优势包括:简单的水合与水解可逆反应即可完成蓄热(其储热机理见式(4)),反应过程条件温和,在安全性上展现出极大的优势;在低温蓄热方面的应用前景广阔,反应温度通常低于423 K,大大拓展了化学储能技术的应用范围;结晶水合物易于通过填充或者负载的方式与多孔材料形成复合材料,从而优化其传热性能。
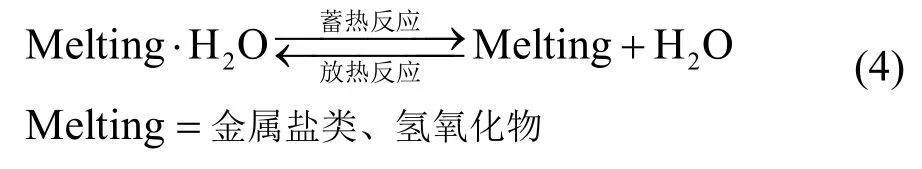
漥田光宏等[38]研究发现,在近40种结晶水合物化学蓄热反应评价中,LiOH·H2O、Ba(OH)2·8H2O和Na3PO4·12H2O具有非常高的蓄热性能,其储能密度均在1 000 kJ/kg以上,明显优于硫酸盐和硝酸盐类化合物。然而结晶水合物低温化学蓄热科学研究仍面临重大挑战,蓄热组分单体的水合反应速率普遍较慢,低下的放热效率严重制约了其工程应用。采用蓄热活性组分与吸湿材料混合的方式所形成的复合化学蓄热材料,能利用吸湿材料对水的高吸附性,使活性组分与水稳定反应。德国和日本的学者分别通过 MgCl2[39]及 CaCl2[21]吸湿材料的添加,提高了复合材料整体的水合反应速率。另外有研究表明优异的亲水性使得LiCl[40]在化学热泵中有着非常好的应用前景,该类吸湿材料与高性能蓄热活性组分混合是复合材料设计的基本理念之一。
通过多孔材料与蓄热活性组分的复合,不仅能提高比表面积以获得高反应活性的复合蓄热材料,而且由合适的载体制备具有小尺寸和特定形态的结构对传质传热效率的提高具有极为重要的意义。美国弗吉尼亚理工学院的 Balasubramanian等[41]建立了水合盐吸放热的二维非稳态数学模型,他们认为边界热流密度对蓄热时间的影响是非线性的,推荐选择导热系数与比热容较大的材料作为蓄热活性组分。法国里昂国立应用科学学院的Hongois等[42]发现MgSO4在与水蒸气反应时不能释放出所有潜在的热量,所形成的水合盐表层阻止了水与固体的进一步接触。他利用13X型分子筛改善了MgSO4的吸水传热性质,该复合材料在提升能量品位的同时能保持较高的反应稳定性。法国里昂第一大学的Whiting等[43]将MgSO4填充于Na–Y和H–Y型分子筛制成复合型的化学蓄热材料,分子筛载体的高比表面积以及大孔容积有利于水分子与活性组分充分接触,是提升其放热反应性能的关键因素。俄罗斯科学院的Ovoshchnikov等[44]就CaCl2/硅胶复合材料的水吸附行为进行了详尽的动力学研究,微孔中的扩散效应对于水合反应的促进作用非常大。多孔碳材料由于具备强亲水性、高比表面积、优异的热学以及机械性质,因此非常适合用作载体,膨胀石墨[45]和碳纤维[46]所复合的化学蓄热材料已经在化学热泵和制冷体系中得到应用。Lee等[47]研究发现,拥有较小尺寸的CaSO4在吸附性能方面有显著提升。石墨烯是当今纳米科技领域最炙手可热的新型材料,氧化石墨烯作为载体有望在复合材料制备方面发挥其独特的优势,从而成为未来低温化学蓄热发展的方向之一。
5 氨合物的低温化学蓄热
氯盐氨合物通过与氨气之间的可逆分解/化合反应进行蓄放热(其储热机理见式(5)),其在低温(473 K以下)储能领域有着重要应用。
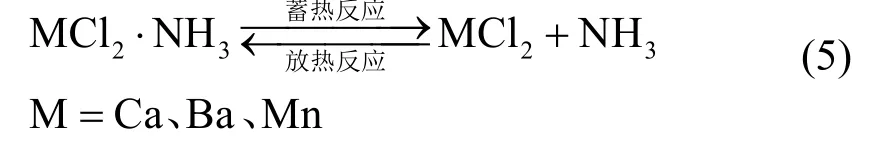
氯盐氨合反应一直以来主要应用于吸附式制冷和热泵系统[48,49],其在化学蓄热方面的系统研究尚不成熟。法国国家科研中心的 Stitou等[50]将BaCl2/NH3吸附体系用于制冷量为20 kW·h的太阳能试验工厂,所装备的平板式太阳能集热器针对的是该体系340 K左右的反应温度。上海交通大学的王如竹教授课题组对 MnCl2-CaCl2-NH3[51]以及CaCl2-NH3[52]化学吸附工作对进行了研究,将其用于高密度的热能储存以及能量品位的提升。基于MnCl2-CaCl2-NH3的目标导向型热变换器在蓄热过程中应用了减压脱附技术,理论分析的结果显示该类型的热变换器可以将 360 K的低品位能提升到444 K。基于CaCl2-NH3的双模热变换器主要应用于低温余热回收以作为理想热源。
与结晶水合物类似,基于氯盐氨合物单体的蓄热体系整体反应性能低下,许多科研工作者尝试通过氧化铝[53]、分子筛[54]等多孔材料的复合优化其传质传热系数。然而在氨气参与的蓄热反应体系中,必须考虑系统安全性以及反应物腐蚀性的问题。
6 结束语
蓄热技术将成为未来能源系统中热电生产的一个重要组成部分,化学蓄热在储能密度以及工作温度范围上的优势是其它蓄热方式无可比拟的。然而目前小规模的化学储能装置处于主导地位,化学蓄热技术在很多领域的应用还仅仅处于研究和尝试阶段。在化学蓄热材料制备这一核心技术方面,多孔载体复合以及金属掺杂型材料的优化制备是未来发展的主要方向。在完善材料合成的基础上对整体系统中迫切需要解决的机理和工程问题进行研究,将有助于推进化学储能的规模化应用,为该项环境友好的新能源技术发展提供持久的动力。
[1] Agyenim F, Hewitt N, Eames P, et al. A review ofmaterials, heat transfer and phase change problem formulation for latent heat thermal energy storage systems (lhtess)[J]. Renewable and Sustainable Energy Reviews, 2010, 14(2): 615-628.
[2] Oró E, de Gracia A, Castell A, et al. Review on phase change materials (PCMs) for cold thermal energy storage applications[J]. Applied Energy, 2012, 99(0): 513-533.
[3] Zhang S, Niu J. Experimental investigation of effects of supercooling on microencapsulated phase-change material (MPCM) slurry thermal storage capacities[J]. Solar Energy Materials and Solar Cells, 2010, 94(6): 1038-1048.
[4] Li M, Wu Z, Kao H, et al. Experimental investigation of preparation and thermal performances of paraffin/ bentonite composite phase change material[J]. Energy Conversion and Management, 2011, 52(11): 3275-3281.
[5] Li W, Song G, Tang G, et al. Morphology, structure and thermal stability of microencapsulated phase change material with copolymer shell[J]. Energy, 2011, 36(2): 785-791.
[6] Pardo P, Deydier A, Anxionnaz-Minvielle Z, et al. A review on high temperature thermochemical heat energy storage[J]. Renewable and Sustainable Energy Reviews, 2014, 32(0): 591-610.
[7] Felderhoff M, Bogdanović B. High temperature metal hydrides as heat storage materials for solar and related applications[J]. International journal of molecular sciences, 2009, 10(1): 325-344.
[8] Haije W G, Veldhuis J B J, Smeding S F, et al. Solid/vapour sorption heat transformer: Design and performance[J]. Applied Thermal Engineering, 2007, 27(8-9): 1371-1376.
[9] Yu N, Wang R Z, Wang L W. Sorption thermal storage for solar energy[J]. Progress in Energy and Combustion Science, 2013, 39(5): 489-514.
[10] Zhou D, Zhao C Y, Tian Y. Review on thermal energy storage with phase change materials (PCMs) in building applications[J]. Applied Energy, 2012, 92(0): 593-605.
[11] Yan Q, Zhang X, Zhang L. Analysis and optimization on solar energy chemical heat storage material[C]//In Proceedings of the 8th international symposium on heating, ventilation and air conditioning, Li, A, Zhu, Y; Li, Y. Eds. Springer Berlin Heidelberg: 2014, 262: 121-129.
[12] Schaube F, Koch L, Wörner A, et al. A thermodynamic and kinetic study of the de-and rehydration of Ca (OH)2at high H2O partial pressures for thermo-chemical heat storage[J]. Thermochimica Acta, 2012, 538: 9-20.
[13] Schmidt M, Szczukowski C, Roßkopf C, et al. Experimental results of a 10 kW high temperature thermochemical storage reactor based on calcium hydroxide[J]. Applied Thermal Engineering, 2014, 62(2): 553-559.
[14] Roßkopf C, Linder M, Wörner A. Optimierung der reaktionsbetteigenschaften für thermochemische energiespeicher[J]. Chemie Ingenieur Technik, 2012, 84(8): 1244-1244.
[15] Schaube F, Kohzer A, Schütz J, et al. De- and rehydration of Ca(OH)2in a reactor with direct heat transfer for thermo-chemical heat storage. Part a: Experimental results[J]. Chemical Engineering Research and Design, 2013, 91(5): 856-864.
[16] Felderhoff M, Urbanczyk R, Peil S. Thermochemical heat storage for high temperature applications–a review[J]. Green, 2013, 3(2): 113-123.
[17] Ishitobi H, Hirao N, Ryu J, et al. Evaluation of heat output densities of lithium chloride-modified magnesium hydroxide for thermochemical energy storage[J]. Industrial & Engineering Chemistry Research, 2013, 52(15): 5321-5325.
[18] Ishitobi H, Uruma K, Ryu J, et al. Durability of lithium chloride-modified magnesium hydroxide on cyclic operation for chemical heat pump[J]. Journal of Chemical Engineering of Japan, 2012, 45(1): 58-63.
[19] Ishitobi H, Uruma K, Takeuchi M, et al. Dehydration and hydration behavior of metal-salt-modified materials for chemical heat pumps[J]. Applied Thermal Engineering, 2013, 50(2): 1639-1644.
[20] Myagmarjav O, Ryu J, Kato Y. Lithium bromide-mediated reaction performance enhancement of a chemical heat-storage material for magnesium oxide/water chemical heat pumps[J]. Applied Thermal Engineering, 2014, 63(1): 170-176.
[21] Tae Kim S, Ryu J, Kato Y. Reactivity enhancement of chemical materials used in packed bed reactor of chemical heat pump[J]. Progress in Nuclear Energy, 2011, 53(7): 1027-1033.
[22] Harries D N, Paskevicius M, Sheppard D A, et al. Concentrating solar thermal heat storage using metal hydrides[J]. Proceedings of the IEEE, 2012, 100(2): 539-549.
[23] Bogdanović B, Ritter A, Spliethoff B. Active MgH2/Mg systems for reversible chemical energy storage[J]. Angewandte Chemie International Edition in English, 1990, 29(3): 223-234.
[24] Bogdanović B, Hartwig T H, Spliethoff B. The development, testing and optimization of energy storage materials based on the MgH2mg system[J]. International Journal of Hydrogen Energy, 1993, 18(7): 575-589.
[25] Bogdanović B, Ritter A, Spliethoff B, et al. A process steam generator based on the high temperature magnesium hydride/magnesium heat storage system[J]. International Journal of Hydrogen Energy, 1995, 20(10): 811-822.
[26] Bao Z, Yang F, Wu Z, et al. Optimal design of metal hydride reactors based on CFD–taguchi combined method[J]. Energy Conversion and Management, 2013, 65(0): 322-330.
[27] Shen D, Zhao C Y. Thermal analysis of exothermic process in a magnesium hydride reactor with porous metals[J]. Chemical Engineering Science, 2013, 98(0): 273-281.
[28] Sheppard D A, Paskevicius M, Buckley C E. Thermodynamics of hydrogen desorption from namgh3 and its application as a solar heat storage medium[J]. Chemistry of Materials, 2011, 23(19): 4298-4300.
[29] Bogdanović B, Reiser A, Schlichte K, et al. Thermodynamics and dynamics of the Mg–Fe–H system and its potential for thermochemical thermal energy storage[J]. Journal of Alloys and Compounds, 2002, 345(1/2): 77-89.
[30] Reiser A, Bogdanović B, Schlichte K. The application of mg-based metal-hydrides as heat energy storage systems[J]. International Journal of Hydrogen Energy, 2000, 25(5): 425-430.
[31] Schaube F, Wörner A, Tamme R. High temperature thermochemical heat storage for concentrated solar power using gas-solid reactions[J]. Journal of solarenergy engineering, 2011, 133(3): 0310061-0310067.
[32] Kubota M, Kyaw K, Watanabe F, et al. Study of decarbonation of CaCO3for high temperature thermal energy storage[J]. Journal of Chemical Engineering of Japan, 2000, 33(5): 797-800.
[33] Ervin G. Solar heat storage using chemical reactions[J]. Journal of Solid State Chemistry, 1977, 22(1): 51-61.
[34] Kato Y, Yamada M, Kanie T, et al. Calcium oxide/carbon dioxide reactivity in a packed bed reactor of a chemical heat pump for high-temperature gas reactors[J]. Nuclear Engineering and Design, 2001, 210(1/3): 1-8.
[35] Arjmand M, Liu L, Neretnieks I. Exergetic efficiency of high-temperature-lift chemical heat pump (chp) based on CaO/CO2and CaO/H2O working pairs[J]. International Journal of Energy Research, 2013, 37(9): 1122-1131.
[36] Barker R. The reactivity of calcium oxide towards carbon dioxide and its use for energy storage[J]. Journal of Applied Chemistry and Biotechnology, 1974, 24(4/5): 221-227.
[37] Aihara M, Nagai T, Matsushita J, et al. Development of porous solid reactant for thermal-energy storage and temperature upgrade using carbonation/decarbonation reaction[J]. Applied Energy, 2001, 69(3): 225-238.
[38] Kubota M, Horie N, Togari H, et al. Improvement of hydration rate of LiOH/LiOH·H2O reaction for lowtemperature thermal energy storage[C]//In 2013 Annual Meeting of Japan Society of Refrigerating and Air Conditioning Engineers, Tokai University, Japan, 2013.
[39] Posern K, Kaps C. Calorimetric studies of thermochemical heat storage materials based on mixtures of MgSO4and MgCl2[J]. Thermochimica Acta, 2010, 502(1/2): 73-76.
[40] Hamdan M A, Rossides S D, Haj Khalil R. Thermal energy storage using thermo-chemical heat pump[J]. Energy Conversion and Management, 2013, 65(0): 721-724.
[41] Balasubramanian G, Ghommem M, Hajj M R, et al. Modeling of thermochemical energy storage by salt hydrates[J]. International Journal of Heat and Mass Transfer, 2010, 53(25/26): 5700-5706.
[42] Hongois S, Kuznik F, Stevens P, et al. Development and characterisation of a new MgSO4-zeolite composite for long-term thermal energy storage[J]. Solar Energy Materials and Solar Cells, 2011, 95(7): 1831-1837.
[43] Whiting G, Grondin D, Bennici S, et al. Heats of water sorption studies on zeolite–MgSO4composites as potential thermochemical heat storage materials[J]. Solar Energy Materials and Solar Cells, 2013, 112: 112-119.
[44] Ovoshchnikov D S, Glaznev I S, Aristov Y I. Water sorption by the calcium chloride/silica gel composite: The accelerating effect of the salt solution present in the pores[J]. Kinetics and Catalysis, 2011, 52(4): 620-628.
[45] Hu J, Zheng M S, Teng H P, et al. Synthetizing the expanded graphite based Caxzny(OH)2(x+y): A nanocomposite solar chemical storage material by coprecipitation (in chinese)[J]. Chin Sci Bull, 2014, 59: 267-272.
[46] Zajaczkowski B, Królicki Z, Jeżowski A. New type of sorption composite for chemical heat pump and refrigeration systems[J]. Applied Thermal Engineering, 2010, 30(11/12): 1455-1460.
[47] Lee J-H, Ogura H. Reaction characteristics of various gypsum as chemical heat pump materials[J]. Applied Thermal Engineering, 2013, 50(2): 1557-1563.
[48] Meunier F. Solid sorption heat powered cycles for cooling and heat pumping applications[J]. Applied Thermal Engineering, 1998, 18(9): 715-729.
[49] Neveu P, Castaing J. Solid-gas chemical heat pumps: Field of application and performance of the internal heat of reaction recovery process[J]. Heat Recovery Systems and CHP, 1993, 13(3): 233-251.
[50] Stitou D, Mazet N, Mauran S. Experimental investigation of a solid/gas thermochemical storage process for solar air-conditioning[J]. Energy, 2012, 41(1): 261-270.
[51] Li T, Wang R, Kiplagat J K. A target-oriented solid-gas thermochemical sorption heat transformer for integrated energy storage and energy upgrade[J]. AIChE Journal, 2013, 59(4): 1334-1347.
[52] Li T, Wang R, Kiplagat J K, et al. Performance analysis of an integrated energy storage and energy upgrade thermochemical solid–gas sorption system for seasonal storage of solar thermal energy[J]. Energy, 2013, 50(0): 454-467.
[53] Sharonov V E, Aristov Y I. Ammonia adsorption by MgCl2, CaCl2and BaCl2confined to porous alumina: The fixed bed adsorber[J]. Reaction Kinetics and Catalysis Letters, 2005, 85(1): 183-188.
[54] Glaznev I, Ponomarenko I, Kirik S, et al. Composites CaCl2/SBA-15 for adsorptive transformation of low temperature heat: Pore size effect[J]. International Journal of Refrigeration, 2011, 34(5): 1244-1250.
Research Progress on the Development and Application of Chemical Heat Storage Materials
YANG Xi-xian1, KUBOTA Mitsuhiro1,2, HE Zhao-hong1, KOBAYASHI Noriyuki1,2, DENG Li-sheng1, HUANG Hong-yu1
(1.CAS Key Laboratory of Renewable Energy, Guangzhou Institute of Energy Conversion, Chinese Academy of Sciences, Guangzhou 510640, China; 2. Nagoya University, Nagoya 4648603, Japan)
Chemical heat storage, as the core technology of chemical energy and heat energy interconversion, is one of the most significant energy storage technologies in the 21stcentury. Compared with traditional latent heat storage, chemical heat storage has enhanced by orders of magnitude in energy storage density, and its superiority in operating temperature range as well as stability of materials is outstanding. This paper is oriented toward several primary chemical heat storage materials, such as metal hydroxide, metal hydride, metal carbonate, crystalline hydrate and metal salts ammonate. We put emphasis on elaborating the application mechanism and operating condition of each material. We also analyzed the research status as well as scientific and application problems of those materials that need to be solved urgently. We strongly believed that the main development direction of chemical heat storage technology in the future lies on the optimization and synthesis of composite materials and doped materials.
energy storage technology; chemical heat storage; composite materials; reaction mechanism
TK6;X705
A
10.3969/j.issn.2095-560X.2014.05.012
2095-560X(2014)05-0397-06
杨希贤(1986-),男,博士,助理研究员,主要从事化学蓄热材料制备研究。
漥田光宏(1973-),男,博士,助理教授,主要从事化学蓄热以及热泵技术研究。
何兆红(1980-),女,博士,副研究员,主要从事吸附式制冷以及传热学方面的研究。
小林敬幸(1965-),男,博士,副教授,主要从事化学蓄热系统以及高效吸附式热泵方面的研究。
邓立生(1985-),男,硕士,研究实习员,主要从事吸附式制冷以及传热学方面的研究。
黄宏宇(1978-),男,博士,研究员,主要从事低品位能提质高效利用方面的研究。
2014-04-16
2014-08-12
中国科学院外籍青年科学家计划(Y207Y41001)
† 通信作者:黄宏宇,E-mail:huanghy@ms.giec.ac.cn
