3种肿瘤标志物在不可测量病灶的晚期乳腺癌患者血清中的水平变化及其临床意义
2014-07-01秦柳霄梁陈昕妤廖小莉廖思娜原春玲李永强韦明景蓝肖玲朱丽君刘志辉
秦柳霄梁 嵘 陈昕妤廖小莉 廖思娜 原春玲 黎 倩 李永强 韦明景蓝肖玲朱丽君刘志辉
作者单位:530021 南宁 广西医科大学附属肿瘤医院化疗一科;1广西医科大学研究生学院;2广西医科大学第一临床医学院
临床研究
3种肿瘤标志物在不可测量病灶的晚期乳腺癌患者血清中的水平变化及其临床意义
秦柳霄1梁 嵘 陈昕妤2廖小莉 廖思娜 原春玲 黎 倩 李永强 韦明景2蓝肖玲1朱丽君1刘志辉
作者单位:530021 南宁 广西医科大学附属肿瘤医院化疗一科;1广西医科大学研究生学院;2广西医科大学第一临床医学院
目的 研究血清中CEA、CA125及CA153的水平及其变化在不可测量病灶的晚期乳腺癌患者化疗中的应用价值。方法 回顾性收集在我院化疗的不可测量病灶的晚期乳腺癌患者的临床资料及化疗前后血清中CEA、CA125及CA153的检测结果,分析3种肿瘤标志物的水平及其变化与患者生存时间的相关性。结果 纳入的81例患者中,54.32%(44/81)的患者3种肿瘤标志物处于正常水平(标志物阴性组),45.68%(37/81)的患者有1种或1种以上的标志物高于正常水平(标志物阳性组),标志物阴性组患者中位的无进展生存期(PFS)为19.0个月,显著长于标志物阳性组的9.8个月(P=0.007);两组患者的总生存期(OS)差异无统计学意义(51.9个月 vs 37.7个月,P=0.06)。化疗后任一标志物下降Ⅱ度以上者的中位PFS显著长于下降Ⅰ度者(10.2个月vs 5.2个月,P=0.008)。结论 化疗前血清中CEA、CA125及CA153升高的不可测量病灶晚期乳腺癌的无进展生存期较短,化疗后任一标志物下降Ⅱ度以上可预测该类患者无进展生存期的获益情况。
乳腺肿瘤;肿瘤标志物;无可测量病灶;CEA;CA125;CA153
乳腺癌是女性最常见的恶性肿瘤,最常见的转移部位有肺、骨和肝,其次为皮肤、胸膜和脑等,临床上有10%~40%的乳腺癌患者其转移病灶为不可测量[1],常见于骨、皮肤和胸腹膜等部位的转移灶。对不可测量病灶的转移性乳腺癌目前尚缺乏准确的疗效评估及判断预后的方法,这往往导致患者接受了无效的治疗,从而降低生活质量,甚至缩短生存时间。研究显示糖类抗原(carbohydrate antigen,CA)CA153、癌胚抗原(carcino embryonic antigen,CEA)和CA125可用于可测量病灶的晚期乳腺癌化疗的疗效评估[2],但鲜见用于不可测量病灶晚期乳腺癌的报道。本研究探讨不可测量病灶晚期乳腺癌患者化疗前血清中CEA、CA125及CA153的水平及其化疗后的变化,并分析其与患者生存时间的相关性,以期找到此类患者化疗生存获益的预测因子,从而优化治疗,改善患者生活质量及生存时间。现将结果报道如下。
1 材料与方法
1.1 资料收集
入选患者纳入标准:在我院经病理学或细胞学诊断的晚期乳腺癌;既往已行根治术及规范的术后辅助治疗,本次出现转移后首次行姑息化疗;转移灶按实体瘤疗效评估标准1.1(RECIST1.1)确定为不可测量的病灶;化疗前1周内及化疗后直至出现疾病进展前均定期检测血清中CEA、CA125及CA153的水平。
详细记录入组患者的临床病理资料及化疗前后血清中CEA、CA125及CA153的水平。随访并记录患者疾病进展时间及生存状态。
1.2 血清肿瘤标志物的检测
3种肿瘤标志物均采用电化学发光法检测。采用德国罗氏公司电化学发光法试剂盒,仪器为德国罗氏E1010电化学发光全自动免疫分析仪。肿瘤标志物正常参考值:CEA<5.2 ng/ml,CA125<35 U/ml,CA153≤30 U/ml。若检测值大于正常值上限即为阳性。肿瘤标志物水平的下降程度=(治疗前水平-治疗后最低水平)/治疗前水平×100%。化疗后肿瘤标志物水平下降程度的评判参照文献[3]:Ⅰ度为标志物水平下降≤25%;Ⅱ度为25%<标志物水平下降≤50%;Ⅲ度为50%<标志物水平下降≤75%;Ⅳ度为标志物水平下降>75%。
1.3 患者无进展生存期(PFS)及总生存期(OS)的计算
根据RECIST 1.1的标准定义不可测量病灶。PFS指自化疗开始到出现疾病进展(PD)或死亡的时间,中位PFS为经SPSS 16.0软件计算所得的PFS中位值,OS指自化疗开始到死亡的时间。PD定义为出现1个或多个新发病灶。
1.4 统计学方法
采用SPSS 16.0软件统计分析数据。两个样本均数的比较采用t检验,两个样本率的比较采用χ2检验。生存率采用Kaplan-Meier法计算,组间生存率差异采用Log-Rank检验。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
共纳入2008年1月至2013年6月期间符合入选标准的不可测量病灶的晚期乳腺癌患者81例。其中37例有1种或1种以上肿瘤标志物阳性为标志物阳性组,3种标志物均正常者44例为标志物阴性组。两组患者的一般临床资料比较差异无统计学意义(P>0.05)。见表1。
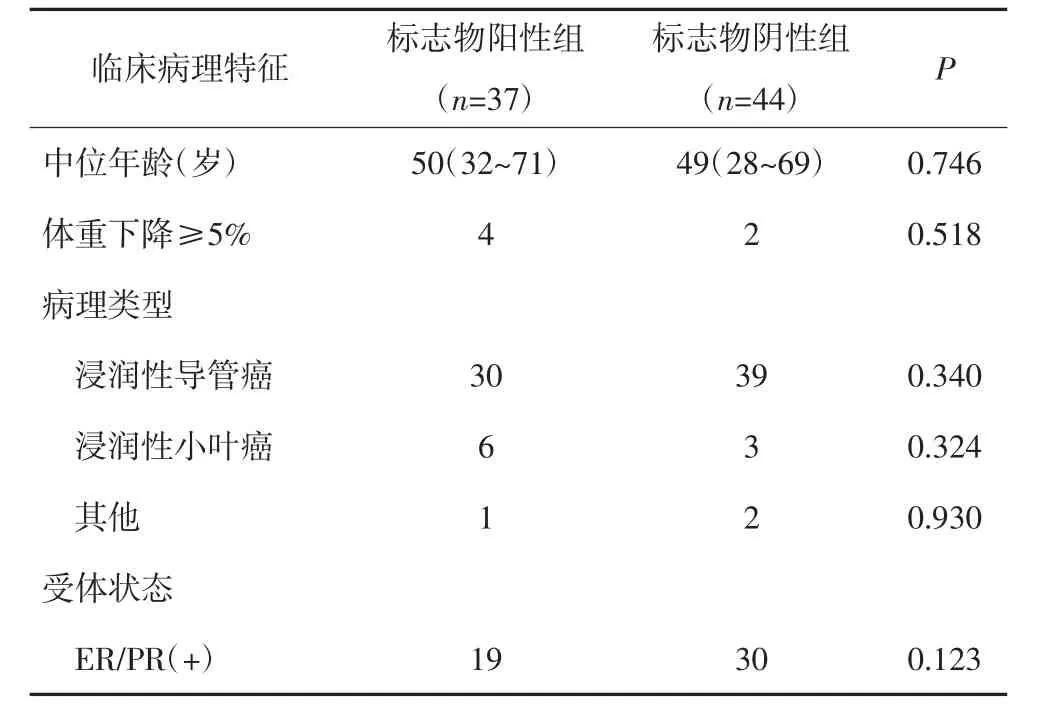
表1 81例不可测量病灶的晚期乳腺癌化疗前的临床病理特征(n)
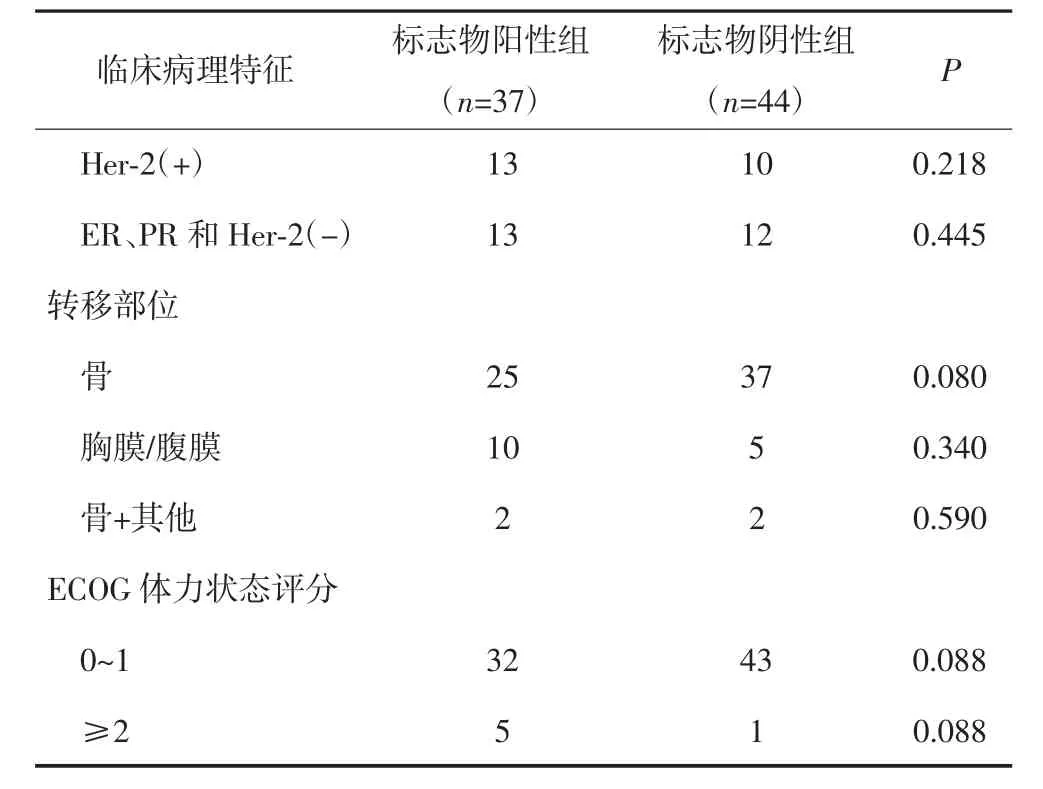
(续表)
2.2 化疗前血清肿瘤标志物的水平变化与生存期的关系
化疗前血清中CEA、CA125和CA153单项肿瘤标志物阳性率分别为12.35%(10/81)、23.46%(19/81)和34.57%(28/81),其中有1种或1种以上标志物升高者37例,阳性率为45.68%(37/81)。
全组患者随访时间截止2013年9月30日。中位随访24.8个月,69例患者疾病进展,18例死亡。1年、2年生存率分别为91.36%、83.95%。
肿瘤标志物阴性组患者的中位PFS较阳性组患者显著延长(19个月vs 9.8个月,P=0.007),其生存曲线见图1。两组患者OS的差异无统计学意义(51.9个月vs 37.7个月,P=0.06)。

图1 化疗前血清肿瘤标志物阳性组与阴性组患者的无进展生存曲线
2.3 化疗后血清肿瘤标志物的水平变化与生存期的关系
肿瘤标志物阴性组患者化疗后无标志物水平升高者,阳性组患者化疗后可见3种肿瘤标志物同时升高或下降,标志物水平下降的比率为86.49%(32/37)。其中5例患者化疗后标志物水平升高。
CEA下降的比率为60%(6/10),其中Ⅰ度、Ⅱ度和Ⅳ度下降分别为1例、3例和2例;CA125下降的比率为100%(19/19),其中Ⅰ度、Ⅲ度、Ⅳ度下降分别为4例、3例、12例;CA153下降的比率为82.14%(23/28),其中Ⅰ度、Ⅱ度、Ⅲ度、Ⅳ度下降分别为5例、6例、5例、7例。
化疗后任何一种肿瘤标志物下降者与升高者的中位PFS的差异无统计学意义(10.1个月vs 8.2个月,P=0.130)。其生存曲线见图2。但在标志物下降者中标志物下降Ⅱ~Ⅳ度者较Ⅰ度下降者其中位PFS显著延长(10.2个月vs 5.2个月,P=0.008)。
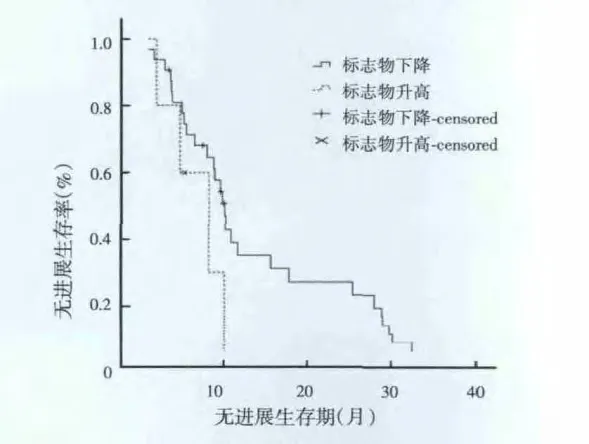
图2 化疗后血清肿瘤标志物下降与升高者的无进展生存曲线
至随访截止日,标志物阴性组患者死亡8例,标志物阳性组患者死亡10例。标志物阳性组死亡的患者中有9例化疗后标志物水平下降,其中位生存期为10.2个月,1例化疗后标志物水平升高。因死亡病例数尚少,未能对化疗后标志物下降或升高的总生存期进行比较分析。
3 讨论
目前临床上评估不可测量病灶的晚期乳腺癌患者的客观疗效较为困难,但预测其无进展生存期较为可行。血清肿瘤标志物已用于可测量病灶的晚期乳腺癌的客观疗效判断[2]。美国临床肿瘤学会乳腺癌分子标志物使用指南[4]认为对不可测量病灶的患者,治疗过程若血清中CA153或CEA升高则提示治疗失败。因缺乏足够数据,该指南未对血清肿瘤标志物在这类患者的应用价值作进一步分析和评价。本文分析不可测量病灶的晚期乳腺癌患者血清肿瘤标志物的水平及其变化与化疗后生存时间的相关性,为优化此类患者的治疗提供参考。
血清中CA153及CEA的水平在乳腺癌发展的不同阶段差异较大。早期乳腺癌二者的阳性率分别为19.6%和12.7%[5],可测量病灶的晚期乳腺癌则分别为70.0%和50.0%左右[6],但在不同的病理亚型及不同转移器官中二者的阳性率有较大差异[7]。在不可测量病灶的晚期乳腺癌,一个小样本的回顾性分析显示CA153及CEA的阳性率均达65.0%左右[8]。本组患者CEA、CA153的阳性率分别为12.35%、34.57%,说明不同临床病理特征的患者、同一患者不同的疾病状态可能具有不同的血清标志物水平。国内学者报道乳腺癌血清中CA125的阳性率为24.69%[9]。有研究[10]发现血清中CA125升高仅见于胸膜转移的乳腺癌患者。Yerushalmi等[7]发现CA153阴性的患者中有35%CEA和(或)CA125阳性。本组患者疾病较为复杂,转移部位多个,3种标志物联合检测的总阳性率为45.68%,高于单个标志物检测的阳性率,说明联合检测血清中CEA、CA125及CA153的水平对此类患者更具优势。
目前在晚期乳腺癌治疗过程中能否以血清肿瘤标志物水平的变化来判断疗效尚存在争议。对可测病灶的患者,美国临床肿瘤学会乳腺癌分子标志物使用指南[4]不推荐单独以血清肿瘤标志物水平的变化来评估客观疗效,但欧洲肿瘤标志物专家组[11]推荐每周期化疗前后检测血清中CA153的水平以判断客观疗效。对不可测量病灶的患者,各专家组[4,11]及学者[1]则认为可依据血清肿瘤标志物的水平判断疗效。Hashimoto等[8]以血清CEA和CA153建立了疗效预测的模型。结果争议在于标志物水平变化的幅度多大才与疗效相关,以及联合检测哪些标志物。本研究中治疗后患者肿瘤标志物下降与升高者其PFS未见明显差异,可能与标志物升高者的例数太少和标志物升高的幅度有关。欧洲肿瘤标志物专家组[11]认为与疾病进展相关的升高幅度定义为至少 >25%,但与PFS相关的升高幅度目前未知。多数学者将有显著意义的血清标志物水平的下降幅度定为>25%,欧洲肿瘤标志物专家组认为下降>50%才与肿瘤退缩互相一致。本研究中标志物阳性组患者化疗后任一标志物下降幅度>25%(Ⅱ~Ⅳ度)者其PFS(10.2个月)较<25%(Ⅰ度)者延长5个月,差异具有统计学意义(P<0.01)。说明联合动态监测血清中CEA、CA125和CA153的水平,并以下降幅度>25%为界对判断化疗方案的PFS有重要的参考价值。
总之,对不可测量病灶的晚期乳腺癌,应动态、联合检测血清中CEA、CA125和CA153的水平,并根据其变化幅度调整化疗方案。本研究为回顾性研究,其结果需在前瞻性的临床试验中验证。
[1] Cheung KL,Graves CR,Robertson JF.Tumour marker measurements in the diagnosis and monitoring of breast cancer[J].Cancer Treat Rev,2000,26(2):91-102.
[2] 许隽颖,刘超英,李 江,等.肿瘤标志物CEA、CA153和CA125在乳腺癌化疗疗效评估中的价值[J].放射免疫学杂志,2009,22(2):160-162.
[3] Jiang W,Freidlin B,Simon R.Biomarker-adaptive threshold design:a procedure for evaluating treatment with possible biomarker-defined subset effect[J].J Natl Cancer Inst,2007,99(13):1036-1043.
[4] Harris L,Fritsche H,Mennel R,et al.American Society of Clinical Oncology 2007 update of recommendations for the use of tumor markers in breast cancer[J].J Clin Oncol,2007,25(33):5287-5312.
[5] Molina R,Auge JM,Farrus B,et al.Prospective evaluation of carcinoembryonic antigen(CEA)and carbohydrate antigen 15.3(CA 15.3)in patients with primary locoregional breast cancer[J].Clin Chem,2010,56(7):1148-1157.
[6] Hayes DF,Zurawski VR Jr,Kufe DW.Comparison of circulating CA15-3 and carcinoembryonic antigen levels in patients with breast cancer[J].J Clin Oncol,1986,4(10):1542-1550.
[7] Yerushalmi R,Tyldesley S,Kennecke H,et al.Tumor markers in metastatic breast cancer subtypes:frequency of elevation and correlation with outcome[J].Ann Oncol,2012,23(2):338-345.
[8] Hashimoto K,Yonemori K,Katsumata N,et al.Prediction of progressive disease using tumor markers in metastatic breast cancer patients without target lesions in first-line chemotherapy[J].Ann Oncol,2010,21(11):2195-2200.
[9] 易 琳,刘兴明,林 丁,等.血清CA153、CA125、CEA联合检测在乳腺癌诊断中的价值[J].重庆医科大学学报,2012,37(9):802-805.
[10]Jager W,Kissing A,Cilaci S,et al.Is an increase in CA125in breast cancer patients an indicator of pleural metastases[J].Br J Cancer,1994,70(3):493-495.
[11] Molina R,Barak V,van Dalen A,et al.Tumor markers in breast cancer-European Group on Tumor Markers recommendations[J]. Tumour Biol,2005,26(6):281-293.
[2014-01-03收稿][2014-02-05修回][编辑 阮萃才]
Clinical significance of serum tumor marker levels(CEA,CA125,CA153)for assessing the efficacy of chemotherapy in patients with metastatic breast cancer without measurable disease
QIN Liu-xiao1,LIANG Rong,CHEN Xin-yu2,LIAO Xiao-li,LIAO Si-na,YUAN Chun-ling,LI Qian,LI Yong-qiang,WEI Ming-jing2,LAN Xiao-ling1,ZHU Li-jun1,LIU Zhi-hui(Department of Chemotherapy,Affiliated Tumor Hospital of Guangxi Medical University;1Graduate School of Guangxi Medical University;2The First Clinical Medical College of Guangxi Medical University,Nanning 530021,P.R.China)
LIU Zhi-hui.E-mail:lzhh101@sina.com
Objective To study the usefulness of changes in serum levels of the tumor markers CEA,CA125,and CA153for assessing the efficacy of chemotherapy in patients with metastatic breast cancer without measurable disease.Methods Electronic medical records were retrospectively reviewed for 81 patients with metastatic breast cancer but without measurable disease treated between January 2008 and June 2013.Serum levels of CEA,CA125,and CA153were measured with electrochemiluminescence before and after chemotherapy,and the levels were correlated with survival.Results Patients were grouped according to whether they presented normal levels of all three serum markers before chemotherapy(negative group,n=44)or they presented elevated levels of at least one marker before chemotherapy(positive group,n=37).Median progression-free survival(PFS)was significantly longer in the negative group(19 months)than in the positive group(9.8 months,P=0.007).The positive and negative groups had similar overall survival(51.9 vs 37.7 months,P=0.06).Median PFS in patients in whom at least one tumor marker declined by one degree during chemotherapy(10.2 months)was longer than that in patients in whom at least one marker declined by two degrees(5.2 months,P=0.008).ConclusionsElevated levels of serum CEA,CA125or CA153correlate with shorter PFS in metastatic breast cancer patients without measurable disease.A decline of two or more degrees in the levels of any one of these tumor markers is a significant predictor of PFS benefit.
Breast neoplasm;Tumor marker;Unmeasurable disease;CEA;CA125;CA153
R737.9
A
1674-5671(2014)01-04
10.3969/j.issn.1674-5671.2014.01.09
广西自然科学基金资助项目(2010GXNSFA 013243001)
刘志辉。E-mail:lzhh101@sina.com
