大黄素乙酰化物致鼻咽癌CNE-1细胞线粒体自噬活性的研究
2014-07-01莫媛媛侯华新黎丹戎陈云龙莫春燕王春苗
莫媛媛 侯华新 黎丹戎陈云龙 梁 燕 莫春燕 王春苗 李 竟
作者单位:530021 南宁 广西医科大学药学院;△广西肿瘤防治研究所实验研究部
基础研究
大黄素乙酰化物致鼻咽癌CNE-1细胞线粒体自噬活性的研究
莫媛媛 侯华新 黎丹戎△陈云龙 梁 燕 莫春燕 王春苗 李 竟
作者单位:530021 南宁 广西医科大学药学院;△广西肿瘤防治研究所实验研究部
目的 研究大黄素乙酰化物作用鼻咽癌CNE-1细胞后,其线粒体损伤及其与线粒体自噬的关系。方法 以5 mg·L-1及10 mg·L-1大黄素乙酰化物作用鼻咽癌CNE-1细胞,通过透射电镜观察大黄素乙酰化物导致鼻咽癌CNE-1细胞自噬体形成的超微结构;激光共聚焦显微镜测定线粒体膜电位、细胞内钙离子、细胞内活性氧的浓度变化及线粒体自噬的活性。结果 与空白对照组比较,两个实验组细胞都出现线粒体损伤以及线粒体自噬体。大黄素乙酰化物作用后的细胞线粒体膜电位降低(P<0.05);细胞内游离的钙离子浓度升高(P<0.05);细胞内活性氧增加(P<0.05),且呈剂量依赖性。经线粒体与溶酶体示踪分析,可见大黄素乙酰化物作用的实验组均出现酸性溶酶体增殖,其中包含线粒体探针标记的线粒体碎片等典型的自噬特征,且增加的趋势呈剂量效应关系。结论 大黄素乙酰化物可致鼻咽癌CNE-1细胞线粒体损伤,并与线粒体自噬密切相关。
鼻咽肿瘤;大黄素乙酰化物;线粒体自噬;透射电镜;激光共聚焦显微镜
癌细胞往往存在凋亡逃逸的现象,导致以促凋亡为基础的治疗疗效低下,而诱导凋亡缺陷的细胞自噬死亡是减少抗癌药物耐受性以及提高化疗敏感性的一种高效的方式[1,2]。本课题组前期以大黄素为基本结构,化学合成了大黄素乙酰化物,在细胞实验中发现该化合物可聚集在鼻咽癌CNE-1细胞的线粒体上,无细胞毒作用的大黄素乙酰化物(10 mg·L-1)对鼻咽癌CNE-1细胞具有放射增敏活性,并伴随线粒体的损伤[3]。为进一步研究大黄素乙酰化物对鼻咽癌细胞线粒体损伤的机制及线粒体损伤与自噬的关系,本文通过激光扫描共聚焦显微镜和电镜技术,观察大黄素乙酰化物导致鼻咽癌CNE-1细胞自噬体形成的超微结构,测定自噬过程中线粒体跨膜电位、细胞内钙离子、细胞内活性氧的浓度等变化,探讨大黄素乙酰化物作为自噬诱导剂的可能性。
1 材料
1.1 细胞株
鼻咽癌CNE-1细胞株由广西肿瘤防治研究所传代保存。细胞于37℃、5%CO2培养箱内,以10%小牛血清的RPMI-1640培养液在培养瓶内单层传代培养。
1.2 试剂
大黄素乙酰化物由本课题组以大黄素为基本结构化学合成,其结构为1,8-二羟基-3-乙酰基-6-甲基-9,10蒽醌,并经红外光谱(IR)、核磁共振氢谱(1HNMR)及碳谱(13C-NMR)进行结构确证[3]。活性氧检测试剂盒购自上海碧云天公司。Fluo-3/AM购自美国Sigma公司。溶酶体探针lyso-Tracker Red和线粒体探针Mito Tracker Green为美国LIFE公司产品。
1.3 仪器
激光共聚焦显微镜为日本Nikon公司,型号为A1,透射电镜为日本日立公司,型号为H7650。
2 实验方法
2.1 实验分组
空白对照组,不做任何处理;低浓度大黄素乙酰化物(5 mg·L-1)实验组;高浓度大黄素乙酰化物(10 mg·L-1)实验组。两个实验组所用的药物浓度均无细胞毒性,各组细胞经药物孵育作用1 h后,弃去含药的培养基,再经正常培养基培养1 h后进行后续实验。
2.2 细胞超微结构的观察
对各实验组经处理后的细胞进行消化、离心、收集,以3%戊二醛、1%锇酸双重固定,丙酮逐级脱水、苯二甲酸二丙烯酯包埋,超薄切片。用透射电镜观察和摄图。
2.3 细胞内钙离子浓度的测定
各组细胞经不同处理后,以PBS清洗细胞,加入10 μmol·L-1的Fluo-3/AM探针,避光、37℃孵育1 h,用无钙缓冲液反复洗涤3次后,将细胞保存于无钙缓冲液中并在激光扫描共聚焦显微镜下观察和摄图。每个样本重复实验3次。
2.4 细胞线粒体膜电位的测定
各组细胞经不同处理后,以PBS清洗细胞,加入1 ml(5 μg·ml-1)的Rhodamine 123,避光、37℃孵育30 min,以PBS洗涤3次,将细胞在激光扫描共聚焦显微镜下观察和摄图。每个样本重复实验3次。
2.5 细胞内活性氧的测定
各组细胞经不同处理后,以PBS清洗细胞,加入1∶1 000的DCFH-DA探针,避光、37℃孵育20 min,以无血清1640培养基洗涤3次后,用激光共聚焦显微镜扫描和摄图。每个样本重复实验3次。
2.6 线粒体与溶酶体探针示踪分析
各组细胞经不同处理后,以PBS清洗细胞,加入37℃预热的0.5 μmol·L-1线粒体探针Mito-Tracker Green,20 min后撤去探针,再加入0.5 μmol·L-1溶酶体探针lyso-Tracker Red 20 min后,将细胞置于激光共聚焦显微镜下分析检测溶酶体对线粒体的吞噬活性。
2.7 统计学分析
细胞线粒体膜电位、细胞内活性氧、细胞内钙离子浓度通过NIS-element AR软件进行统计分析。所有数据以均数±标准差(s)表示,采用SPSS 16.0统计软件的方差分析进行差异显著性检验。P<0.05为差异有统计学意义。
3 结果
3.1 自噬线粒体的超微结构
如图1所示,空白对照组线粒体未见有明显损伤,细胞器结构完整,基本没有自噬线粒体的形成;低浓度(5 mg·L-1)实验组线粒体有些肿胀,未见脊断裂,但空泡明显增多,有少量自噬线粒体出现;高浓度(10 mg·L-1)实验组的大部分线粒体出现脊融合或者消失,线粒体肿胀、空泡明显,有些双层膜已消失,出现大量的自噬线粒体(如箭头所示)。

图1 透射电镜下观察各组细胞的超微结构注:A、D.空白对照组细胞;B、E.低浓度实验组细胞;C、F.高浓度实验组细胞。
3.2 细胞线粒体跨膜电位
经大黄素乙酰化物作用CNE-1细胞后,空白对照组荧光强度为40.58±3.56,其线粒体膜电位(ΔΨm)最高,而实验组荧光强度减弱,分别为32.09±1.61和22.42±1.23,表明其线粒体跨膜电位下降,且呈剂量依赖性(F=44.143,P=0.000)。见图2。
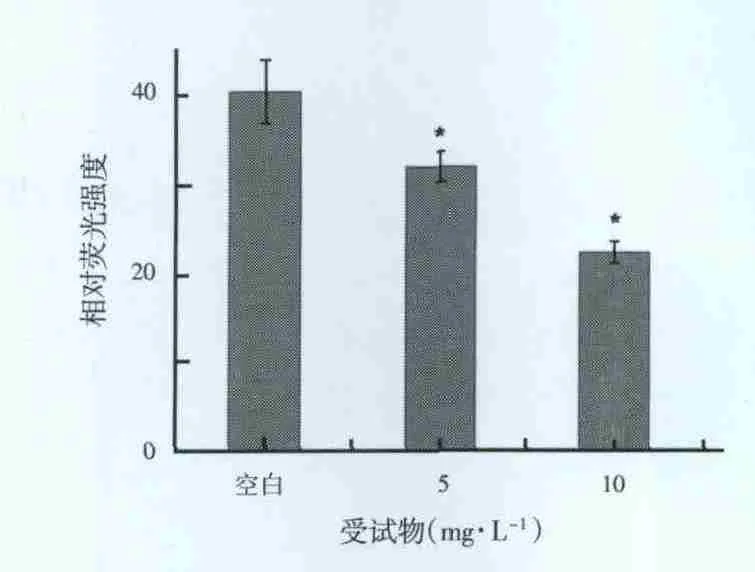
图2 各组细胞线粒体跨膜电位的变化注:*与空白对照组比较,P<0.05。
3.3 细胞内钙离子浓度
实验结果表明,空白对照组细胞内游离的钙离子浓度最低为(1 166.04±77.43),而经大黄素乙酰化物作用CNE-1细胞后,细胞中游离的钙离子浓度随着药物浓度的增加而显著升高(5 mg·L-1组为1 388.16±48.63;10 mg·L-1组为1 427.15±54.55),与空白对照组比较差异均有统计学意义(F=15.75,P=0.004)。见图3。

图3 各组细胞内游离钙离子浓度的变化注:*与空白对照组比较,P<0.05。
3.4 细胞内活性氧浓度
如图4所示,细胞内活性氧的浓度随着大黄素乙酰化物的浓度增加而升高。空白对照组细胞荧光强度值为816.84±53.92,5 mg·L-1和10 mg·L-1药物实验组的荧光强度值分别为1 027.47±34.05和1 472.66±110.68(F=61.835,P=0.000)。
3.5 线粒体探针与溶酶体探针示踪分析
对鼻咽癌细胞的线粒体和酸性溶酶体同时采用线粒体探针Mito-Tracker Green(MTG)和溶酶体探针Lyso-Tracker Red(LTR)染色,在激光共聚焦显微镜下观察去极化的线粒体是否与溶酶体融合,即是否发生了线粒体自噬,检测细胞线粒体的自噬活性。激光共聚焦显微镜下观察显示细胞线粒体及溶酶体的形态,红色为溶酶体探针标记的信号;绿色为线粒体探针标记的信号。合并的图片中黄色区域显示线粒体与溶酶体的共定位。如图5所示,空白对照组线粒体丰富,显影清晰,呈棒状或短棒状交织连接而成网状结构,溶酶体数量较少。经大黄素乙酰化物作用后,细胞的线粒体随着药物浓度的增加其形状改变为点状或粒状,与线粒体探针的结合信号减弱,而溶酶体与探针的结合信号随着药物剂量的增加而增强,且包含的线粒体碎片的溶酶体数量增多(黄色区域)。

图5 大黄素乙酰化物作用CNE-1细胞后线粒体的自噬活性注:A.空白对照组;B.5 mg·L-1实验组;C.10 mg·L-1实验组。
4 讨论
线粒体是细胞生命活动最主要的能量供应场所,在其发挥生物效应过程中为应对细胞环境的变化而引起线粒体的损伤,从而产生线粒体自噬。线粒体自噬一般分为4个时期:①线粒体受损后其通透性转变,线粒体去极化[4];②形成线粒体自噬体[5];③形成成熟的线粒体自噬溶酶体[6];④线粒体被溶酶体降解。研究表明,自噬是一把双刃剑,在肿瘤微环境中,自噬既能在不利的环境中提高肿瘤细胞对应激的耐受能力,维持其生存;另一方面,过度线粒体自噬可以导致细胞自噬性死亡[7]。因此,研究和开发自噬诱导剂,促使抗凋亡的肿瘤细胞或缺乏凋亡机制的肿瘤细胞发生自噬性死亡,是提高肿瘤化疗敏感性的一个新方向[8]。
电子显微镜可以观测到细胞内各种细胞器的超微结构,是目前检测自噬过程自噬体形成的金标准[9],但该法由于耗时长且存在较强的主观性,有时候还要借助一些示踪剂来对自噬体进行显影。本研究选择线粒体及溶酶体两种探针进行染色,LTR探针主要用于标记和追踪活细胞中的酸性细胞器,对酸性细胞器如溶酶体具有高选择性,染色后产生红色荧光[10]。MTG探针的细胞通透性好,与细胞简单孵育后能被动地渗透质膜,与活性的线粒体结合发射绿色荧光。在激光共聚焦显微镜下实现对两种细胞器已融合或者受损严重看不清轮廓的细胞器进行共定位。同时还可动态示踪自噬体的形成和对细胞器自噬程度进行半定量分析。本研究以电镜和激光共聚焦显微镜观察到大黄素乙酰化物可以选择性地损伤线粒体,诱导细胞内线粒体自噬体的产生。
已有大量文献报道,细胞内钙离子浓度的增加[11]、活性氧的升高[12]以及膜电位的下降[13]与线粒体损伤有关,是促发自噬的关键因素。本课题组前期发现具有蒽醌母核结构的大黄素乙酰化物,是一种生物还原性物质,易聚集在乏氧的肿瘤细胞线粒体上,导致线粒体脊肿胀、空泡化。本研究发现大黄素乙酰化物作用CNE-1细胞后细胞内钙离子浓度显著升高,细胞内活性氧浓度亦增加,而细胞线粒体跨膜电位下降。提示大黄素乙酰化物可能与细胞内的氧化还原酶反应,产生过量的活性氧,过量活性氧可以靶向损伤线粒体,作用于膜渗透性转换孔(MPTP),改变其构象使其呈现开放状态[14],线粒体膜去极化,引起线粒体渗透性转换(MPT),导致膜电位下降[15],同时大黄素乙酰化物刺激内质网使其紊乱,造成游离钙离子浓度的增加,破坏线粒体膜电位和ATP合成水平,最终引发自噬。
研究表明,一些天然食物及其类似物或化合物可诱导肿瘤细胞自噬和抑制增殖的作用[16]。本研究选取大黄素乙酰化物作用于鼻咽癌CNE-1细胞线粒体损伤可以诱发线粒体自噬,研究结果为开发促肿瘤细胞自噬性死亡的药物提供了新的线索。探讨自噬在肿瘤发生、发展过程中的作用及其机制,或许可以揭开抗肿瘤药物的新篇章,但如何提高该药物对肿瘤组织或细胞的靶向性,降低其毒副反应有待进一步研究。
[1] Moretti L,Yang ES,Kim KW,et al.Autophagy signaling in cancer and its potential as novel target to improve anticancer therapy[J]. Drug Resist Updat,2007,10(4-5):135-143.
[2] Demasters G,Di X,Newsham I,et al.Potentiation of radiation sensitivity in breast tumor cells by the vitamin D3 analogue,EB 1089,through promotion of autophagy and interference with proliferative recovery[J].Mol Cancer Ther,2006,5(11):2786-2797.
[3] 梁 燕,侯华新,黎丹戎,等.1,8-二羟基-3-乙酰基-6-甲基-9,10蒽醌的合成及对卵巢癌细胞的生长抑制[J].中国新药杂志,2012,21(9):1038-1041.
[4] Rodriguez-Enriquez S,He L,Lemasters JJ.Role of mitochondrial permeability transition pores in mitochondrial autophagy[J]. Int J Biochem Cell Biol,2004,36(12):2463-2472.
[5] Kim I,Lemasters JJ.Mitochondrial degradation by autophagy(mitophagy)in GFP-LC3 transgenic hepatocytes during nutrient deprivation[J].Am J Physiol Cell Physiol,2011,300(2):C308-317.
[6] Xie R,Nguyen S,McKeehan WL,et al.Acetylated microtubules are required for fusion of autophagosomes with lysosomes[J].BMC Cell Biol,2010,11:89.
[7] Roggero E,Piazzon I,Nepomnaschy I,et al.Thymocyte depletion during acute trypanosoma cruzi infection in C57BL/6 mice is partly reverted by lipopolysaccharide pretreatment[J].FEMS Immunol Med Microbiol,2004,41(2):123-131.
[8] Shintani T,Klionsky DJ.Autophagy in health and disease:a doubleedged sword[J].Science,2004,306(5698):990-995.
[9] Roggero E,Piazzon I,Nepomnaschy I,et al.Thymocyte depletion during acute trypanosoma cruzi infection in C57BL/6 mice is partly reverted by lipopolysaccharide pretreatment[J].FEMS Immunol Med Microbiol,2004,41(2):123-131.
[10]Tasdemir E,Galluzzi L,Maiuri MC,et al.Methods for assessing autophagy and autophagic cell death[J].Methods Mol Biol,2008,445:29-76.
[11] Buytaert E,Callewaert G,Hendrickx N,et al.Role of endoplasmic reticulum depletion and multidomain proapoptotic BAX and BAK proteins in shaping cell death after hypericin-mediated photodynamic therapy[J].FASEB J,2006,20(6):756-758.
[12] Scherz-Shouval R,Shvets E,Fass E,et al.Reactive oxygen species are essential for autophagy and specifically regulate the activity of Atg4[J].EMBO J,2007,26(7):1749-1760.
[13] Rana P,Nadanaciva S,Will Y.Mitochondrial membrane potential measurement of H9c2 cells grown in high-glucose and galactose-containing media does not provide additional predictivity towards mitochondrial assessment[J].Toxicol in Vitro,2011,25(2):580-587.
[14]Theodossiou TA,Noronha-Dutra A,Hothersall JS.Mitochondria are a primary target of hypericin phototoxicity:synergy of intracellular calcium mobilisation in cell killing[J].Int J Biochem Cell Biol,2006,38(11):1946-1956.
[15] Chiang JH,Yang JS,Ma CY,et al.Danthron,an anthraquinone derivative,induces DNA damage and caspase cascades-mediated apoptosis in SNU-1 human gastric cancer cells through mitochondrial permeability transition pores and bax-triggered pathways[J].Chem Res Toxicol,2011,24(1):20-29.
[16]徐亚来,周广舟,夏熙郑,等.姜黄素类似物诱导A549细胞自噬和抑制增殖的作用[J].中国癌症防治杂志,2013,5(3):216-221.
[2013-12-05收稿][2014-01-28修回][编辑 阮萃才]
Mitophagy of nasopharyngeal carcinoma CNE-1 cells induced by acetylated emodin derivative
MO Yuan-yuan,HOU Hua-xin,LI Dan-rong△,CHEN Yun-long,LIANG Yan,MO Chun-yan,WANG Chun-miao,LI Jing(College of Pharmaceutical Science of Guangxi Medical University;△Department of Research,Guangxi Cancer Institute,Nanning 530021,P.R. China)
HOU Hua-xin.E-mail:houhuaxin@163.com
Objective To explore the relationship between mitochondrial damage and mitophagy in nasopharyngeal carcinoma CNE-1 cells treated with acetylated emodin derivative.Methods CNE-1 cells were divided into a control group and groups treated with 5 or 10 mg·L-1of acetylated emodin derivative.After treatment,autophagosome ultrastructure was analyzed by transmission electron microscopy,while mitochondrial membrane potential and levels of intracellular free calcium ion and reactive oxygen species were measured by confocal microscopy.Results Cells treated with acetylated emodin derivative showed mitochondrial damage and the presence of mitophagosomes,which were not observed in control cells.The emodin derivative also led to a significant decrease in mitochondrial membrane potential and increases in levels of intracellular free calcium ion and reactive oxygen species(P<0.05);these effects were dose-dependent.Analyzing mitochondrial and lysosome markers of treated cells revealed typical mitophagic features,including acidic lysosomal proliferation and lysosomes containing mitochondrial remnants labeled with Mito Tracker Green.The abundance of these features was also dose-dependent.Conclusion The acetylated emodin derivative can cause mitochondrial damage in nasopharyngeal carcinoma CNE-1 cells,perhaps through a mechanism closely related to mitophagy.
Nasopharyngeal neoplasm;Acetylated emodin derivative;Mitophagy;Transmission electron microscopy;Confocal laser scanning microscopy
R739.63
A
1674-5671(2014)01-06
10.3969/j.issn.1674-5671.2014.01.01
国家自然科学基金资助项目(81060270);广西医学科学实验中心开放基金资助项目(KFJJ2011-25)
候华新。E-mail:houhuaxin@163.com
