以基因通路富集法探索上皮性卵巢癌多药耐药相关生物学通路及功能性SNP位点
2014-07-01蔡祖艾王琪张玮李尹富强
蔡祖艾王 琪张 玮李 力 尹富强
作者单位:530021 南宁 广西医科大学附属肿瘤医院妇瘤科;△广西医科大学研究生学院;1广西肿瘤防治研究所实验研究部;2广西医科大学医学科学实验中心
基础研究
以基因通路富集法探索上皮性卵巢癌多药耐药相关生物学通路及功能性SNP位点
蔡祖艾△王 琪1张 玮1李 力 尹富强2
作者单位:530021 南宁 广西医科大学附属肿瘤医院妇瘤科;△广西医科大学研究生学院;1广西肿瘤防治研究所实验研究部;2广西医科大学医学科学实验中心
目的 借助生物信息学工具探索上皮性卵巢癌多药耐药相关的生物学通路及SNP位点。方法 从基因表达综合数据库的GSE13813芯片数据中筛选出初次术后经铂类和紫杉醇类联合化疗的73例患者,其中22例为化疗耐药,51例为化疗敏感。采用PLINK软件进行等位基因关联检验分析,对差异表达的SNP位点(P<0.05)采用WebGestalt在线工具和DAVID进行基因通路富集分析,并筛选与上皮性卵巢癌多药耐药相关的共同通路。利用SciMiner工具检索上皮性卵巢癌多药耐药研究相关基因,并用上述方法进行通路分析以交叉验证。最后对通路涉及的SNP及其连锁位点采用Snpfunc网站进行功能预计。结果 敏感组和耐药组共有4 978个差异表达的SNP位点。通路分析显示黏附分子、钙离子信号和ErbB信号途径与上皮性卵巢癌多药耐药相关。其中ErbB信号在文献挖掘通路分析中得到交叉验证。11个连锁SNP可通过异常剪接、编码非同义氨基酸等方式改变基因功能,从而影响通路在上皮性卵巢癌联合化疗中的作用。结论通过基因通路富集方法找到3个与上皮性卵巢癌多药耐药相关的通路及一批可能影响通路的功能性SNP位点。检测这些位点有助于预测上皮性卵巢癌联合化疗的反应。
卵巢肿瘤;上皮性卵巢癌;多药耐药;单核苷酸多态性;SNP芯片;基因通路富集分析
临床上大部分晚期上皮性卵巢癌患者对初次化疗较敏感,但最终约有80%的患者对化疗耐药,5年生存率一直徘徊在30%左右[1]。肿瘤细胞的多药耐药(multidrug resistance,MDR)是指肿瘤细胞在接触一种抗癌药物后,不但对该药产生耐药,而且还对其他结构和作用机制不同的药物也产生抗药性,出现交叉耐药,多药耐药是造成肿瘤化学药物治疗失败的主要原因[2]。单核苷酸多态性(single nucleotide polymorphism,SNP)占人类基因组所有变异的90%以上,对于生物医学研究有着极大的价值[3]。然而既往对卵巢癌耐药相关SNP的研究结果经常不尽一致,实验样本以及研究位点过少可能是其主要原因。Bolton等[4]建议加大样本量和同时检测多个位点如SNP芯片等方法来克服其不足。本生物信息学研究试图利用基于SNP的基因通路富集方法,从上皮性卵巢癌联合化疗芯片数据中筛选出一批与上皮性卵巢癌多药耐药相关的通路及功能性SNP位点,有望为临床预测上皮性卵巢癌联合化疗效果提供依据。
1 材料与方法
1.1 芯片数据来源
在基因表达综合数据库(gene expression omnibus,GEO)采用“ovarian cancer”、“drug resistance”及“SNP array”关键词检索卵巢癌耐药相关芯片数据。经阅读原文最终纳入GSE13813(affymetri×50 K芯片)共73个经铂类和紫杉醇类联合化疗的晚期上皮性卵巢癌样本。
1.2 芯片差异表达SNP的通路分析
1.2.1 芯片数据质量控制及差异表达SNP的选择
应用plink软件采用次要等位基因频率(minor allele frequency,MAF)0.01为标准对原始数据进行质量控制,并删除与性染色体相关的SNP位点。选取经等位基因关联检验(allelic test)结果中的差异SNP位点(P<0.05)进行后续通路分析。
1.2.2 多药耐药相关通路的选择 对上述差异表达SNP位点和基因分别采用WebGestalt在线工具和DAVID进行通路分析。以校正后的P<0.05并结合文献筛选上皮性卵巢癌多药耐药相关生物学通路。
1.3 文献检索验证
利用SciMiner文献挖据在线工具,采用“ovarian cancer”和“multidrug resistance”主题词初步检索与上皮性卵巢癌多药耐药相关的基因。分别采用Web-Gestalt在线工具和DAVID进行通路分析,再以校正后的P<0.05筛选共同的生物学通路。
1.4 多药耐药相关通路基因的SNP位点功能预测
将上述筛选出的通路中基因包含的SNP位点及其连锁位点采用Snpfunc网站(http://snpinfo.niehs. nih.gov/cgi-bin/snpinfo/snpfunc.cgi)进行功能预测。
1.5 统计学分析
采用SPSS 17.0统计学软件处理实验数据并进行分析。两个样本均数的比较采用t检验,两个样本率的比较采用χ2检验,P<0.05为差异有统计学意义。采用PLINK软件 1.07版(http://pngu.mgh.harvard.edu/ purcell/plink/)的等位基因关联检验比较各等位基因型在组间分布频率的差异,P<0.05为差异有统计学意义。采用WebGestalt和DAVID进行基因通路富集分析,校正后P<0.05为差异有统计学意义。
2 结果
2.1 化疗敏感组和耐药组患者临床病理特征的比较
提取的73例标本均为无血缘关系的晚期高级别浆液性上皮性卵巢癌(high grade serous ovarian cancer,HGSOC),初次手术前无放化疗史,术后接受6~8个常规疗程的铂类联合紫杉醇类化疗。术后化疗完毕若疾病无复发/进展的时间大于6个月为化疗敏感,小于6个月则为化疗耐药。分期采用FIGO病理分级标准,全部患者均为Ⅲ~Ⅳ期。肿瘤残存直径≤1 cm为手术满意,>1 cm则为不满意[5]。73例中敏感组51例,中位年龄57岁,其中6例年龄数据缺失。耐药组22例,中位年龄57岁,其中1例年龄数据缺失。以肿瘤残存直径1 cm为标准,敏感组中有34例为手术满意,15例为手术不满意,2例肿瘤残存直径数据缺失。耐药组中有12例为手术满意,8例为手术不满意,2例肿瘤残存直径数据缺失。两组临床病理参数的差异比较无统计学意义(P>0.05)。见表1。
2.2 数据质控及关联分析结果
原始芯片共有58 530个SNP检测位点,采用maf=0.01为标准并删除性染色体相关位点后剩余53 956个SNP位点纳入后续分析。等位基因关联分析结果显示共有4 978个SNP位点组间差异具有统计学意义(P<0.05),其在染色体分布的位置如图1。

表1 73例中化疗敏感和化疗耐药患者的临床病理特征比较
WebGestalt和DAVID分析结果显示这些位点属于268个不同基因。通路分析结果显示两者相同的生物学通路有5个,在丢弃明显与上皮性卵巢癌耐药无关的通路后剩余3个,包括细胞黏附分子、钙离子信号途径和ErbB信号途径。见表2。
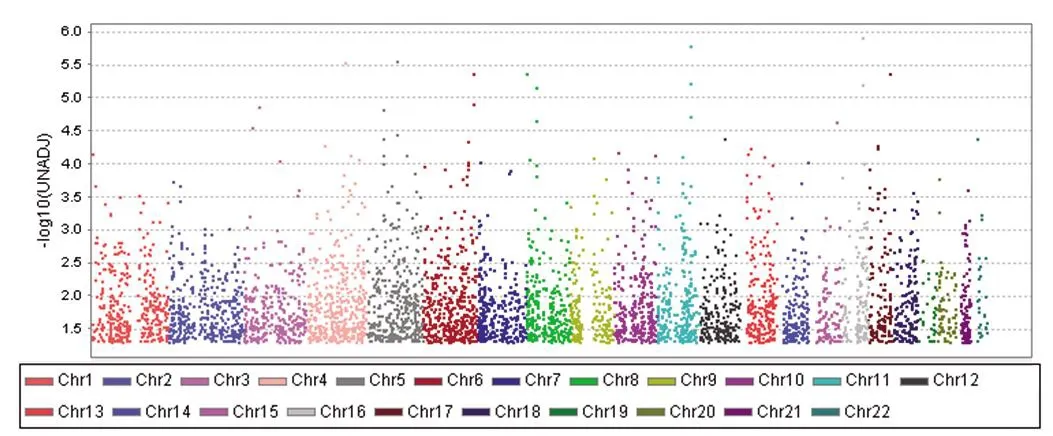
图1 差异SNP位点曼哈顿图注:横轴为染色体序号,纵轴为-lgp值。

表2 芯片数据通路分析与多药耐药相关的通路
2.3 文献挖据的基因通路分析结果
利用SciMiner在线工具初步挖掘出279篇可能与上皮性卵巢癌多药耐药相关的文献,包括233个非重复基因。WebGestalt和DAVID分析结果显示两者相同的通路有33个,在丢弃明显与上皮性卵巢癌耐药无关的通路后剩余13个,其中ErbB信号途径与芯片数据的通路分析结果重合。见表3。
2.4 多药耐药相关通路基因的SNP位点功能预测
通过上述分析最终发现3个可能与上皮性卵巢癌多药耐药相关的通路,即细胞黏附分子、钙离子信号途径和ErbB信号途径,其通路和包含的基因见表4。
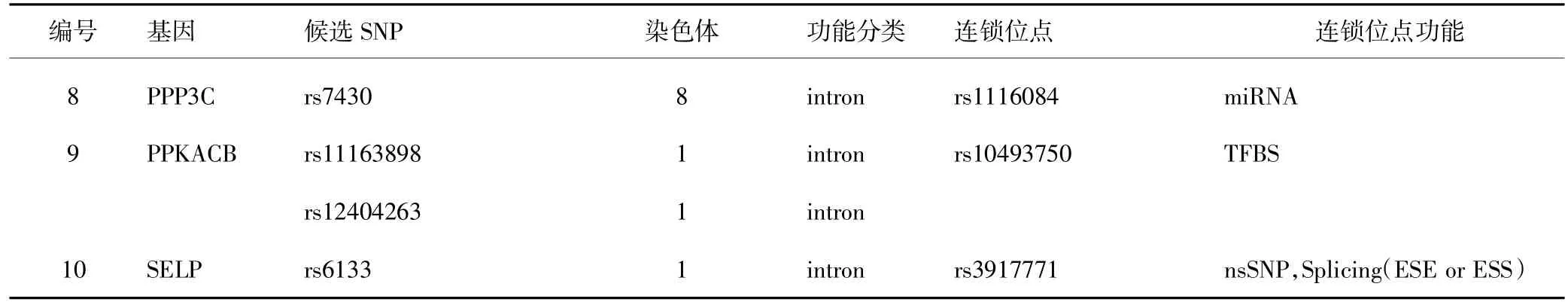
对各通路基因包含的SNP位点及其连锁位点(r2≥0.8)利用Snpfunc进行功能预测,共发现11个功能性位点。见表5。
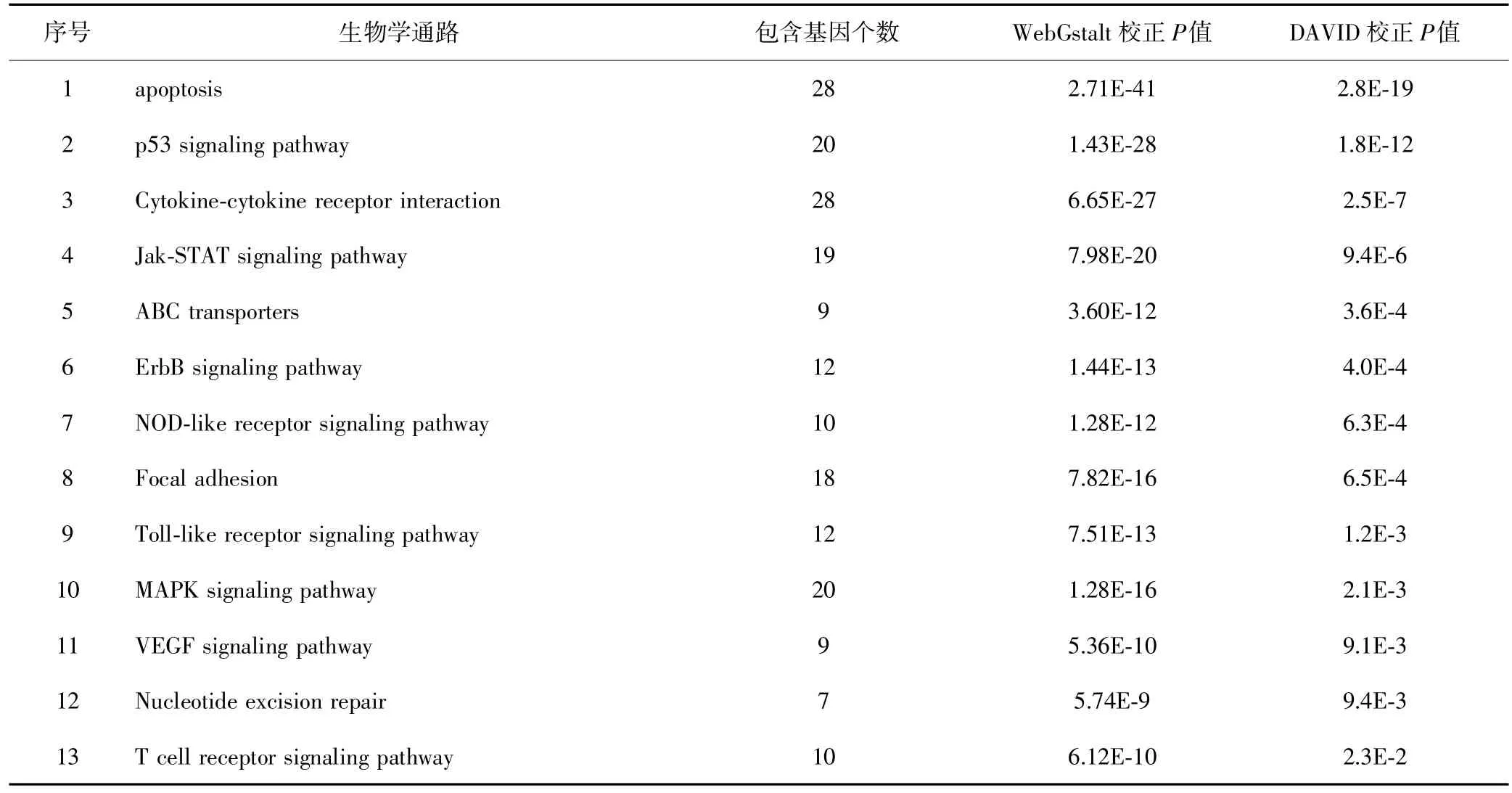
表3 文献挖掘和通路分析与多药耐药相关的生物学通路
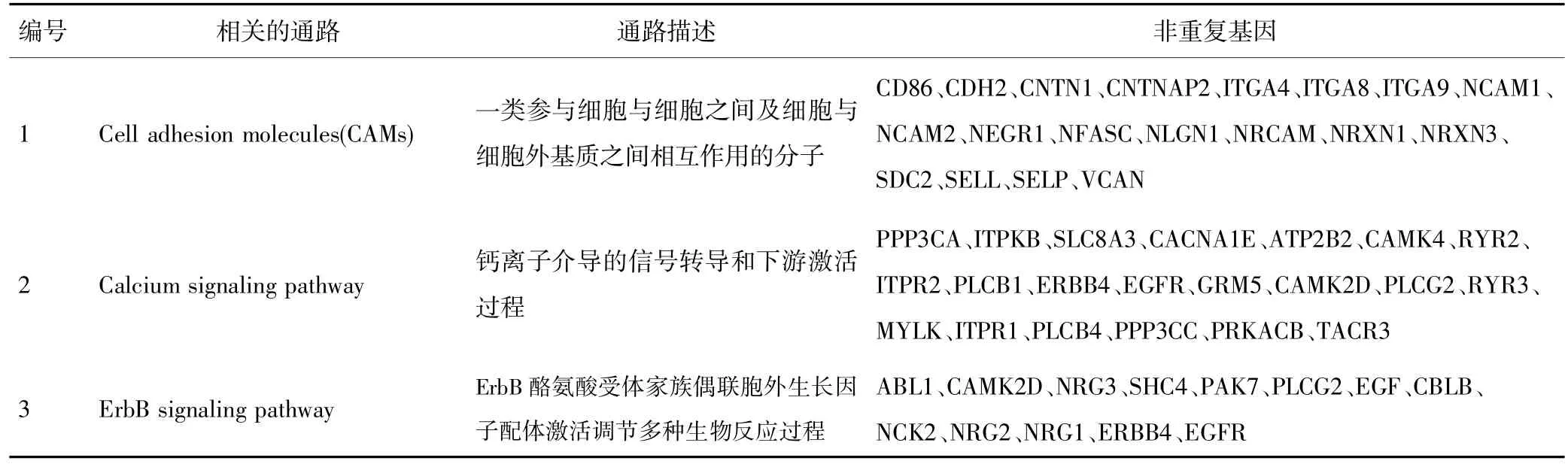
表4 上皮性卵巢癌多药耐药相关的通路及包含的非重复基因
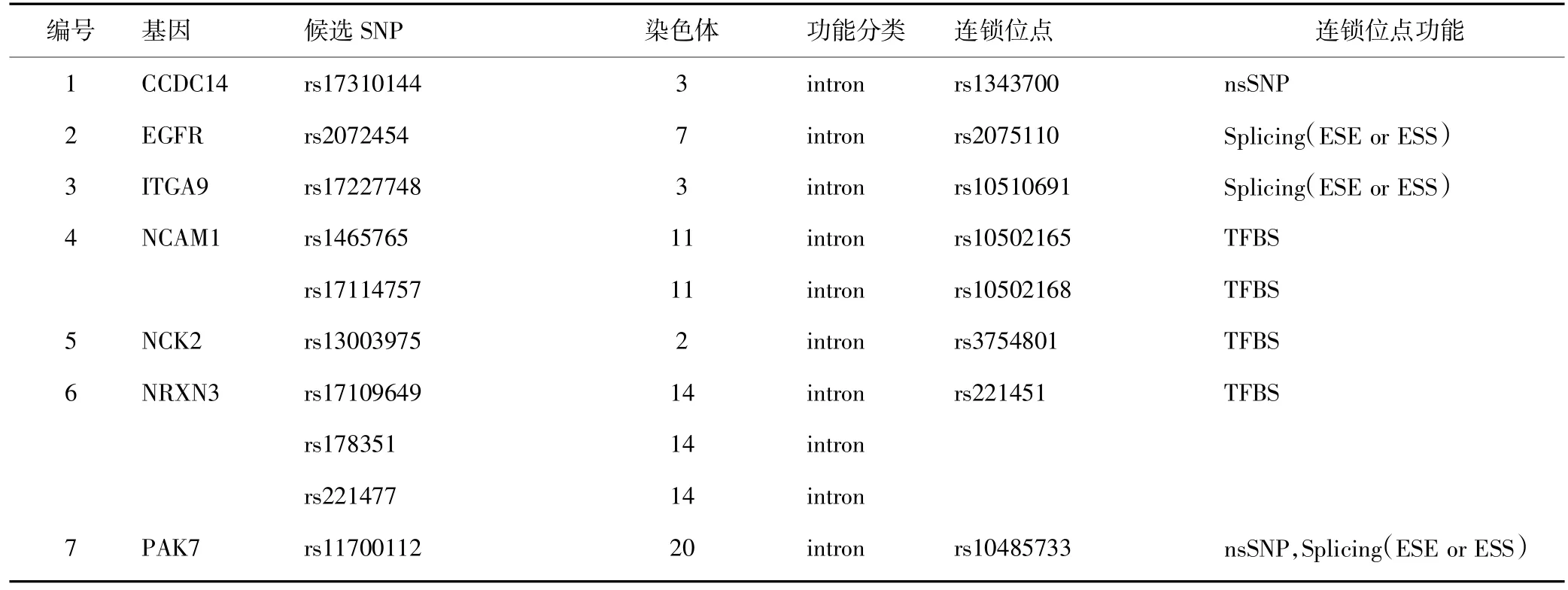
表5 多药耐药相关通路的功能性SNP位点
(续表)
3 讨论
自90年代以来卵巢癌5年总体生存率一直徘徊在20%~30%,临床上对耐药尤其是多药耐药治疗十分棘手。SNP占人群基因组变异的90%以上,对预测个体药物差异反应具有重要价值。经过检索GEO数据库,我们选取了GSE13813芯片数据中73个与上皮性卵巢癌多药耐药相关高级别浆液性上皮性卵巢癌癌样本,关联分析发现4 978个SNP位点在组间的差异有统计学意义,分别属于268个非重复基因。基因通路分析发现细胞黏附分子、钙离子信号途径和ErbB信号途径的差异有统计学意义。
ErbB酪氨酸受体家族偶联胞外生长因子配体激活胞内信号通路调节细胞增生、分化、移动及生存。该受体家族(包括EFGR/ErbB-1/HER-1、ErbB-2/HER-2、ErbB-3/HER-3和ErbB-3/HER-3等)在激活后形成同源或异源二聚体,导致自身磷酸化激活,进而激活MAPK和PI3K等下游通路。Huang等[6]通过对比分析晚期卵巢癌患者与正常卵巢上皮的干细胞基因组的基因谱情况,结果发现SP1(side population,SP1)和SP2卵巢癌中干细胞与正常上皮细胞中的干细胞相比,分别有1 349个和509个差异表达的基因。这些基因大部分与蛋白受体结合、激酶活性和化疗抵抗相关,基因通路富集分析发现其涉及ECM、ErbB信号途径等通路。由于卵巢癌干细胞具有多药耐药特性,因此推测这些关键通路可能也参与上皮性卵巢癌多药耐药过程。也有研究证实ErbB信号途径包含的多个基因与卵巢癌多药耐药相关。Wu等[7]研究发现多药耐药卵巢癌C13K细胞系转染野生型PTEN基因后,该基因表达增加进而通过降低磷酸化Akt基因的表达而恢复对顺铂药物的敏感性。Kim等[8]研究c-myc基因表达在多药耐药卵巢癌中使用肿瘤坏死因子相关凋亡诱导配体(TNF-related apoptosis-inducing ligand,TRAIL)治疗中的作用。结果发现c-myc基因表达上升在逆转卵巢癌多药耐药中发挥重要作用。此外该通路中其他基因如EGF、EGFR、PRKCA和SRC等也与卵巢癌多药耐药相关[9~12]。
本实验通过芯片分析发现细胞黏附分子、钙离子信号途径可能与上皮性卵巢癌多药耐药相关。细胞黏附分子是一群表达于细胞表面的蛋白,主要包括整合素家族、免疫球蛋白超家族、选择素及钙黏蛋白4类,它们在细胞生成、免疫反应和炎症等生物学过程发挥重要作用。细胞黏附介导的耐药(cell adhesion mediated drug resistance,CAM-DR)中整合素家族研究较为广泛。已有研究证实整合素与卵巢癌、多发性骨髓瘤、结肠癌等多个恶性肿瘤化疗耐药相关,涉及卡铂、长春碱、5-FU等药物[13~15]。此外,钙黏蛋白、选择素等家族也参与多种癌症及耐药的发生。
钙离子可通过门控通道由细胞外部流入细胞内,也可由磷酸三肌醇受体(IR3Rs)或ryanodin受体调节胞内"钙离子池"释放入细胞内。已有研究证实L型电压门控钙离子通道(voltage-gated calcium channel,VGCC)异常可导致非小细胞肺癌亚克隆细胞系抵抗多种化疗药物,钙离子通道阻断剂维拉帕米(verapamil)则可以在一定程度上逆转多药耐药[16]。
功能性SNP位点可以通过影响转录因子或miRNA结合、异常剪接、编码非同义氨基酸等方式改变基因功能,从而可能影响患者对化疗敏感性。虽然由于芯片检测位点和样本较少,导致本生物信息学探索出的上皮性卵巢癌多药耐药相关通路及功能性SNP位点有限,但利用芯片检测比传统方法更为高效。Meng等[17]应用SNP芯片对FGF-FGFR轴多个基因多态性位点进行研究,发现包括FGF18(rs3806929)在内的4个与上皮性卵巢癌多药耐药相关的SNP。Liang等[18]借助芯片研究与microRNA处理相关的基因多态性位点,发现了包括ALDH5A1(rs12190214)等在内的17个与上皮性卵巢癌多药耐药相关的功能性SNP位点。
本实验通过基于SNP的基因通路富集分析,初步发现3个通路包括多个SNP位点可能与上皮性卵巢癌多药耐药相关。通过检测这些多态性位点有助于从分子水平阐明上皮性卵巢癌多药耐药的机制,从而为预测化疗敏感性及个体化治疗提供理论基础。
[1] Cannistra SA.Cancer of the ovary[J].N Eng J Med,2004,351(24):2519-2529.
[2] Calatozzolo C,Gelati M,Ciusani E,et al.Expression of drug resistance proteins P-gp,MRP1,MRP3,MRP5 and GST-pi in human glioma[J].J Neurooncol,2005,74(2):113-121.
[3] Su SC,Jay Kuo CC,Chen T.Single nucleotide polymorphism data analysis-state-of-the-art review on this emerging field from a signal processing viewpoint[J].Signal Processing Magazine,IEEE 2007,24:75-82.
[4] Bolton KL,Ganda C,Berchuck A,et al.Role of common genetic variants in ovarian cancer susceptibility and outcome:progress to date from the Ovarian Cancer Association Consortium(OCAC)[J].J Intern Med,2012,271(4):366-378.
[5] Etemadmoghadam D,deFazioA,Beroukhim R,etal.Integrated genome-wide DNA copy number and expression analysis identifies distinct mechanisms of primary chemoresistance in ovarian carcinomas[J].Clin Cancer Res,2009,15(4):1417-1427.
[6] Huang Y,Ju B,Tian J,et al.Ovarian cancer stem cell-specific gene expression profiling and targeted drug prescreening[J].Oncol Rep,2014,31(3):1235-1248.
[7] Wu H,Weng D,Xing H.Reversal of multidrug resistance and inhibition of phosphorylation of AKT in human ovarian cancer cell line by wild-type PTEN gene[J].J Huazhong Univ Sci Technolog Med Sci,2007,27(6):713-716.
[8] Kim DY,Kim MJ,Kim HB,et al.Suppression of multidrug resistance by treatment with TRAIL in human ovarian and breast cancer cells with high level of c-myc[J].Biochim Biophys Acta,2011,1812(7):796-805.
[9] Cloven NG,Kyshtoobayeva A,Burger RA,et al.n vitro chemoresistance and biomarker profiles are unique for histologic subtypes of epithelial ovarian cancer[J].Gynecol Oncol,2004,92(1):160-166.
[10]Milane L,Duan Z,Amiji M.Development of EGFR-targeted polymer blend nanocarriers for combination paclitaxel/lonidamine delivery to treat multi-drug resistance in human breast and ovarian tumor cells[J]. Mol Pharm,2011,8(1):185-203.
[11] Zhao LJ,Xu H,Qu JW,et al.Modulation of drug resistance in ovarian cancer cells by inhibition of protein kinase C-alpha(PKC-alpha)with small interference RNA(siRNA)agents[J].Asian Pac J Cancer Prev,2012,13(8):3631-3636.
[12] Yun UJ,Lee JH,Koo KH,et al.Lipid raft modulation by Rp1 reverses multidrug resistance via inactivating MDR-1 and Src inhibition[J].Biochem Pharmacol,2013,85(10):1441-1453.
[13] Scalici JM,Harrer C,Allen A,et al.Inhibition of α4β1 integrin increases ovarian cancer response to carboplatin[J].Gynecol Oncol,2014,132(2):455-461.
[14]Long QZ,Zhou M,Liu XG,et al.Interaction of CCN1 with αVβ3 integrin induces P-glycoprotein and confers vinblastine resis-tance in renal cell carcinoma cells[J].Anti-cancer Drugs,2013,24(8):810-817.
[15] Liu S,Wang J,Niu W,et al.The β6-integrin-ERK/MAP kinase pathway contributes to chemo resistance in colon cancer[J].Cancer Lett,2013,328(2):325-334.
[16]Chiu LY,Ko JL,Lee YJ,et al.L-type calcium channel blockers reverse docetaxel and vincristine-induced multidrug resistance independent of ABCB1 expression in human lung cancer cell lines[J]. Toxicol Lett,2010,192(3):408-418.
[17] Meng QH,Xu E,Hildebrandt MA,et al.Genetic variants in the fibroblast growth factor pathway as potential markers of ovarian cancer risk,therapeutic response,and clinical outcome[J].Clin Chem,2014,60(1):222-232.
[18] Liang D,Meyer L,Chang DW,et al.Genetic variants in microRNA biosynthesis pathways and binding sites modify ovarian cancer risk,survival,and treatment response[J].Cancer Res,2010,70(23):9765-9776.
[2014-04-20收稿][2014-06-02修回][编辑 阮萃才]
Using gene-set enrichment pathway analysis to identify signaling pathways and functional single nucleotide polymorphisms related to multi-drug resistance in epithelial ovarian cancer
CAI Zu-ai△,WANG Qi1,ZHANG Wei1,LI Li,YIN Fu-qiang2(Department of Gynecologic Oncology,Affiliated Tumor Hospital of Guangxi Medical University;△Graduate School of Guangxi Medical University;1Department of Research,Guangxi Cancer Institute;2Medical Scientific Research Centre,Guangxi Medical University,Nanning 530021,P.R.China)
YIN Fu-qiang.E-mail:yinfq@mail2.sysu.edu.cn
Objective This bioinformatics study aimed to explore signaling pathways and functional single nucleotide polymorphisms(SNPs)related to multidrug resistance(MDR)in epithelial ovarian cancer.Methods Patients with ovarian cancer treated by platinum and paclitaxel after primary surgery were selected from the SNP array(GSE13813)in the Gene Expression Omnibus(GEO)dataset. PLINK software and allelic tests were applied to identify SNPs significantly related to MDR(P<0.05),which were further analyzed online using gene-set enrichment pathway analysis(GSEA)in WebGestalt and DAVID.SciMiner was used to search for all genes potentially related to MDR in patients with epithelial ovarian cancer,and the corresponding functional pathways were explored using WebGestalt and DAVID.Finally,the on-line software Snpfunc was used to predict functions of SNPs in MDR-related pathways as well as of their partners in linkage disequilibrium.Results GSEA of 4978 significant SNPs from 22 platinum-resistant and 51 platinumsensitive patients identified cell adhesion molecules and calcium-and ErbB-dependent signaling pathways as being potentially relatedto MDR.Literature analysis supported the association between the ErbB signaling pathway and MDR.Function prediction suggested that 11 functional SNPs may modify gene function by causing aberrant splicing or amino acid substitutions,potentially affecting response to combination chemotherapy.Conclusion Using GSEA,we identified three possible MDR-related signaling pathways and 11 functional SNPs that may help predict responses to platinum-based combination chemotherapy for epithelian ovarian cancer. These findings should be confirmed in future studies.
Ovarian neoplasm;Epithelial ovarian cancer;Multidrug resistance;Single nucleotide polymorphism;SNP array;Geneset enrichment analysis
R737.31
A
1674-5671(2014)02-06
10.3969/j.issn.1674-5671.2014.02.06
广西医学科学实验中心开放基金资助项目(KFJJ2011-15)【通信作者】尹富强。E-mail:yinfq@mail2.sysu.edu.cn
