慢病毒介导的LKB1基因在子宫内膜癌HEC-1A细胞中的表达
2014-07-01唐乔乔宋玥龙张洁清宋红林赵冰冰
唐乔乔宋 玥龙 颖 张洁清 宋红林 赵冰冰
作者单位:530021 南宁 广西医科大学附属肿瘤医院妇瘤科;△广西医科大学研究生学院
基础研究
慢病毒介导的LKB1基因在子宫内膜癌HEC-1A细胞中的表达
唐乔乔△宋 玥△龙 颖 张洁清 宋红林 赵冰冰
作者单位:530021 南宁 广西医科大学附属肿瘤医院妇瘤科;△广西医科大学研究生学院
目的 探讨慢病毒系统介导的LKB1基因在子宫内膜癌HEC-1A细胞中的过表达,为进一步研究LKB1基因在子宫内膜癌的作用机制奠定基础。方法 以PCR扩增LKB1克隆质粒获得全长cDNA,将LKB1 cDNA链接到慢病毒载体pWPI,构建慢病毒表达质粒LKB1/pWPI。通过与包装质粒pCMV-Dr8.74和pMD2.G共转染293T细胞进行病毒包装,用包装成功后的病毒液感染子宫内膜癌HEC-1A细胞,以荧光定量PCR、Western blot法检测HEC-1A细胞中LKB1的相对表达量。结果 成功扩增LKB1全长cDNA和构建LKB1重组慢病毒表达载体LKB1/pWPI。转染包装293T细胞后能产生慢病毒颗粒并能有效感染靶细胞HEC-1A。转染后HEC-1A-LKB1-pWPI细胞中LKB1的表达率明显高于亲本细胞和空白对照细胞(P<0.01)。结论 成功构建携带LKB1基因的慢病毒表达载体,包装病毒后能有效地感染子宫内膜癌HEC-1A细胞,为进一步探讨LKB1基因在子宫内膜癌中的生物学效应奠定了基础。
子宫肿瘤;子宫内膜癌;LKB1;慢病毒
LKB1基因又称STK11(serine threonine kinase)基因,目前认为是一种肿瘤抑制基因[1]。1998年由Hemminki等[2]采用定位候选克隆的方法从Peutz-Jeghers syndrome(PJS)患者血液细胞中克隆出来。以往的实验研究发现,子宫内膜癌从正常组织到癌变的过程中,存在LKB1的表达缺失[3]。LKB1作为一种抑癌基因,其表达缺失与子宫内膜癌的发生、发展是否存在密切相关?是否可以作为子宫内膜癌基因治疗的一个新靶点?为进一步探讨两者的关系,本实验构建高拷贝的LKB1/pWPI重组慢病毒表达质粒,并将其转染到该基因表达缺失的子宫内膜癌HEC-1A细胞中,进一步观察LKB1对肿瘤细胞增殖的影响,为研究LKB1与子宫内膜癌的发病机制提供理论基础。
1.1 材料与方法
1.1 材料
1.1.1 质粒、细菌及细胞株 慢病毒系统表达质粒pWPI、包装质粒pCMV-Dr8.74、包膜质粒pMD2.G、人子宫内膜癌HEC-1A细胞、人胚胎肾上皮293T细胞及感受态大肠杆菌DH-5α均为广西医科大学附属肿瘤医院实验室保存。
1.1.2 主要试剂及仪器 逆转录聚合酶链反应(RTPCR)试剂盒、羟乙基哌(HEPSE)和Trizol试剂均购自美国Sigma公司,限制性内切酶PmeI和快速链接试剂盒购自纽英仑生物技术公司,虾碱性磷酸酶(SAP)购自日本 Tataka公司,T4DNA Polymerase和 First STRAND cDNA Synthesis Kit逆转录试剂盒购自加拿大MBI Fermentas公司,Lipofectamin 2000购自美国Invitrogen公司,无内毒素质粒提取试剂盒购自北京Tiangen公司,补平试剂盒购自上海Genestar公司。引物合成和测序由美国Ivitrogen公司(上海英杰生物工程有限公司)完成。
1.2 实验方法
1.2.1 LKB1基因引物设计及合成 根据Genebank人类LKB1(STK11)mRNA(NM_000455.4)序列设计引物,送上海英杰生物工程公司合成。检测LKB1基因mRNA表达引物的上游引物为5′TGTGGCTATGAGGATGTTTGG 3′,下游引物为5′TTGGTCGTGTTGTCTGGTTGAT 3′,长度为118 bp;LKB1基因全长cDNA引物上游引物为5′ATGGCAGGTGAAGAAATTAAT 3′,下游引物为5′TTAACTTTTACTTTTTCCTTTATTG 3′,长度为1 302bp;β-actin内参引物的上游引物为5′AAAAGCCACCCCACTTCTCT 3′,下游引物为3′GACCAAAAGCCTTCATACATCTCA 5′,长度为221bp;PWPI载体通用引物的上游引物为5′TCAAGCCTCAGACAGTGGTTC 3′,下游引物为5′CGTCGCCGTCCAGCTCGACCAG 3′,长度为904 bp。
1.2.2 LKB1重组慢病毒表达质粒的构建 采用LKB1基因的cDNA作为模板,PCR反应体系:10× buffer 2.5 μl,dNTP1.5 μl,上下游引物各1 μl,Taq酶0.2 μl,模板1 μl,ddH2O 25 μl。反应条件为94℃5 min,94℃ 30 s,61℃ 30 s,72℃ 30 s,共30个循环,72℃10 min延伸,4℃保存。将产物按照说明书进行回收和纯化,取1 μl DNA加149 μl DEPC水,混匀后测A260值,按照DNA浓度(μg/μl)=(A260×50×稀释倍数)/ 1 000计算纯化的DNA浓度。PmeI酶切pWPI载体质粒pWPI,SAP去磷酸化后回收。链接LKB1与pWPI,LKB1∶pWPI浓度比为3∶1,链接体系为T4 buffer 1 μl,T4 DNA Ligase 1 μl,LKB1 DNA 1 μl,10×Ligation Buffer 1 μl,ddH2O 10 μl,16℃反应16 h后将链接产物转化感受态大肠杆菌DH-5α,取适量转化后的菌液涂布AMP(+)的琼脂糖平板培养基上,37℃培养20~24 h后挑选阳性克隆,将其接种于3 ml AMP(+)的LB中,37℃振荡培养16~20 h后采用质粒DNA提取试剂盒提取质粒DNA。取每管菌液1 μl为模板,用pWPI载体的通用引物进行PCR反应,将可以扩增出目的条带的重组质粒送上海英杰生物工程公司测序。
1.2.3 LKB1重组慢病毒表达质粒的包装及滴度测定 将293T细胞以1×105个细胞的密度接种到12孔板,采用LipofectamineTM2000转染试剂盒,按照说明书的方法进行操作,将LKB1/pWPI质粒、pCMV包膜质粒、pMD2.G包装质粒按照3∶2∶2的比例共转染293T细胞,24 h及48 h后用荧光显微镜观察转染效率。将293T细胞按照每孔100 μl含有1×104个细胞接种到24孔板中,用不含抗生素的DMEM培养液将病毒液稀释为1倍、2倍、4倍、8倍、16倍和32倍,分别加入到24孔板的细胞中,轻轻混匀,37℃、5%CO2培养箱中培养48 h后在荧光显微镜下计数有荧光的细胞数,取5个视野取平均值计算病毒滴度。病毒滴度(IU/ml)=(荧光细胞占总细胞数的百分比×接种细胞数/100×接种细胞体积)×1/稀释倍数。
1.2.4 重组慢病毒转染HEC-1A细胞及流式细胞仪分选 取对数生长期的HEC-1A细胞,以4×105个细胞/孔接种于6孔板,每组设置3个平行孔。37℃、5% CO2培养24 h后弃去上清液,加入800 μl病毒液,培养96~120 h。将准备好需要分选的带有绿色荧光的细胞,调整细胞计数为1×107~1×108个,PBS洗2~3遍后以1 000 r/min离心5 min,取1~2 ml转染后的HEC-1A细胞,以300目的细胞筛过滤,用绿色荧光蛋白标记进行流式分选。
1.2.5 荧光定量PCR检测LKB1的表达量 从6孔板中收集转染的HEC-1A细胞,采用Trizol法提取总RNA,逆转录为总cDNA,检测转染靶细胞LKB1的表达量。荧光定量-PCR反应条件为:94℃5 min,94℃30 s,60℃30 s,72℃20 s,30个循环,72℃10 min。实验分为3组:HEC-1A-LKB1-pWPI组(转染带有LKB1基因的病毒颗粒)、HEC-1A-pWPI(转染空病毒颗粒对照)以及HCE-1A组(空白对照)。荧光定量PCR扩增反应完成后,仪器自行进行数据分析,分别给出各个样品的Ct值与SQ值。利用2-△△Ct法计算实验组与对照组目标基因mRNA模板的相对差异。△Ct实验组= Ct(实验组目标基因)-Ct(实验组内参基因),△Ct对照组=Ct(对照组目标基因)-Ct(对照组内参基因)。△△Ct=△Ct实验组-△Ct对照组。最后,计算目的基因模板水平比率:2-△△Ct=mRNA模板量的比值。
1.2.6 Western blot法检测3组细胞中LKB1蛋白的表达 将准备好3组培养好的细胞弃去培养液后加入2~3 ml预冷4℃的PBS洗涤3次,弃掉PBS后每瓶加入200~400 μl含PMSF的裂解液(1 ml蛋白裂解液加入10 μl PMSF),冰上裂解30 min,然后用干净的细胞刮棒将细胞刮于培养瓶的一侧,再用移液枪将裂解液和细胞碎片移至1.5 ml离心管中。以14 000 r/min、4℃离心30 min,将离心后的上清液分装到0.6 ml的离心管中,用BAC法测定蛋白浓度。体积按4∶1加1×上样缓冲液混匀,根据测算的浓度确定50 μg为上样量,换算出各自的实际上样体积。用普通PCR仪煮沸5 min变性,进行SDS-PAGE电泳分离蛋白(5%浓缩胶,12%分离胶),浓缩胶跑80 V的恒压,分离胶跑120 V的恒压,总时间为2 h左右,按照蛋白质Marker切下LKB1和GAPDH胶段,转移至PVDF膜上(恒100 mA,42 min),5%脱脂牛奶封闭非特异抗原2.5 h,PBS-T洗涤1次,将一抗用PBS-T稀释至适当浓度为1∶2 000,GAPDH为1∶5 000,放入培养皿中;从封闭液中取出膜,用滤纸吸去残留液后,将膜蛋白面朝下置于抗体液面上,4℃孵育过夜,用PBS-T在室温下脱色摇床上洗涤两次,每次10 min;再用PBS洗涤一次,10 min。同上法准备二抗稀释液(1∶10 000),并与膜接触,室温下孵育2 h后,用PBS-T在室温下脱色摇床上洗涤两次,每次10 min;再用PBS洗涤一次,10 min,进行化学发光反应。凝胶图像分析:将胶片进行扫描或拍照,用凝胶图像处理系统分析目标带的分子量和净光密度值。
1.3 统计学方法
采用SPSS 17.0统计学软件进行分析。3组样本LKB1基因相对表达量采用多个样本两两比较的配对资料t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 重组表达质粒LKB1/PWPI的PCR鉴定
采用1.5%的琼脂糖凝胶电泳检测,结果显示1 302 bp左右的条带的质粒为含有目的基因的重组质粒。见图1。送上海英杰生物工程公司测序,结果在NCBI进行BLAST结果序列进行对比分析,显示在295 bp和1 256 bp位置的基因发生突变,但是编码的氨基酸并不改变,可以进行后续实验。

图1 PCR产物琼脂糖凝胶电泳结果注:M.Marker;1、2.胶回收LKB1 PCR产物。
2.2 质粒转染子宫内膜癌HEC-1A细胞及阳性克隆的筛选
按照最佳转染条件进行质粒转染后分别于转染24 h、36 h、48 h后观察293T细胞的转染效率。如图2所示,细胞转染48 h的转染效率最高,达到92%左右。根据公式计算得出,包装的病毒滴度约为5.0×107IU/ml。吸取病毒上清液感染HEC-1A细胞后96~120 h于荧光显微镜下观察,见绿色荧光细胞占总细胞平均数的70%~80%,如图3所示,说明携带LKB1基因的慢病毒能高效感染HEC-1A细胞。经流式细胞仪分选可获得感染效率达95%以上的HEC-1A细胞。见图4。

图2 转染24 h、36 h、48 h荧光显微镜观察293T细胞的转染效率(×200)注:A.转染24 h;B.转染36h;C.转染48 h。
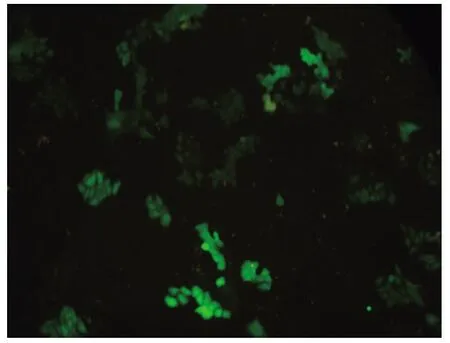
图3 吸取病毒上清液感染HEC-1A细胞后96~120 h检测绿色荧光蛋白的表达(×200)
2.3 荧光定量PCR检测转染HEC-1A细胞LKB1的相对表达量

图4 HEC-1A-LKB1-pWPI感染子宫内膜癌HEC-1A细胞后分别于荧光显微镜(×200)和普通白光显微镜下(×200)观察细胞感染效率注:A.荧光显微镜下观察;B.普通白光显微镜下观察。
通过荧光定量PCR检测HEC-1A-LKB1-pWPI、HEC-1A-pWPI及HEC-1A 3组中LKB1的表达量,结果转染后HEC-1A-LKB1-pWPI组的细胞中LKB1的表达量明显高于HEC-1A-pWPI组和HEC-1A组,差异均有统计学意义(P均<0.01);HEC-1A组和HEC-1A-pWPI组比较差异无统计学意义(P>0.05)。见表1。

表1 HEC-1A-LKB1-pWPI组与HEC-1A-pWPI组和HEC-1A组中LKB1基因的表达量比较(χ±s)
2.4 Western blot法检测3组细胞中LKB1的蛋白表达
以Western blot法验证转染后的子宫内膜癌HEC-1A细胞中LKB1的蛋白表达。由图5可见,HEC-1A-LKB1-pWPI组细胞LKB1的蛋白表达为阳性,而HEC-1A-pWPI组和HEC-1A组未检测到LKB1基因蛋白的表达,说明上调LKB1基因的表达成功。见图5。
3 讨论
近年来子宫内膜的发病率在世界范围内呈上升的趋势,流行病学调查发现,其发病率与地区差异及种族有密切的关系,在北欧及北美地区的发病率最高,在某些欧美国家其发病率占女性生殖道恶性肿瘤的首位[4]。随着子宫内膜癌发病率的不断升高、癌基因及抑癌基因研究的深入开展,目前世界上对于子宫内膜癌分子生物学发病机制的研究有了进一步的认识。迄今研究较多且得到公认的主要有ER、PR、p53、DNA含量在子宫内膜癌的异常表达[5],但国内有关LKB1基因与子宫内膜癌分子生物学的发病研究尚无报道。
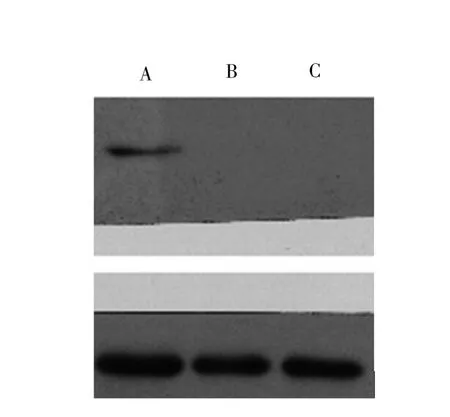
图5 Western blot法检测LKB1蛋白的表达注:A.HEC-1A-LKB1-pWPI组;B.HEC-1A-pWPI组;C.为HEC-1A组。
目前有研究发现,LKB1由433个氨基酸组成,位于人体基因染色体19p13.3,其编码产物相对分子量为60 000KD的丝氨酸/苏氨酸蛋白激酶,是腺苷酸激酶(AMPK)的上游激酶[6]。LKB1能够通过激活AMPK,抑制mTor复合体,从而达到降低蛋白翻译肌细胞的生长[7]。Contreras等[8]研究发现,在体内或者生殖细胞中LKB1基因失活的雌性小鼠中,有>50%的小鼠发生子宫内膜癌,表明LKB1对子宫内膜癌的发生、发展起到明显的抑制作用[9]。
LKB1蛋白至少参与两个不同潜在的重叠的生物学途径。大部分研究表明LKB1基因缺失导致肿瘤的产生与细胞极性的缺失相关,而细胞极性的缺失与恶性肿瘤细胞的浸润及增殖相关,这些特征与腺癌包括子宫内膜腺癌的特征相符[10]。LKB1是AMPK的上游激酶,直接参与AMPK信号传导通路的调控。在肿瘤细胞中,LKB1基因的缺失促进了细胞的生长、增殖与肿瘤的发生。LKB1是通过对AMPK及mTOR信号传导通路的调控,还可以调节上皮细胞紧密链接,有助于维持上皮细胞极性。
慢病毒载体来源于人类免疫缺陷病毒-1,具有感染目的细胞后不会再感染其他细胞的特性[11]。由于慢病毒属于假性病毒,其毒性基因已经被剔除,并且被外源性目的基因取代。其具有转移基因片段容量大、不容易诱发宿主免疫反应的特效,能够整合到宿主细胞的基因组,且不会利用宿主细胞产生新的病毒颗粒,既能感染分裂细胞,也能感染不分裂细胞[12,13]。慢病毒能够稳定持久地表达目的基因,目前已被广泛应用于基因功能及治疗的研究中。pWPI慢病毒载体质粒是第二代慢病毒载体,拥有绿色荧光蛋白基因以及氨苄青霉素抗性基因,均可作为筛选标记[14]。
本课题组前期的研究结果表明,在子宫内膜癌HEC-1A细胞中没有LKB1基因的表达,因此我们选用HEC-1A细胞作为研究对象,构建了LKB1/pWPI慢病毒载体表达质粒,与包装质粒、包膜质粒共转染293T细胞。将转染后的质粒在荧光显微镜下观察,能够看到绿色荧光蛋白的表达。收集慢病毒颗粒后感染靶细胞HEC-1A进行荧光定量PCR、Western blot法检测,发现LKB1在HEC-1A细胞中呈高表达状态,说明本实验成功构建、包装慢病毒载体表达质粒,并且能够有效地感染HEC-1A细胞。本实验通过成功构建稳定、高效的LKB1/pWPI重组慢病毒表达质粒,并以慢病毒载体介导LKB1基因转染到LKB1表达缺失的子宫内膜癌HEC-1A细胞中,为进一步研究LKB1基因的作用机制及其与子宫内膜癌发生、发展的关系、探讨子宫内膜癌新的治疗方法奠定了基础。
[1] Zheng B,Cantley LC.Regulation of epithelial tight junction assembly and disassembly by AMP-activated protein kinase[J].Proc Natl Acad Sci U S A,2007,104(3):819-822.
[2] Hemminki A,Markie D,Tomlinson I,et al.A serine/threonine kinase gene defective in Peutz-Jeghers syndrome[J].Nature,1998,391(6663):184-187.
[3] Borun P,Bartkowiak A,Banasiewicz T,et al.High resolution melting analysis as a rapid and efficient method of screening for small mutations in the STK11 gene in patients with Peutz-Jeghers syndrome[J]. BMC Med Genet,2013,14:58.
[4] Ring KL,Connor EV,Atkins KA,et al.Women 50 years or younger with endometrial cancer:the argument for universal mismatch repair screeningand potential for targeted therapeutics[J].Int J Gynecol Cancer,2013,23(5):853-860.
[5] Saeedi R,Parsons HL,Wambolt RB,et al.Metabolic actions of metformin in the heart can occur by AMPK-independent mechanisms[J]. Am J Physiol Heart Circ Physiol,2008.294(6):H2497-2506.
[6]丁新民,徐勤枝,周平坤.LKB1基因功能及与肿瘤关系研究进展[J].国外医学·肿瘤学分册,2004,31(10):723-726.
[7] Wognum B,Yuan N,Lai B,et al.Colony forming cell assays for human hematopoietic progenitor cells[J].Methods Mol Biol,2013,946:267-283.
[8] Contreras CM,Gurumurthy S,Haynie JM,et al.Loss of LKB1 proyokes highly invasive endometrial adenocarcinomas[J].Cancer Res,2008,68(3):759-766.
[9] Shirazi RS,Ewert KK,Silva BF,et al.Structural evolution of environmentally responsive cationic liposome-DNA complexes with a reducible lipid linker[J].Langmuir,2012,28(28):10495-10503.
[10] Li J,Fan Y,Chen J,et al.Microarray analysis of differentially ex-pressed genes between nasopharyngeal carcinoma cell lines 5-8F and 6-10B[J].Cancer Genet Cytogenet,2010,196(1):23-30.
[11]尹巧云,李 力,于红静,等.小分子蛋白慢病毒表达系统的构建[J].中国癌症防治杂志,2011,3(4):271-276.
[12]Ring KL,Connor EV,Atkins KA,et al.Women 50 years or younger with endometrial cancer:the argument for universal mismatch repair screening and potential for targeted therapeutics[J].Int J Gynecol Cancer,2013,23(5):853-860.
[13]De Sarrau B,Clavel T,Bornard I,et al.Low temperatures and fermentative metabolism limit peptidoglycan digestion of Bacillus cereus.Impact on colony forming unit counts[J].Food Microbiol,2013,33(2):213-220.
[14]Pfeiffer RM,Park Y,Kreimer AR,et al.Risk prediction for breast,endometrial,and ovarian cancer in white women aged 50 year or older:derivation and validation from population-based cohort studies[J]. PLoS Med,2013,10(7):e1001492.
[2014-04-15收稿][2014-05-21修回][编辑 阮萃才]
Lentivirus-mediated LKB1 gene expression in HEC-1A endometrial cancer cells
TANG Qiao-qiao△,SONG Yue△,LONG Yin,ZHANG Jie-qing,SONG Hong-lin,ZHAO Bing-bing(Department of Gynecology Oncology,Affiliated Tumor Hospital of Guangxi Medical University;△Graduate School of Guangxi Medical University,Nanning 530021,P.R. China)
Corresponding auther:SONG Hong-lin.E-mail:gxwskj@163.com
Objective To investigate lentivirus-mediated LKB1 gene overexpression in HEC-1A endometrial cancer cells as a basis for future research.Methods The LKB1 gene was subcloned by RT-PCR from a cDNA plasmid into a lentiviral pWPI expression vector,generating the plasmid LKB1/pWPI.This plasmid was co-transfected into 293T cells together with the packaging plasmid pCMV-Dr8.74 and pMD2.G.The recombinant virus was used to infect HEC-1A cells,and LKB1 expression was measured using realtime quantitative PCR(qRT-PCR)and Western blotting.Results We succeeded in constructing the recombinant plasmid LKB1/ pWPI and packaging it into lentiviral particles in 293T cells.This virus infected HEC-1A cells efficiently,leading to higher LKB1 expression than in the parental cells or untransfected controls(P<0.01).Conclusion The LKB1 gene has been incorporated into a lentiviral expression vector,allowing studies of its effects on the development of endometrial cancer.
Uterine neoplasm;Endometrial cancer;LKB1;Lentivirus
R737.33
A
1674-5671(2014)02-06
10.3969/j.issn.1674-5671.2014.02.07
广西研究生教育创新计划项目(1059820111002D29)【通信作者】宋红林。E-mail:shlt03@aliyun.com
