卡托普利对兔心房组织Cx40、Cx43表达增龄性变化的影响
2014-06-28陈春燕韩新源酉鹏华孙超峰
陈春燕,韩新源,酉鹏华,程 功,孙超峰
(1. 西安交通大学医学院第一附属医院心血管内科,陕西西安 710061;2. 陕西省人民医院心内科,陕西西安 710068)
心房颤动(atrial fibrillation, AF)的发病率呈现随年龄的增长而增加的趋势[1]。心房组织的结构和功能有明显的增龄性衰退现象,表现为与衰老有关的心房纤维化、脂肪沉积等退行性改变,这些改变可以导致心房组织重构,从而为增龄相关性房颤的发生提供基质。缝隙连接(gap junction)是心肌细胞电信号快速传导的低电阻通道,确保心肌电机械活动的同步。研究发现,缝隙连接蛋白(connexin,Cx)重构与房颤的发生和维持关系密切[2],但其在心房组织中的表达是否存在增龄性改变目前尚不清楚。近年来研究发现,肾素-血管紧张素系统(renin-angiotensin system, RAS)对房颤的发生和维持具有促进作用,阻断RAS的药物能够抑制房颤时的心房重构[3],但其是否能够抑制增龄所致心房重构的研究报道甚少。本实验通过观察不同年龄段家兔心房组织细胞Cx表达的增龄性变化,探讨衰老对心房肌Cx表达的影响,并研究卡托普利干预是否能够逆转这种增龄性变化,为增龄性房颤的防治提供一定的理论依据。
1材料与方法
1.1动物与材料健康家兔24只(由西安交通大学医学院实验动物中心提供),雌雄不限。卡托普利(商品名:开博通,百时美施贵宝公司生产);血管紧张素ⅡELISA试剂盒(美国R&D公司);Cx40多克隆抗体(美国Santa Cruz公司);Cx43多克隆抗体(英国Abcam公司);反转录试剂盒(宝生物工程大连有限公司,TaKaRa Code:DRR037S);实时定量聚合酶链反应试剂盒(宝生物工程大连有限公司,TaKaRa Code:DRR081A)。
1.2分组及给药方法健康家兔分为3组:青年组(4~6月)、老年组(30~34月)、老年+卡托普利干预组,每组8只。老年干预组给予卡托普利5.5 mg/(kg·d),用生理盐水稀释后灌胃给药8周;非给药老年组及青年组均以等容量的生理盐水灌胃。
1.3体表心电图的测定家兔麻醉后,固定在实验台上,连接好导线后,记录体表Ⅱ导心电图,采用分析软件测量心率(HR)和P波时限,包括最大P波时限(Pmax)、最小P波时限(Pmin),计算P波离散度(Pd)、P波平均时限(Pa)。
1.4心房组织AngⅡ含量的测定取出之前置于液氮中的组织,称取约100 mg,将组织加入适量的生理盐水捣碎。2 000 g离心10,取上清液。采用兔(Rabbit)ANG-ⅡELISA检测试剂盒测定心房组织AngⅡ的含量,实验按照说明书进行。
1.5Real-timePCR法检测Cx40、Cx43的基因表达用Trizol提取心房组织总RNA,紫外分光光度法测定所抽提RNA的浓度以及A260/280值,A260/280值在1.8~2.0则视为纯度很高,可以进行下一步操作。按照TaKaRa反转录试剂盒说明进行反转录反应,反应条件为:37 ℃ 15 min(反转录反应),85 ℃ 5 s(反转录酶的失活反应)合成cDNA。以NCBI GenBank提供的GAPDH、Cx40、Cx43的cDNA序列为模板,由北京三博远志生物科技公司合成引物。引物序列如下:Cx40:上游:5′-ACGTCTGCAGCATTGTCATC-3′;下游:5′-CCCAGGTGGTAGAGTTCAGC-3′;Cx43:上游:5′-CTTGCTGCGAACCTACATCA-3′;下游:5′-AGAGGAAGCAGTCCACCTGA-3′;GAPDH:上游:5′-GCGCCTGGTCACCAGGGCTGCTT-3′;下游:5′-TGCCGAAGTGGTCGTGGATGACCT-3′。按照TaKaRa Real-time PCR 试剂盒操作说明进行反应,采用三步法PCR扩增程序,第一步95 ℃ 3 min,第二步PCR反应95 ℃ 10 s,59 ℃ 30 s,72 ℃ 30 s,40个循环,第三步55 ℃ 10 s,81个循环。扩增曲线完成后自动生成融解曲线,反应完成后确认扩增曲线和融解曲线。根据Bio-Rad iQ5 Real-time PCR仪软件得出的各个样本的CT值,按照2-△△Ct法计算各个基因的相对表达量;用20 g/L的琼脂糖凝胶电泳检验PCR产物,只有单一的扩增条带,未见引物二聚体等非特异性条带,说明扩增反应是特异的。
1.6Westernblot测定Cx40、Cx43的蛋白表达提取心房组织蛋白并定量分析,按每泳道加总蛋白20 μg进行SDS-PAGE凝胶电泳,电泳后用半干转印法转移至硝酸纤维素膜上,用TBST液封闭后加入1∶1 000稀释的Cx40和1∶1 600稀释的Cx43一抗,4 ℃孵育过夜。洗膜后加入辣根过氧化物酶标记二抗室温孵育1 h,与显色剂(A∶B=1∶1)于暗处反应5 min,后利用Chemidoc化学发光仪显影成像,以BIO-RAD公司的Quantity One成像分析系统进行WB条带的灰度值分析。以目的蛋白与内参蛋白β-actin比值作为目的蛋白的相对表达量。
2结果
2.1各组家兔体表心电图测定结果的比较与青年组相比,老年组家兔心率明显下降(P<0.01),P波的Pmax、P min、Pd和Pa均显著延长(P均<0.01),而老年干预组与老年组相比心率增快,差异有统计学意义(P<0.05),反应P波的各指标均有明显的恢复(P均<0.05,表1)。
表1 各组家兔心电图特征的比较
与青年组比较,*P<0.01;与老年组比较,#P<0.05。
2.2各组家兔心房组织AngⅡ含量的比较老年组心房组织AngⅡ浓度明显高于青年组(P<0.05)。而老年卡托普利干预组心房组织AngⅡ质量浓度较老年组明显降低(P<0.05,图1)。
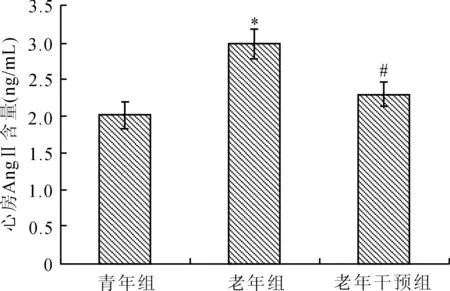
图1 各组家兔心房组织AngⅡ含量的比较
2.3家兔心房组织Cx40、Cx43mRNA表达的比较实验数据采用2-△△Ct的方法进行处理,家兔心房组织中Cx40和Cx43 mRNA的表达水平以Cx/GAPDH表示。与青年组比较,老年组Cx40及Cx43 mRNA水平明显降低(P<0.01);而卡托普利干预后心房组织Cx40、Cx43的表达则明显增加(P<0.05,图2)。
2.4家兔心房组织Cx40、Cx43蛋白的定量分析Western blot检测结果与Real-time PCR结果一致。老年组Cx40表达较青年组减低(P<0.01,n=8),Cx43表达亦下降(P<0.01);卡托普利干预后,Cx40和Cx43蛋白的表达较未干预组则均有所回升(P<0.05,图3)。
3讨论
本研究发现,随着年龄的增长Pmax延长,Pd增大。Pmax增加表明心房内或心房间传导时间延长,标志着心房内传导紊乱[4];而Pd是心房非均质电活动的离散程度的反映,用来预测房性心律紊乱,尤其是房颤[5-6]。本研究结果提示,心房内激动传导速度随着年龄增长而显著减慢,说明心房兴奋传导条件随年龄增加而恶化,均可作为房颤的预测指标,说明在老龄阶段较易发生房颤。
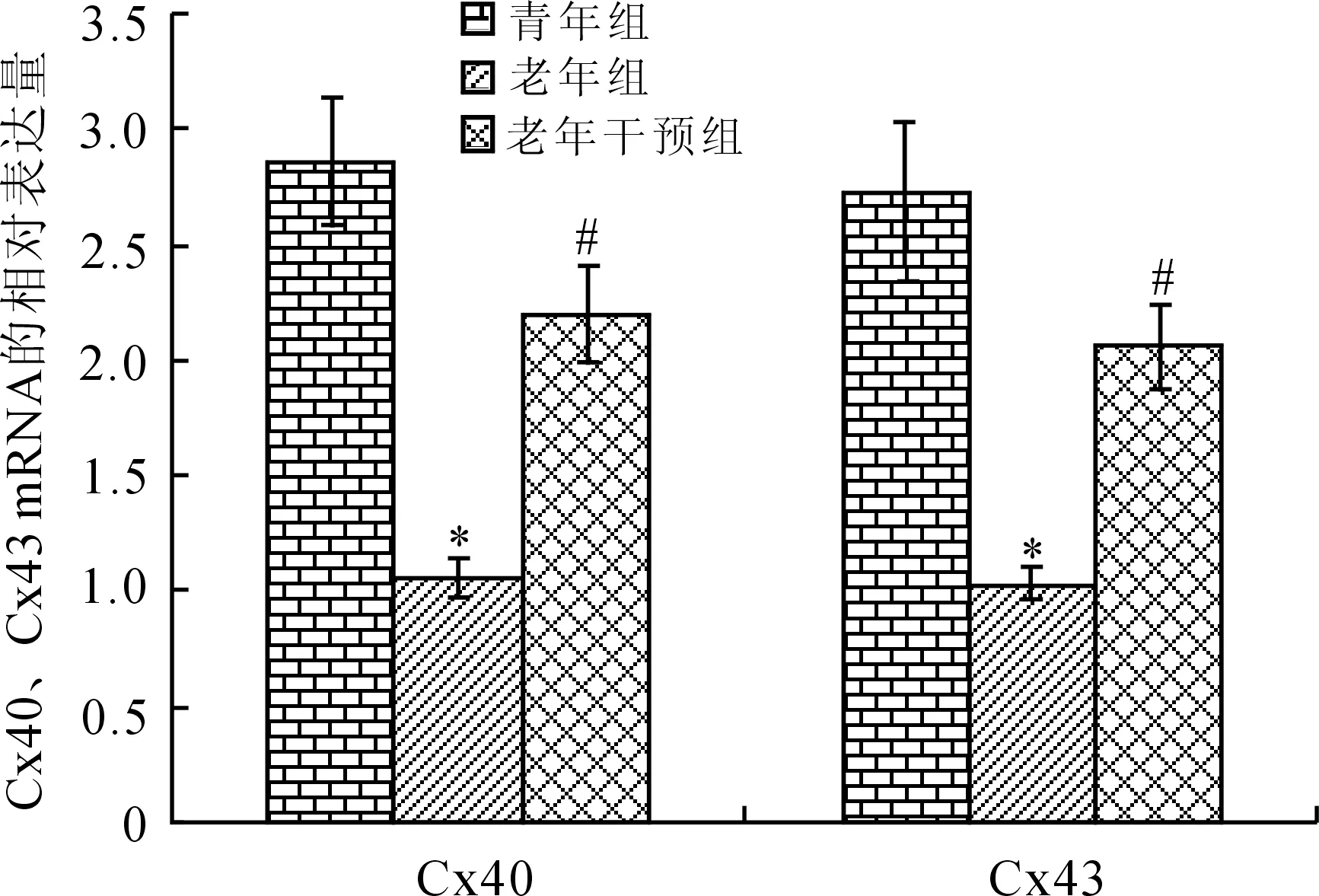
图2 Cx40、Cx43 mRNA相对表达量的比较
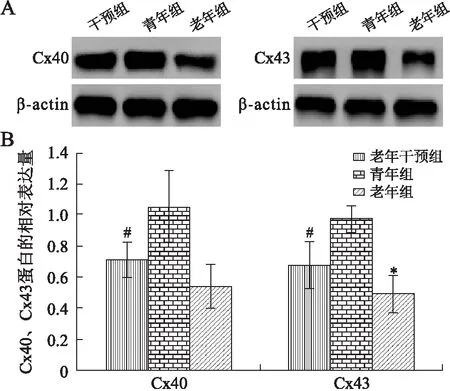
图3 各组Cx40、Cx43蛋白表达量的比较
近年来,大量研究显示RAS的激活与房颤的发生、维持密切相关[7]。AngⅡ是RAS最主要的活性产物。GOETTE等[8]研究发现,房颤患者局部心房组织AngⅡ水平是普通窦性心律患者的3倍。心肌组织中AngⅡ含量增高, 被认为是房性心律失常发生的重要诱发因素[9]。随着对房颤发生机制研究的逐步深入,发现AngⅡ不仅可导致 ERP 明显缩短,参与促进了心房的电重构;而且AngⅡ还能与ATl结合后,通过激活各种磷脂酶及丝裂原活化蛋白酶(MAPK),诱导生长相关的转录因子过度表达,从而引起心脏的间质增生,最终使心房发生结构重构[10]。以上这些改变都是构成AF发生的重要基础。本研究发现,随着增龄,心房组织AngⅡ的含量增加,提示AngⅡ介导的心房重构可能参与了增龄性房颤的发生。
房颤发生与维持的经典机制是折返机制,心房传导速度减慢和(或)心房不应期缩短,可能是心房内折返形成的基础。增强组织的兴奋性或减少电流阻力均可以提高心肌的传导速度。细胞间缝隙连接作为细胞间的一种特殊通道介导着细胞间电和化学信号的传递,在维持电和机械偶联,以及确保心肌协调收缩方面起着重要作用[11]。各种病理改变引起的缝隙连接蛋白的分布、表达量以及种类的变化都可以引起传导速度和传导各向异性发生改变,这就为心律失常的发生提供了基础[12]。心房肌细胞间缝隙连接主要由Cx40、Cx43构成。本研究发现,随着增龄心房组织中Cx43和Cx40的表达逐渐减少。增龄引起心房肌Cx表达降低,导致细胞间电耦联性的进一步下降,改变了心肌的电传导性,使传导速度减慢或发生传导阻滞的程度加重,易于形成折返,折返的普遍存在,促成多子波折返的出现,为AF的发生提供基质[13]。
大量的临床研究表明,RAS阻断剂血管紧张素转化酶抑制剂(ACEI)/血管紧张素Ⅱ受体拮抗剂(ARB)可以预防房颤的发生[14]。其机制可能与ACEI/ARB抑制心房局部及循环中AngⅡ的分泌和活性,减轻心房结构重构和电重构,进而减少了房颤的发作[15]。本研究结果显示,老年家兔采用卡托普利进行干预后,体表心电图Pa以及Pd均缩短,心房组织AngⅡ浓度降低,Cx40、Cx43 mRNA以及蛋白表达增加。已有研究发现,AngⅡ含量长期升高可能通过激活 ERK通路的ERK1/2,最终导致心肌纤维化和Cx40重构[16]。通过基因治疗增加心房组织Cx40、Cx43的表达可以维持心房的传导速度,预防房颤的发生[17]。因此,我们推测卡托普利可以通过减少心房组织AngⅡ浓度,减轻心房Cx的重构,从而改善了细胞间的耦联和传导,使心房的传导时间以及非均质电活动的离散程度缩短,消除了折返性心律失常的病理基础,最终可能发挥防治增龄性房颤的作用。本研究结果为增龄性房颤的发生机制及防治提供了一定的理论基础。
参考文献:
[1] SCHNABEL RB. Can we predict the occurrence of atrial fibrillation[J]. Clin Cardiol, 2012, 35(Suppl 1):S5-S9.
[2] KATO T, IWASAKI Y, NATTEL S. Connexins and atrial fibrillation: Filling in the gaps[J]. Circulation, 2012, 125:203-206.
[3] ZOGRAFOS T, KATRITSIS DG. Inhibition of the renin-angiotensin system for prevention of atrial fibrillation[J]. PACE, 2010, 33(10):1270-1285.
[4] KOSAR F, AKSOY Y, ARI F, et al. P wave duration and dispersion in obese subjects[J]. Ann Noninvasive EIectrocardiol, 2008, 13(1):3-7.
[5] PERZANOWSKI C, HO AT, JACOBSON AK. P wave dispersion predicts recurrent atrial fibrillation after cadioversion[J]. Electrocardiol, 2005, 38(1):43-46.
[6] 陈娟,黄从新. P波与高血压病阵发性心房颤动的关系[J]. 中华心律失常学杂志, 2005, 9(5):400.
[7] SCHNEIDER MP, HUA TA, BOHM M, et al. Prevention of atrial fibrillation by renin-angiotensin system inhibition: A meta-analysis[J]. J Am Coll Cardiol, 2010, 55(21):2299-2307.
[8] GOETTE A, ARNDT M, ROCKEN C, et al. Regulation of angiotensin II receptor subtypes during atrial fibrillation in humans[J]. Circulation, 2000, 101:2678-2781.
[9] OLSEN KB, BRAUNSTEIN TH, SORENSEN CM, et al. Angiotensin II does not acutely regulate conduction velocity in rat atrial tissue[J]. Scand J Clin Lab Inv, 2011, 71(6):492-499.
[10] KOSTIN S, KLEIN G, SZALAY Z, et al. Structural correlate of atrial fibrillation in human patients[J]. Cardio Res, 2002, 54:361-379.
[11] SAFFITZ JE, DOUGLAS P. Zipes lecture: biology and pathobiology of cardiac connexins: from cell to bedside[J]. Heart Rhythm, 2006, 3:102-107.
[12] TRIBULOVA N, KNEZL V, OKRUHLICOVA L, et al. Myocardial gap junctions: targets for novel approaches in the prevention of life-threatening cardiac arrhythmias[J]. Physiol Res, 2008, 57(suppl 2):S1-S13.
[13] WAKILI R, VOIGT N, KAAB S, et al.Recent advances in the molecular pathophysiology of atrial fibrillation[J]. J Clin Invest, 2011, 121:2955-2968.
[14] LI TJ, ZANG WD, CHEN YL, et al. Renin-angiotensin system inhibitors for prevention of recurrent atrial fibrillation: a meta-analysis[J]. Int J Clin Pract, 2013, 6(67):536-543
[15] ZOGRAFOS T, KATRITSIS DG. Inhibition of the rennin angiotensin system for prevention of atrial fibrillation[J]. Pacing Clin Electrophysiol, 2010, 33(10):1270-1285.
[16]王智刚,张卫泽,马凌,等. 抑制ERK1/2通路激活改善大鼠心房纤维化和缝隙连接蛋白40重构[J]. 第二军医大学学报, 2012, 33(3):259-264.
[17] IGARASHI T, FINET JE, TAKEUCHI A, et al. Connexin gene transfer preserves conduction velocity and prevents atrial fibrillation[J]. Circulation, 2012, 125:216-225.
