应用基因芯片技术筛选克山病差异表达基因
2014-06-28何淑兰雷艳霞谭武红朱延河
王 斌,何淑兰,雷艳霞,谭武红,张 峰,王 盼,朱延河,郭 雄
(西安交通大学医学院公共卫生系,环境与疾病相关基因教育部重点实验室,陕西西安 710061)
克山病(Keshan disease, KD)是一种原因不明的地方性心肌病,以心肌损伤为主要特征,主要侵犯妇女与学龄前儿童,主要特点为可导致心源性休克与充血性心力衰竭的多灶性心肌坏死与纤维化[1],临床表现为心脏增大,心力衰竭,不同程度的急、慢性心功能不全及心率失常。调查显示,KD病区内环境与外环境硒含量较低,病区居民处于低硒状态,其血硒、尿硒及发硒的含量均低于非病区居民[2]。硒缺乏被公认是KD发病的相关因素,但不是KD发病的唯一因素[3]。KD具体的分子发病机制尚不清楚,目前普遍认为KD是环境因素(低硒、粮食真菌感染[4])与多基因共同作用的结果。基因芯片(gene chip或DNA microarray)是以基因序列为分析对象,基于核酸互补杂交原理所研制的DNA芯片[5],具有高通量、并行性、微量化和自动化等特点,成为近些年来发展非常迅速、应用最广泛、技术最成熟的生物技术之一[6]。本研究采用全基因组表达谱芯片技术,对比KD患者与病区对照者基因表达谱的变化,筛选出与KD相关的差异表达基因,并对这些基因进行功能及通路分析,进一步探讨KD发病的分子机制。
1材料与方法
1.1研究对象与分组以陕西省克山病病区黄陵县和旬邑县为调查点,依据我国《克山病临床诊断标准》(WS/T 210-2011),按照病例与对照年龄相近、性别相同进行1∶1配对,研究对象年龄在20~70岁之间。从43例KD患者中共选出16例KD患者,8例慢型KD[男2例,女6例,平均年龄(49.1±7.0)岁],8例潜在型KD[男2例,女6例,平均年龄(46±9.5)岁];从33例病区正常对照中选择16例[男4例,女12例,平均年龄(49.7±8.3)岁],组成16对,经统计学检验KD组与对照组年龄无统计学差异。再按照每4例病例(慢型、潜在型各2例)为一组,每4例对照为一组,共8组。所有入选对象均经临床检查、心电图、心脏超声、心功能检查、X线胸部正位摄片检查。同时排除其他心肌病及其他疾病。采集肘静脉血5 mL,加入保护剂,-80 ℃冰箱低温保存。所有患者均已签署知情同意书。
1.2方法
1.2.1总RNA的提取和测定 Trizol一步法提取血样总RNA,每组4例样品RNA按等量混合以消除个体差异,共形成8组混合RNA样。采用Qiagen公司的RNA纯化试剂盒(RNeasy Midi Kit)进行纯化收集,甲醛变性凝胶电泳检测总RNA中28S rRNA和18S rRNA比例,以检测RNA样品的质量。用紫外分光光度计检测RNA的含量和浓度。RNA合格后可用于芯片检测。
1.2.2基因芯片杂交 采用Lifegen公司的RNA扩增与荧光标记试剂盒,将提取的总RNA逆转录为cRNA,并进行荧光标记,操作步骤严格按照试剂盒说明进行。采用Agilent公司的人类全基因组表达芯片(Human 4×44K Whole Genome microarray, G4112F)进行基因芯片杂交,该芯片共包含44 290个寡聚核苷酸探针,杂交过程严格按照基因芯片操作说明与步骤进行。基因芯片杂交所用试剂均购自Agilent公司。采用GenePix4000B Scanner扫描基因芯片杂交图像,采用GenePix 3.0和Spotfire 8.0软件分析芯片杂交图像,进行信号识别、数据分析和质量控制。
1.2.3实时定量PCR验证 收集6例KD患者和6例正常对照,病例和对照均来自芯片实验样本同一地区,采用芯片实验相同方法提取总RNA,采用RNA逆转录试剂盒(RevertAidTMreverse transcriptase),将提取的总RNA逆转录成cDNA。随机挑选其中3个差异表达基因HBA2、APOA1、BCL2L1进行芯片数据验证。引物参照GenBank数据库基因序列进行设计(表1)。以GAPDH为内参照,采用美国Bio-Rad公司的iQ5TMReal-Time PCR Systems进行实时定量PCR分析。反应条件:94 ℃预变性5 min,94 ℃ 30 s,60 ℃/55 ℃(HBA2)30 s,72 ℃ 30 s,45个循环。
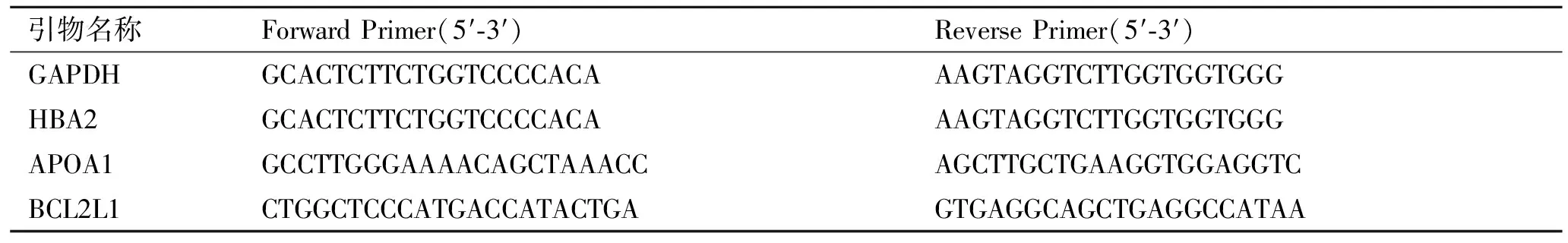
表1 引物序列
1.3芯片数据分析SAM4.0软件进行单基因表达分析。SAM软件设置参数:Two class unpaired方法,Minimum Fold Change=2,同时False Discovery Rate(%)<5%的标准筛选差异表达基因。IPA(ingenuity pathways analysis)软件对差异表达基因进行通路和功能分析。
2结果
2.1总RNA的抽提结果样品RNA的A260/280值均在1.79~1.99之间。由图1可见,总RNA电泳条带清晰,28S比18S rRNA条带亮度接近2∶1,说明纯度高,未降解,可以满足后续实验需要。

图1 样品的总RNA甲醛凝胶电泳图谱
2.2芯片检测结果KD患者与正常对照相比,共得出78个差异表达基因,其中表达上调的有59个(表2),表达下调的有19个(表3)。通过查询各基因的功能发现,与代谢相关的基因有14个,上调的有9个,下调的有5个;与转录相关的基因有7个,上调的有5个,下调的有2个;与离子通道与运输蛋白相关的基因有6个,上调的有4个,下调的有2个;与蛋白合成与修饰相关的基因有5个,上调的有4个,下调的有1个;与信号转导相关的基因有5个,上调的有2个,下调的有3个(表4)。
2.3实时定量PCR验证在KD患者78条差异表达的基因中,随机选取3个基因进行荧光定量RT-PCR检测。结果显示,BCL2L1、APOA1表达上调,HBA2表达下调。经比较其相对表达率,并与芯片结果进行比较,可以确认芯片与荧光定量PCR比较基因表达差异趋势完全符合,表明基因芯片结果准确可靠(图2)。
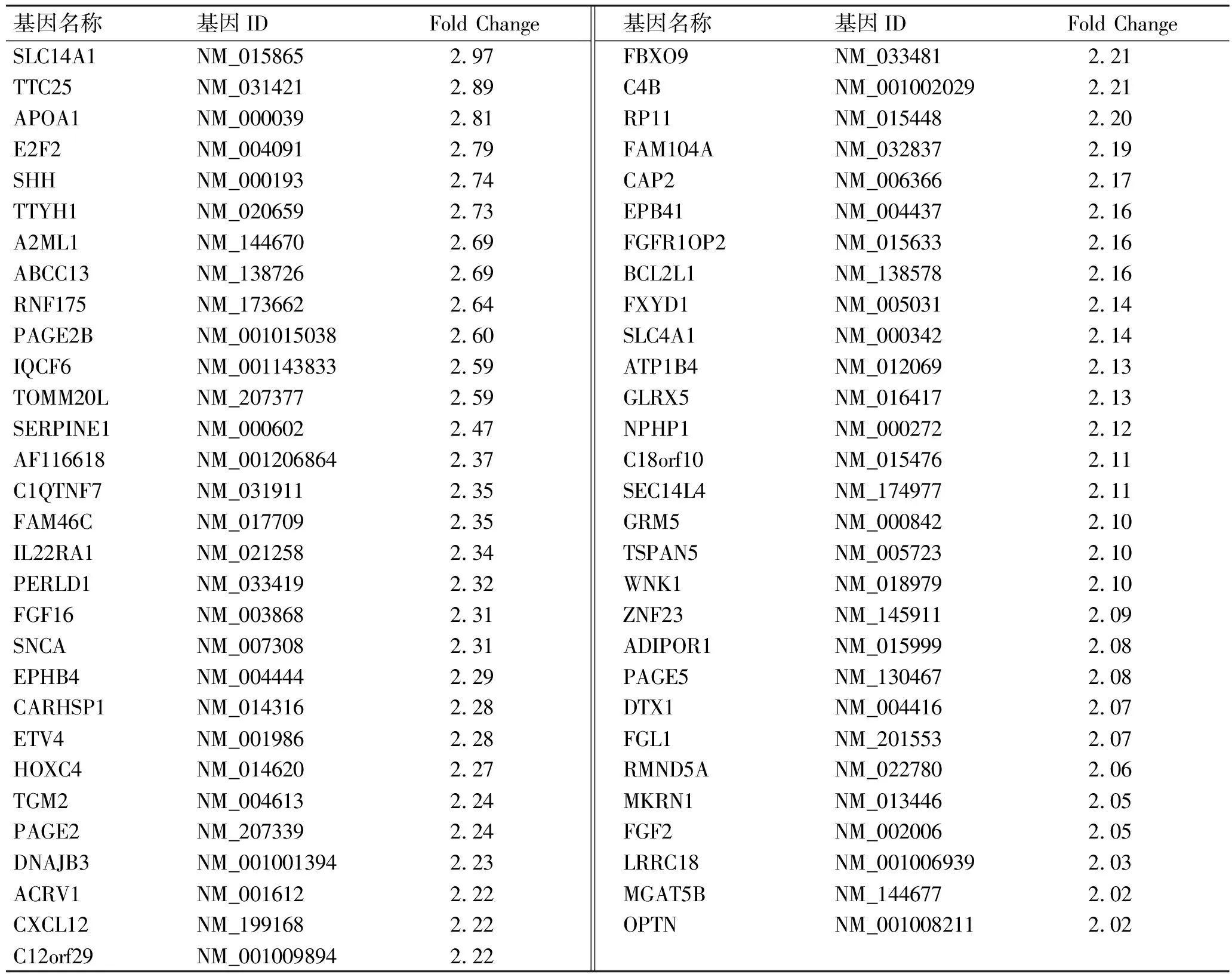
表2 KD患者差异表达上调的基因
Fold Change表示KD患者和正常对照中基因表达信号强度的比值。
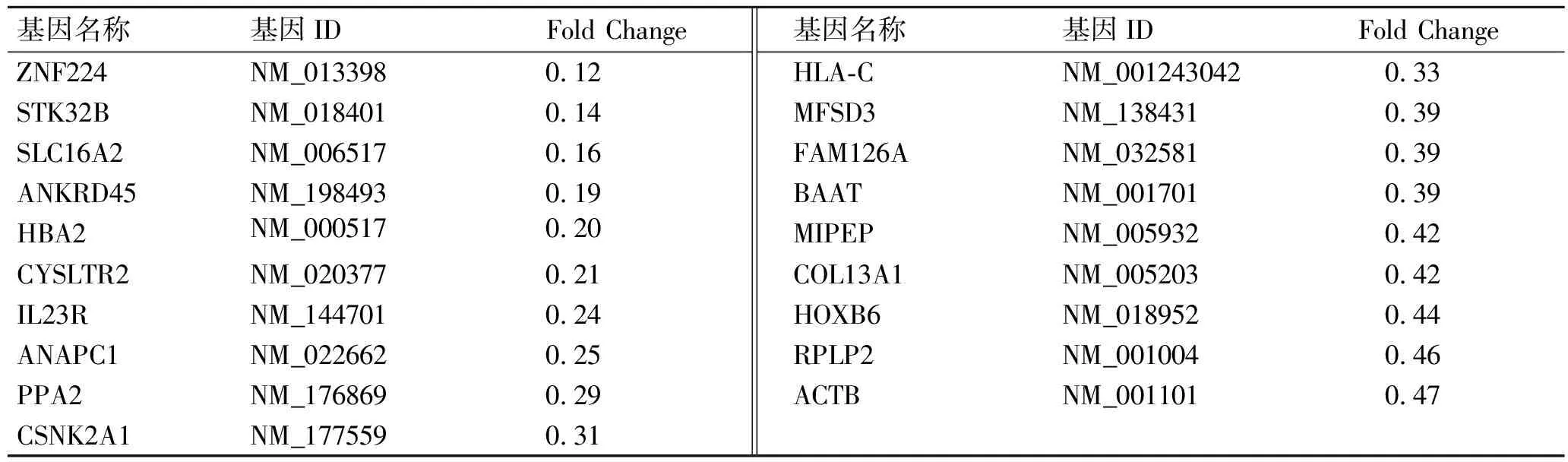
表3 KD患者差异表达下调的基因
Fold Change表示KD患者和正常对照中基因表达信号强度的比值。

表4 KD患者和正常对照差异表达基因的功能分析
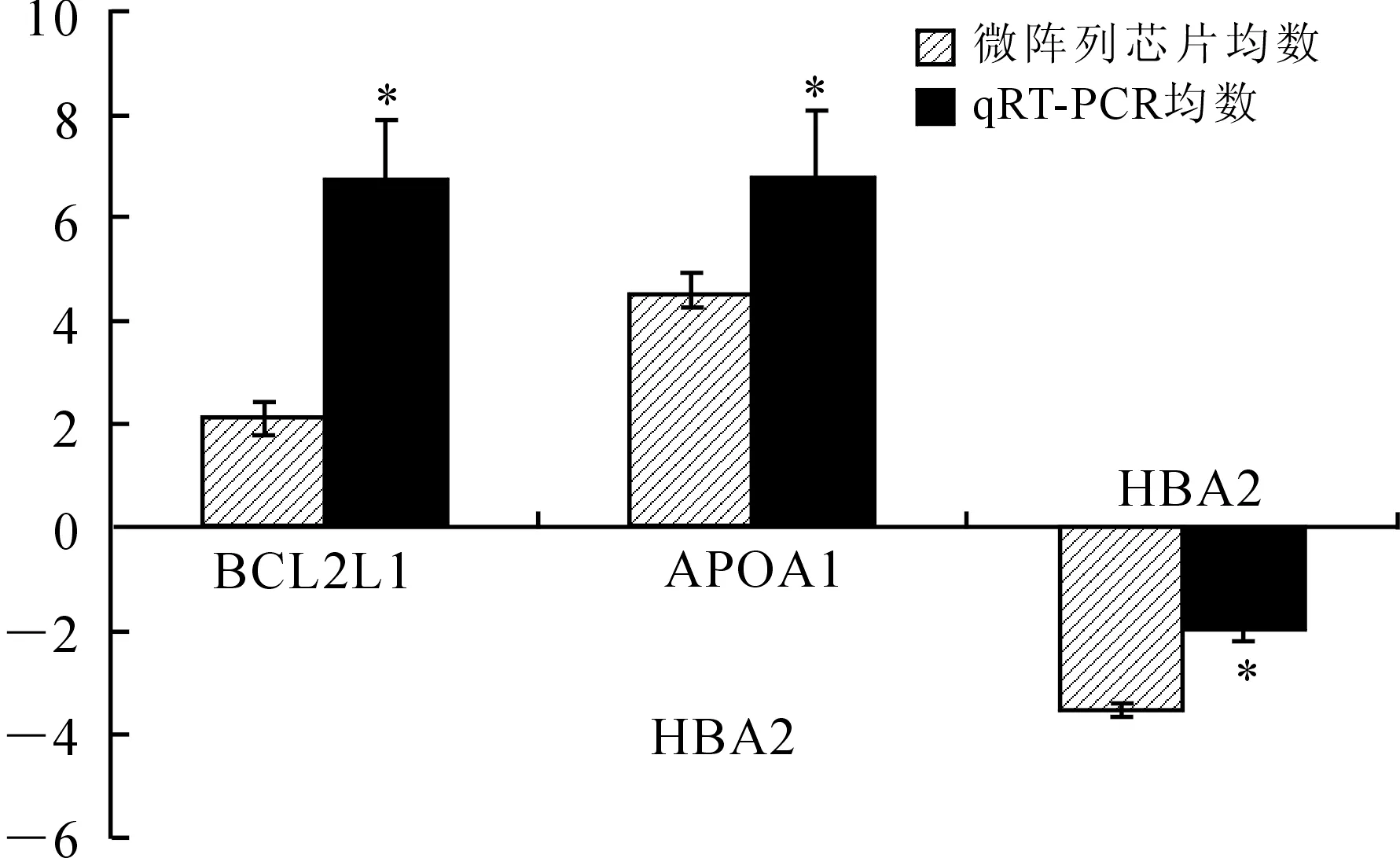
图2 验证KD患者差异表达基因
2.4IPA分析结果78例KD患者差异表达基因经IPA功能分析,获得5个显著的生物功能(表5),主要涉及细胞凋亡、细胞功能修复、分子转运、细胞间信号转导、细胞增殖和分化,其中以细胞功能修复相关的表达基因最多(26个基因);经IPA分析获得主要的相关通路有9条(表6)。
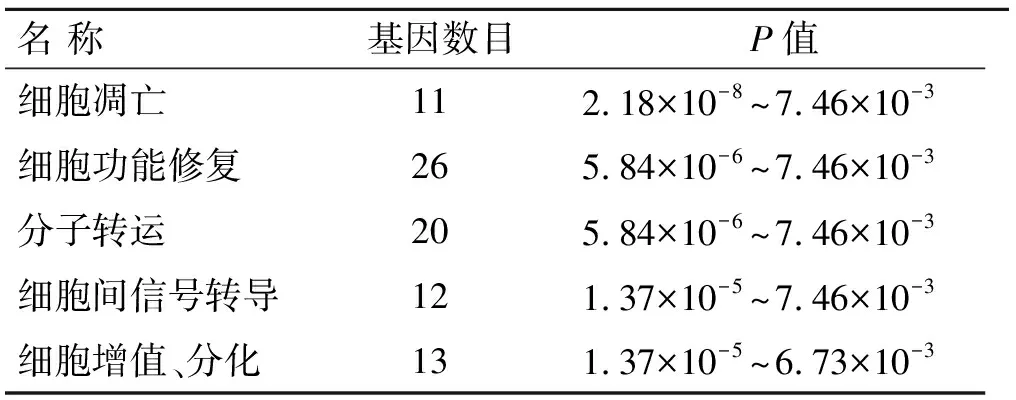
表5 KD患者差异表达基因的生物功能IPA分析
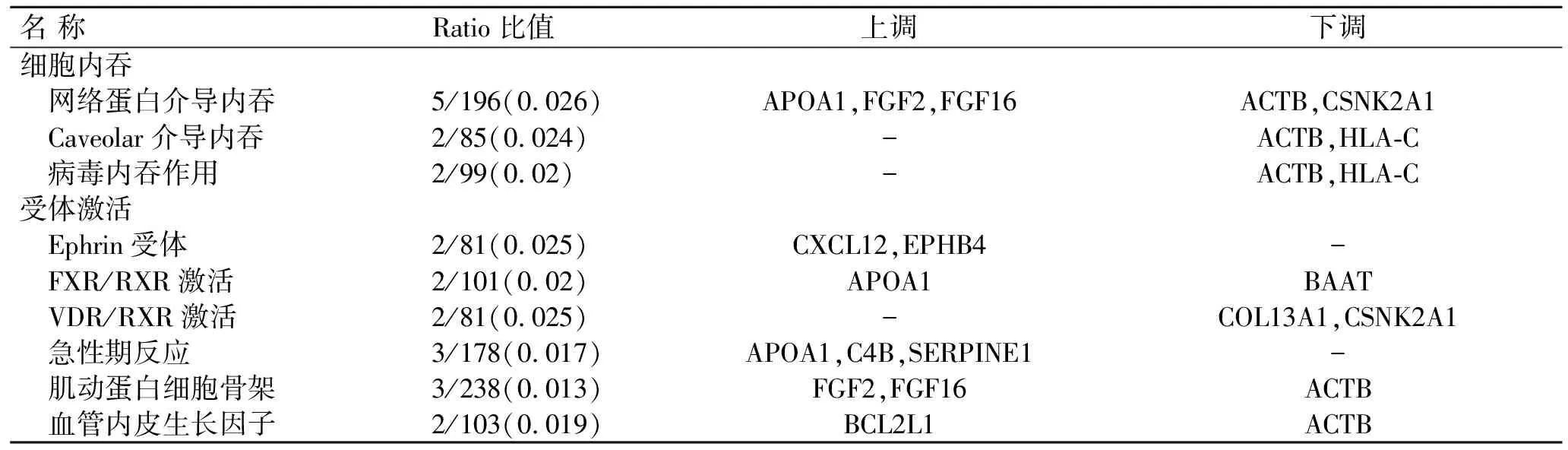
表6 KD患者差异表达基因的相关主要通路IPA分析
Ratio比值表示KD相关基因在该通路所有基因中所占的比例。
3讨论
本研究利用全基因组表达芯片技术,比较了KD患者和病区正常对照外周血单核淋巴细胞基因表达谱的差异,筛选出多个显著差异表达的基因。与细胞凋亡相关的差异表达基因有11个,其中,上调的10个,下调的1个;和细胞功能修复相关表达基因有26个,上调的23个,下调的3个。这些基因的表达差异可能与KD患者心肌实质的变性、坏死及其后的吸收修复相关。实时定量PCR验证了3个基因,结果与基因芯片表达趋势吻合,还需要用大样本量进一步验证基因芯片结果的准确可靠。
在KD患者心肌病理切片中发现,心肌组织中可见散在的凋亡细胞[7]。另有研究显示,细胞凋亡及Desmin结构蛋白的异常同时出现于亚急型KD患者的心肌组织中[8]。这些研究表明心肌细胞凋亡在KD的发生发展中扮演了重要角色。BCL2L1是Bcl-2基因家族的一员,BCL2L1基因家族及其相关蛋白Bcl-2是研究最早的与凋亡有关的基因[9]。BCL2L1是细胞凋亡调控的一个重要基因,其编码的的蛋白位于细胞线粒体外膜,调节线粒体外膜通道(VDAC)开放,VDAC调节线粒体膜电位,从而控制活性氧的产生和线粒体细胞色素C的释放。这两种物质都可以很强地诱导细胞凋亡,从而使心脏陷于缺血、缺氧状态。心脏是一个耗氧旺盛的代谢器官,在生理条件下心肌细胞内氧自由基累积的机会就明显高于其他组织。一旦由于某些原因使心脏陷于缺血、缺氧状态,将使心脏的氧平衡和自由基平衡遭受破坏,呼吸链中氧化反应与磷酸化过程的偶联状态不能顺利进行,造成自由基在心肌线粒体中大量堆积,直接诱发线粒体DNA的结构和功能代谢的紊乱[10]。线粒体的紊乱又会加重心肌缺血、缺氧,使心肌细胞始终处在缺血、缺氧环境中,形成长期的恶心循环。凋亡细胞主要分布在克山病心肌组织坏死灶周围、乳头肌、心内膜下心肌,血管内皮细胞中也可见散在凋亡细胞。大量的心肌表观学研究表明,心肌细胞凋亡在克山病的发生发展中扮演了重要角色。因此,推测BCL2L1基因的表达上调可能与KD患者心肌细胞线粒体代谢紊乱、长期处于缺血、缺氧状态,最终导致心肌细胞变性、坏死相关。
HBA2基因在KD患者中表达下调。2条α链(HBA)与2条β链(HBB)组成血红蛋白(HBA),成人体内大约97%的总血红蛋白均由HBA构成。单个α链与β链组成HBA2,HBA2与胎儿血红蛋白共同构成总血红蛋白剩余的3%。KD患者红细胞含硒量明显低于正常人,并且红细胞及红细胞膜结构异常[11]。硒及其化合物是一种抗氧化剂,含硒的谷胧甘肤过氧化物酶可催化脂质氢过氧化物和过氧化氢的降解,防止其对红细胞膜的损害,保持红细胞膜的完整性和稳定性。因此,推测红细胞内低硒可能抑制HBA2基因的表达,也可能低硒与HBA2基因的下调共同作用于KD患者的红细胞膜,使其结构异常。
ACTB基因编码6种不同的肌动蛋白,是具有高度保守性蛋白质分子之一。肌动蛋白是构成生物体中微丝的一个单节结构,而微丝则是细胞骨架三大组成结构之一。肌动蛋白参与细胞运动、细胞间信息的传递,以及细胞形状与连结的建立和维持等等。红细胞膜的肌动蛋白也是红细胞膜骨架组分之一,对维持细胞外形与稳定红细胞结构也具有一定的作用。杨福愉等[11]研究结果显示,KD患者红细胞膜肌动蛋白与膜的结合程度低于正常对照组,红细胞膜也发生一定的异常,红细胞膜骨架的血影收缩蛋白的聚合状态,肌动蛋白的结合程度,膜脂“头部”运动自由度等都与对照有明显的差异。KD患者红细胞的这些变化很可能与ACTB基因的下调相关。
CSNK2A1是一种信号转导相关基因,表达产生的蛋白激酶CK2,即酪蛋白激酶Ⅱ,是一种真核细胞中普遍存在的信使非依赖性丝氨酸/苏氨酸蛋白激酶,可以调控许多细胞进程,如细胞生存、生长、增殖及凋亡。已有研究显示,CK2的表达下调可以诱导癌细胞的凋亡[12];p38促蛋白激酶家族与心肌细胞肥大、凋亡相关[13]。因此,推测CSNK2A1基因的表达下调可能与KD患者心肌细胞病变相关。在本次研究中CSNK2A1基因又是网络蛋白介导的内吞作用信号通路中的下调基因。网络蛋白介导的内吞作用是包括登革病毒、丙型肝炎病毒、肠道病毒71型[14]等在内的许多病毒进入细胞的主要途径。研究显示,KD的心肌损伤与肠道病毒感染及细胞凋亡有高度相关性,这种凋亡细胞的出现可能和肠道病毒感染诱导有关[15]。当肠道病毒中的嗜心肌病毒经感染进入血液,其通过血管壁首先攻击的是心肌细胞。因此,推测CSNK2A1基因的表达下调可能会影响网络蛋白介导的内吞作用,促使肠道病毒进入心肌细胞,从而诱导心肌细胞变性、坏死。
目前,国内外还没有与KD相关差异表达基因的筛选研究,与KD有着相同低硒环境因素的大骨节病已有相关研究。总之,本研究采用全基因表达谱芯片技术,筛选出与KD相关的78个差异表达基因,这些差异存在于不同生物学过程(如细胞增殖、细胞凋亡、细胞功能修复等)中,其中BCL2L1的上调可能与凋亡、线粒体代谢紊乱、心肌长期处于缺血、缺氧状态,最终导致心肌细胞变性、坏死相关;HBA2基因和ACTB基因的的下调很可能与KD患者红细胞及红细胞膜的形态、结构和功能异常相关;CSNK2A1是信号转导相关基因,可诱导细胞凋亡,并且影响网络蛋白介导的内吞作用,促使肠道病毒进入心肌细胞,从而诱导心肌细胞变性、坏死。这些基因可能在KD病理机制中扮演重要作用。但由于血样中的单核淋巴细胞的差异基因并不能完全代表KD的差异表达基因,这些基因可能与心肌病变有关,也可能与KD患者机体的全身性反应相关,都还需要大样本量进一步实验验证。
参考文献:
[1] LEI C, NIU X, MA X, et al. Is selenium deficiency really the cause of Keshan disease?[J]. Environ Geochem Health, 2011, 33(2):183-188.
[2] YANG J, WANG T, WU C, et al. Selenium level surveillance for the year 2007 of Keshan disease in endemic areas and analysis on surveillance results between 2003 and 2007[J]. Biol Trace Elem Res, 2010, 138(1-3):53-59.
[3] 相有章. 克山病流行现状与病因研究近况[J]. 中国地方病学杂志, 2005, 24(4):463-465.
[4] SUN S. Chronic exposure to cereal mycotoxin likely citreoviridin may be a trigger for Keshan disease mainly through oxidative stress mechanism[J]. Med Hypotheses, 2010, 74(5):841-842.
[5] CHEN MH, IBRAHIM JG, CHI YY. A new class of mixture models for differential gene expression in DNA microarray data[J]. J Statist Planning Infer, 2008, 138(2):387-404.
[6] ROGLER CE, TCHAIKOVSKAYA T, NOREl R, et a1. RNA expression microarrays (REMs), a high-throughput method to measure differences in gene expression in diverse biological samples[J]. Nucleic Acids Res, 2004, 32(15):120.
[7] 钟学宽,于波,张邻杰,等. 克山病的心肌损伤与细胞凋亡[J]. 中国地方病学杂志, 1997, 16(2):81-82.
[8] 钱素娟,于维汉,余祖熙,等. 克山病患者心肌组织细胞凋亡及结构蛋白Desmin异常表达的研究[J]. 中国地方病学杂志, 1999, 19(2):81-83.
[9] MARKOU T, DOWLING AA, KELLY T, et al. Regulation of Bcl-2 phosphorylation in response to oxidative stress in cardiac myocytes[J]. Free Radic Res, 2009, 43(9):809-816.
[10] 贾春澎. 膳食低Se、低VE对克山病心肌纤维化和心肌重构的影响及其分子机制[D]. 吉林:吉林大学, 2011:3-5.
[11] 杨福愉,林治焕,沃维汉,等. 克山病患者红细胞膜的变化[J]. 科学通报, 1988, 20:1580-1582.
[12] WANG G, UNGER G, AHMAD KA, et al. Downregulation of CK2 induces apoptosis in cancer cells--a potential approach to cancer therapy[J]. Mol Cell Biochem, 2005, 274(1-2):77-84.
[13] WANG Y, HUANG S, SAH VP. et al. Cardiac muscle cell hypertrophy and apoptosis induced by distinct members of the p38 mitogen-activated protein kinase family[J]. J Biol Chem, 1998, 273(4):2161-2168.
[14] HUSSAIN KM, LEONG KL, NG MM, et al. The essential role ofclathrin-mediated endocytosis in the infectious entry of human enterovirus 71[J]. J Biol Chem, 2011, 286(1):309-321.
[15] 邹宁,周令望,钟学宽,等. 克山病的心肌损伤与肠道病毒感染及细胞凋亡关系的研究[J]. 中国地方病防治杂志, 1998, 13(6):324-327.
