hGPx-1-198Leu真核表达载体的构建与鉴定及在H9C2细胞中的表达
2014-06-28王素琴牛小麟朱延河高登峰
王素琴,牛小麟,朱延河,高登峰,林 琳
(西安交通大学医学院:1. 第二附属医院心内科,陕西西安 710004;2. 地方病研究所,陕西西安 710061)
谷胱甘肽过氧化物酶(glutathione peroxidase, GPx)家族是生物体内重要的抗氧化酶体之一,是生物体内重要的活性氧族(reactive oxygen species, ROS)清除剂。在我们前期研究中,雷聪等发现慢性克山病患者具有较高的GPx-1基因198位点的C-T多态性频率,GPx-1-198Leu等位基因型者患克山病的风险比GPx-1-198Pro等位基因型者增加123%,提示GPx-1基因198位点等位基因与克山病患病风险之间存在关联[1]。其他研究显示GPx-1基因198位点多态性与肺癌、乳腺癌、结肠癌、前列腺癌等癌症密切相关。而关于GPx-1-198Leu基因的体外研究为数不多。因此,在本研究中,我们拟通过构建含hGPx-1基因Pro198Leu多态的真核表达载体,并观察其对补充亚硒酸钠后在大鼠心肌细胞系H9C2中的反应性表达情况,为后续深入研究hGPx-1-198Leu基因在心血管及其他相关疾病中的作用与机制提供实验基础。
1 材料与方法
1.1质粒与菌株及主要试剂pEGFP-N3质粒、DH5α菌株和HEK293细胞由本实验室保存。H9C2细胞由西安交通大学医学院药理系藏伟进教授惠赠。BamHⅠ和NotⅠ限制性内切酶、DNA连接酶、RNAiso Plus(TaKaRa),PCR试剂(康为世纪公司);高糖DMEM培养基(Hyclone公司),胎牛血清(浙江天杭),TurboFectTM体外转染试剂(Fermentas公司);亚硒酸钠(Sigma公司);DNA Marker Ⅰ(北京天根);卡那青霉素(西安沃尔森)、酵母提取物、胰蛋白胨(OXOID公司)、琼脂糖和琼脂粉购于(DIFCO公司);OMEGA无内毒素质粒小提试剂盒(OMEGA公司);引物的合成及测序均由大连宝生物公司完成。羊抗人GPx-1多克隆抗体(Santa Cruz),辣根过氧化物酶(horseradish peroxidase,HRP)标记兔抗羊IgG二抗、兔抗β-actin多克隆抗体、HRP标记山羊抗兔IgG二抗(北京博奥森)。
1.2目的基因cDNA的合成根据GenBank上提供的人GPx-1基因序列号EC1.11.1.9,并考虑到GPx-1的翻译需要3’UTR茎环结构或硒代半胱氨酸插入序列(selenocystenine insertion sequence,SECIS),采用全基因合成获得目的基因cDNA,将198位点编码脯氨酸的密码子CCC改变为亮氨酸密码子CTC,包括从起始密码子到polyA尾信号及部分polyA尾,同时目的基因cDNA两端分别引入酶切位点,5端是BamHⅠ,3端是NotⅠ。
1.3重组质粒hGPx-1-198Leu的构建及质粒的转化限制性内切酶BamHⅠ和NotⅠ双酶切目的基因片段和pEGFP-N3质粒,用T4 DNA连接酶将酶切后的目的片段和质粒进行定向连接,用氯化钙法处理制备新鲜的大肠杆菌感受态细胞,之后将重组载体转化感受态细胞并涂于含卡那霉素的LB琼脂板,37 ℃倒置培养12~16 h,挑取单克隆,接种于3 mL含有卡那霉素抗生素的LB培养基中,37 ℃摇床培养8~12 h至对数生长期,吸取1 mL上述菌液加入到4 mL含抗性的LB培养基中,37 ℃剧烈震荡培养2~3 h。
1.4hGPx-1-198Leu重组载体的提取和鉴定用OMEGA无内毒素质粒提取试剂盒从上述得到的菌液中提取质粒,操作按试剂盒说明书进行。PCR验证所提质粒,以GenBank提供的人GPx-1基因198位点Pro/Leu(rs1050450)附近序列为模板,引物序列来自于之前的报道[2]。上游引物:5′- CGCTTCCAGACCATTGACATC-3′,下游引物:5′-CGAGGTGGTATTTTCTGTAAGATCA -3′,扩增产物长度为196 bp。PCR反应体系(25 μL):模板质粒DNA 2 μL,2XTaqMaster Mix 12.5 μL,上游引物1 μL,下游引物1 μL,加ddH2O 至25 μL,PCR循环反应条件:95 ℃ 10 min,95 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,72 ℃ 10 min,共35个循环。并将提取的质粒送TaKaRa公司测序分析。
1.5hGPx-1-198Leu真核表达载体转染HEK293细胞复苏冻存的HEK293细胞,用含100 mL/L胎牛血清的高糖DMEM培养液于37 ℃、50 mL/L CO2孵箱中培养。用TurboFectTM体外转染试剂将表达载体hGPx-1-198Leu瞬时转染HEK293细胞,命名为Leu。以空质粒pEGFP-N3转染细胞作为阴性对照和转染效率参照,命名为Con。未转染组命名为Non。转染24 h后荧光显微镜下观察各组细胞转染效率,并拍照记录。
1.6RT-PCR检测转染细胞GPx-1转录情况转染48 h后收集各组细胞,按照RNAiso Plus试剂说明书步骤提取总RNA,溶于DEPC水中,使用TaKaRa逆转录试剂盒,按照说明书配制反应液20 μL,合成cDNA。以cDNA为模板扩增目的基因,引物、PCR反应体系和PCR循环反应条件同质粒鉴定时所用。将PCR产物用20 g/L琼脂糖凝胶电泳30 min。凝胶图像分析仪分析结果。
1.7大鼠心肌细胞系H9C2的转染及补硒后GPx-1的表达在37 ℃、50 mL/L CO2的孵育箱中培养细胞。每隔2 d更换1次培养基,待细胞汇合度达80%~90%时,磷酸盐缓冲液(phosphate buffer, PBS)冲洗细胞3次,用2.5 g/L的胰蛋白酶消化细胞,按1∶3的比例加入含100 mL/L胎牛血清的高糖DMEM培养基终止消化,8 000 r/min,5 min,再用新鲜的培养基重悬细胞,为了排除血清中硒的影响,用含50 mL/L胎牛血清的高糖DMEM培养基培养细胞(含100 mL/L胎牛血清的培养基本就属于低硒环境)。并将细胞接种于六孔板中,待细胞汇合密度达60%~70%时,用空质粒pEGFP-N3和重组载体hGPx-1-198Leu转染H9C2细胞,方法同前。以相同体积的PBS做为阴性对照转染24 h后,给予0、0.03、0.09 μg/mL的亚硒酸钠,48 h后,提取细胞总蛋白,用分光光度计进行蛋白定量,Western blot检测各组细胞GPx-1的表达水平。以上操作均重复三次以保证数据的准确性及可靠性。提取的蛋白加入上样缓冲液后加热变性;制备120 g/L SDS聚丙烯酰胺凝胶;以100 μg总蛋白上样,电泳、转膜、封闭,孵育抗体,其中各抗体稀释度依次为:一抗(山羊抗人GPx-1多克隆抗体(1∶100),HRP标记兔抗山羊IgG二抗(1∶5 000),兔抗β-actin多克隆抗体(1∶1 000),HRP标记山羊抗兔IgG二抗(1∶5 000)。增强型发光液发光显影、曝光。凝胶图像分析系统采集图像,用Quantityone软件对图像进行灰度分析。
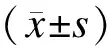
2结果
2.1目的基因cDNA的获得采取人工合成的方法合成hGPx-1-198Leu基因cDNA片段全长869 bp,5′端和3′端分别引入了BamHⅠ和NotⅠ酶切位点。
2.2重组质粒PCR及测序鉴定以提取的质粒DNA为模板,以检测GPx-1基因198位点多态特异引物扩增,将PCR产物用20 g/L琼脂糖凝胶电泳检测,得到196 bp目的条带(图1)。测序结果与NCBI Blast比对显示目的基因序列正确(图2)。
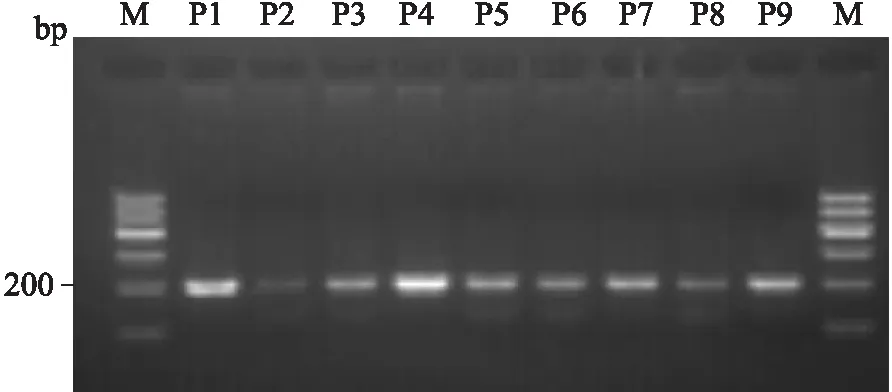
图1 PCR鉴定hGPX-1-198Leu重组质粒的凝胶电泳分析
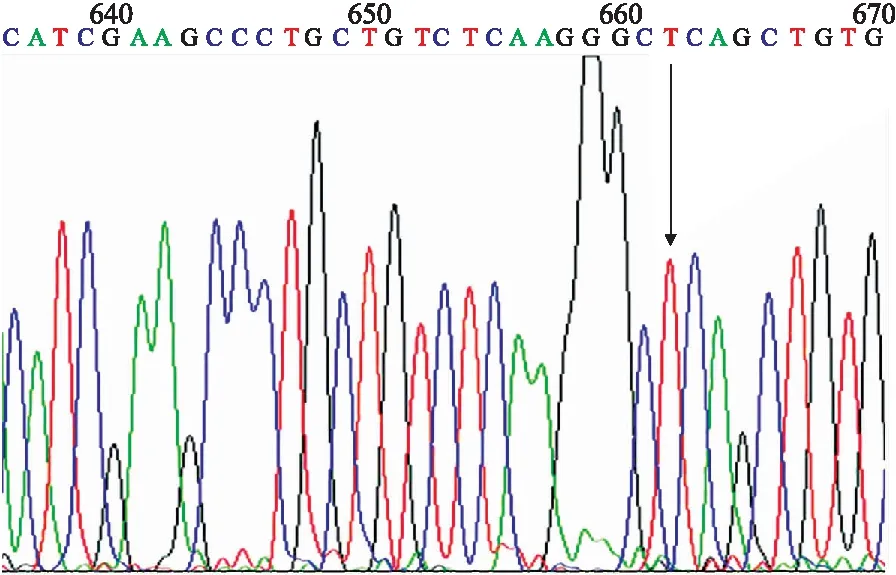
图2 hGPX-1-198Leu重组质粒的测序鉴定
2.3hGPx-1-198Leu载体成功转染HEK293细胞用TurboFectTM体外转染试剂转染细胞,操作按说明进行。以pEGFP-N3质粒做为重组质粒转染细胞效率的参照;荧光显微镜下观察到细胞内有绿色荧光蛋白表达(图3)。
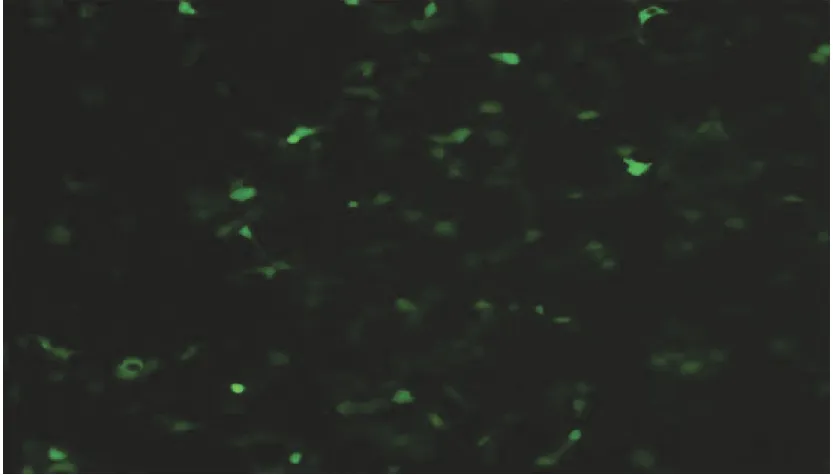
图3 转染pEGFP-N3质粒后的HEK293细胞
2.4转染细胞中GPx-1基因的mRNA表达水平不同转染组GPx-1mRNA有统计学意义(F=9.647,P=0.013)。RT-PCR显示转染重组载体后的细胞GPx-1 mRNA水平比空质粒转染细胞组(P=0.006)和未转染组明显增加(P=0.02),空质粒转染组与未转染组之间无明显差异(P=0.325)(图4)。
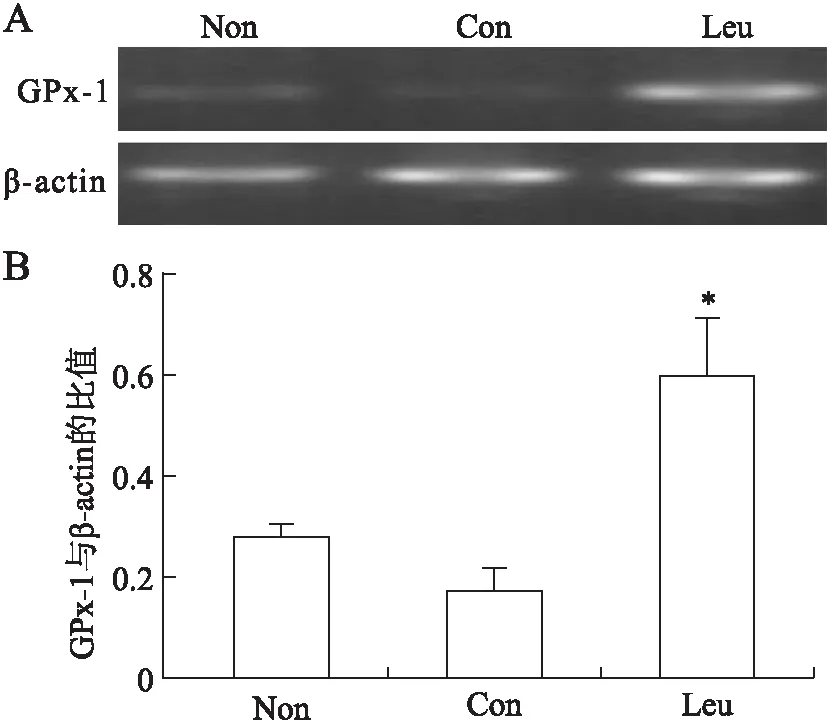
图4 RT-PCR检测HEK293转染后GPx-1mRNA表达水平(A)和GPx-1与β-actin的mRNA的比值(B)
2.5 Western blot检测H9C2细胞中补硒后GPx-1蛋白表达的变化 Non:未转染组;Con:空质粒转染组;Leu:重组质粒转染组。与Non和Con组比较,*P<0.05。2.5Westernblot检测H9C2细胞中补硒后GPx-1蛋白表达的变化未转染组(Non)、空质粒转染组(Con)和重组质粒转染组(Leu)三组分别在转染和补硒之后进行比较。结果显示,在未转染、空质粒转染和重组载体转染情况下,GPx-1表达均有统计学意义(Non:F=19.72,P=0.002);(Con:F=15.833,P=0.004);(Leu:F=21.285,P=0.002)。与空质粒和重组载体转染不同的是,在未转染组,给予0.03 μg/mL和0.09 μg/mL的亚硒酸钠后,GPx-1表达水平无明显差异(表1、图5)。
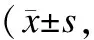
表1 不同组别GPx-1表达的比较
在相同转染条件下,与0 μg/mL组比较,*P<0.05;与0.03 μg/mL组比较,#P<0.05。
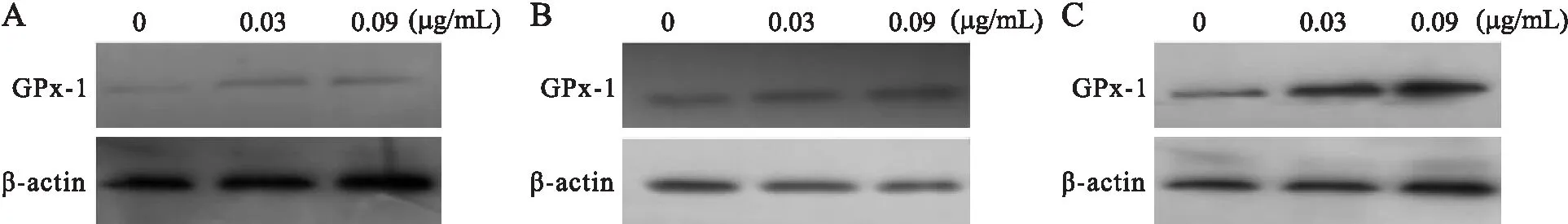
图5 H9C2细胞在未转染组(A)、空质粒转染组(B)和重组载体转染组(C)补硒后GPx-1的表达水平
3讨论
GPx家族是生物体内重要的抗氧化酶体之一,与体内的超氧化物歧化酶(superoxide dismutase, SOD)和过氧化氢酶(catalase, CAT)一起构成了机体的抗氧化防御体系。胞质型谷胱甘肽过氧化物酶(cellular glutathione peroxidase)属于GPx家族中第一个被确认的哺乳动物含硒蛋白[3],也是分布最广泛的过氧化物酶,主要分布在细胞质和线粒体。GPx-1对于清除细胞呼吸代谢过程中产生的过氧化氢和脂质过氧化物,减轻细胞膜多不饱和脂肪酸的过氧化及保护细胞的结构和功能有着重要作用。并且,GPx-1通过限制过氧化氢生成过多,从而对生长因子介导的信号传导、线粒体功能和正常巯基氧化平衡的维持等生理过程进行调控[4]。研究表明,自由基异常增多与诸多疾病发病密切相关。
研究发现GPx-1以四聚体形式存在,一个酶分子含四个硒原子,GPx-1的活力中心是硒代半胱氨酸(selenocysteine, Se-Cys),已经证实,硒以Se-Cys的形式插入GPx-1的活力中心发挥作用[5],低硒可以降低GPx-1mRNA稳定性使其降解增加[6],并降低GPx-1含量和蛋白活性;而补硒又可明显提高机体GPx-1活力[7]。近年来,大量实验表明,GPx-1在保护心肌、血管以及相关脏器对抗氧化应激损伤方面有着极其重要的作用[8-9]。有学者报道,GPx-1基因的198位点存在单核苷酸多态,即C-T,导致编码脯氨酸CCC的密码子由编码亮氨酸CTC的密码子取代。朱建宏等研究表明血GPx活性与GPx-1基因Pro198Leu多态性有关[10]。GPx-1活性是预测心血管事件的独立因子且其与心血管事件呈负相关,即升高GPx-1酶活力可明显降低心血管事件发生率[11]。周文锐等研究表明,上海汉族人群2型糖尿病与GPx-1基因Pro198Leu多态相关,提示GPx-1基因Pro198Leu多态性的T等位基因可能是2型糖尿病发病的风险因子,但不是2型糖尿病发生冠心病的风险因素[12]。然而,NEMOTO等[13]发现GPx-1基因的Pro198Leu多态性在2型糖尿病患者对冠脉粥样硬化的遗传易感性方面起关键作用。ZEIKOVA等[14]发现患有冠状动脉疾病的男性和过早因心血管疾病而死亡的男性比正常男性具有显著增高的T 等位基因频率,其研究结果显示GPx-1 Pro198Leu多态的等位基因T(Leu)使人寿命缩短,使人易患冠状动脉性心脏病、早发的心肌梗死(50岁之前)和过早死亡(55岁之前)。还有研究发现GPx-1基因198位点多态性与肺癌、乳腺癌、结肠癌、前列腺癌等癌症密切相关[15-16]。DIAMOND[17]曾将含有人GPxPro198和GPxLeu198的慢病毒表达载体转染乳腺癌细胞MCF-7,并观察两种不同基因型的GPx-1基因对补充微量元素硒的反应,结果显示含Leu等位基因的GPx-1酶活性对硒反应比含Pro等位基因的较差。
本研究以人巨细胞病毒启动的真核表达载体pEGFP-N3为骨架,将人GPx-1-198Leu基因插入酶切位点BamHⅠ和NotⅠ之间,经BamHⅠ和NotⅠ双酶切和纯化后与经同样双酶切、纯化的pEGFP-N3载体以T4 DNA连接酶进行定向连接,转化至DH5α后,分别经PCR及测序验证,结果表明成功构建真核表达载体pEGFP-N3-GPx-1-198Leu,命名为hGPx-1-198Leu。瞬时转染HEK293细胞后从mRNA水平验证,结果显示GPx-1可以有效表达,这又说明GPx-1-198Leu真核表达载体得到了成功构建。同时,我们又将重组载体转染大鼠心肌细胞系H9C2,并观察不同硒浓度对GPx-1的诱导表达情况。结果显示重组载体转染的细胞中GPx-1蛋白表达水平随着硒浓度的升高而升高。这与DIAMOND等报道的不太一致,考虑这与我们给予的最高硒浓度远比其给予的较低有关。因此,未能达到GPx-1-198Leu蛋白表达至饱和状态所需硒浓度。总之,GPx-1-198Leu真核表达载体的成功构建为我们进一步研究该基因在心血管疾病及其他氧化应激相关疾病中的作用奠定了基础。
参考文献:
[1] LEI C, NIU XL, WEI J, et al. Interaction of glutathione peroxidase-1 and selenium in endemic dilated cardiomyopathy[J]. Clin Chim Acta, 2009, 399(1-2):102-108.
[2] YANG P, BAMLET WR, EBBERT JO, et al. Glutathione pathway genes and lung cancer risk in young and old populations[J]. Carcinogenesis, 2004, 25(10):1935-1944.
[3] ROTRUCK JT, POPE AL, GANTHER HE, et al. Selenium: Biochemical role as a component of glutathione peroxidase[J]. Science, 1973(179):588-590.
[4] LUBOS E, LOSCALZO J, HANDY DE. Glutathione peroxidase-1 in health and disease: From molecular mechanisms to therapeutic opportunities[J]. Antioxid Redox Signal, 2011, 15(7):1957-1997.
[5] TOSATTO SC, BOSELLO V, FOGOLARI F, et al. The catalytic site of glutathione peroxidases[J]. Antioxid Redox Signal, 2008, 10(9):1515-1526.
[6] MAQUAT LE. Evidence that selenium deficiency results in the cytoplasmic decay of GPx1 mRNA dependent on pre-mRNA splicing proteins bound to the mRNA exon-exon junction[J]. Biofactors, 2001, 14(1-4):37-42.
[7] SINCI V, GUNAYDIN S, KALAYCIOGLUS, et al. Effects of selenium enriched reperfusion solutions on isolated guinea pig hearts[J]. Keio J Med, 1998, 47(4):219-222.
[8] TORZEWSK M, OCHSENHIRT V, KlLESCHYOV AL, et al. Deficiency of glutathione peroxidase-1 accelerates the progression of atherosclerosis in apolipoprotein E-deficient mice[J]. Arterioscler Thromb Vasc Biol, 2007, 27(4):850-857.
[9] ARDANAZ N, YANG XP, CIFUENTES ME, et al. Lack of glutathione peroxidase-1 accelerates cardiac-specific hypertrophy and dysfunction in angiotensin II hypertension[J]. Hypertension, 2010, 55(1):116-123.
[10] 朱建宏,雷聪,安哲,等.血硒、GPX酶活力与GPx-1基因Pro198Leu多态关联分析[J]. 现代检验医学杂志,2010,25(6):16-18.
[11] BLANKENBERG S, RUPPRECHT HJ, BICKEL C, et al. Glutathione peroxidase-1 activity and cardiovascular events in patients with coronary artery disease[J]. N Engl J Med, 2003, 349(17):1605-1613.
[12] 周文锐,刘丽梅,郑泰山,等.GPx-1基因Pro198Leu多态与2型糖尿病及合并冠心病的关系[J]. 上海交通大学学报:医学版,2007, 27(7):770-773.
[13] NEMOTO M, NISHIMURA R, SASAKI T, et al. Genetic association of glutathione peroxidase-1 with coronary artery calcification in type2 diabetes: a case control study with multi-slice computed tomography[J]. Cardiovasc Diabetol, 2007, 6:23.
[14] ZEIKOVA TV, GOLUBENKO MV, BUIKIN SV, et al. The glutathione peroxidase-1(GPX1)single nucleotide polymorphism pro198Leu: association with life span and coronary artery disease[J]. Mol Biol (Mosk), 2012, 46(3):481-486.
[15] 顾杰锋,郭建波,季朝能,等. GPX1的198位点多态性与肺癌和乳腺癌易感性的关系[J].中国肿瘤,2009, 18(10):823-826.
[16] CHEN J, CAO Q, QIN C, et al. GPx-1 polymorphism (rs1050450) contributes to tumor susceptibility: evidence from meta-analysis[J]. J Cancer Res Clin Oncol, 2011, 137(10):1553-1561.
[17] HU YJ, DIAMOND AM. Role of glutathione peroxidase-1 in breast cancer: loss of heterozygosity and allelic differences in the response to selenium[J]. Cancer Res, 2003, 63(12):3347-3351.
