人甲状腺未分化癌鸡胚尿囊膜移植瘤模型的建立及生物学性状
2014-06-28白艳霞闫利英王全颖杨广笑
杨 琦,白艳霞,闫利英,王全颖,杨广笑
(1.西安交通大学医学院第一附属医院耳鼻咽喉头颈外科,陕西西安 710061;2.西安华广生物科技有限公司,陕西西安 710025)
甲状腺未分化癌(anaplastic thyroid carcinoma, ATC)是恶性程度最高的甲状腺癌,致死率极高[1-2],极易侵犯邻近组织,早期即可通过血管和淋巴管发生远处转移[3],多数患者就诊时肿瘤组织已扩展至甲状腺外[4]。ATC的生存期较短,无论是手术治疗还是放疗化疗,其生存期一般低于6个月[5]。目前为止,还未有任何简单的动物模型应用于ATC的研究中。因此,建立ATC动物模型,探讨其形态学特征及生物学特征,寻求有效的治疗方法,十分重要。本研究拟用人ATC细胞株FRO,在鸡胚尿囊膜(CAM)上建立ATC移植瘤模型,并初步探讨移植瘤形成条件,观察移植瘤形态学特征与生物学特征,为ATC的进一步研究提供简便的动物模型。
1材料与方法
1.1人甲状腺未分化癌标本来源收集2007~2011年西安交通大学医学院第一附属医院耳鼻咽喉头颈外科ATC患者的手术切除标本11例。所有标本均经100 mL/L甲醛固定后,常规石蜡包埋,每例均制成5 μm厚的切片,行HE染色。
1.2细胞培养人ATC细胞株FRO由重庆医科大学基础医学院刘智敏教授惠赠。人ATC细胞株FRO在含100 mL/L胎牛血清的RPMI-1640培养基中,置37 ℃、50 mL/L CO2孵箱培养,待细胞达到一定数量且处于对数期生长期时,消化收集细胞,用培养基重新悬浮调到所需的细胞浓度备用。
1.3人工气室的建立鸡胚购于西安市耿镇孵化场,用750 mL/L的乙醇消毒后,置于37 ℃恒温电热培养箱内隔水式孵育,选择孵育良好的鸡胚进行实验。根据文献[6]的方法并适当改进建立人工气室。在消毒好的超净台上通过照卵灯确定胚头的大致位置,在胚头右下方约0.5~1.0 cm处标记确定开窗部位,750 mL/L乙醇消毒后,用小镊子在鸡胚气室端轻戳一小口,然后小心地去掉周围的蛋壳和壳膜,开口直径约为2 cm大小,便于后期实验观察。此时可以看到气室底部白色的气室膜,滴数滴无菌生理盐水,使白色气室膜变成透明色,小心地用注射针头在气室膜中央挑一小口,然后用小镊子轻轻剥除上层的气室膜,充分暴露下层透明的CAM膜。后将收集好的肿瘤细胞20 μL接种于CAM膜上相对无血管区。接种后用无菌透明胶带封闭窗口,继续在培养箱内孵育。
1.4实验设计及处理
1.4.1观察胚龄对鸡胚成瘤率及鸡胚活力的影响 收集处于生长对数期的ATC细胞,用培养基将细胞密度调为每20 μL含有5×106个的细胞,接种在胚龄分别为9、10、11、12、13的鸡胚尿囊膜上,每组10只鸡胚,每只鸡胚接种20 μL细胞悬液。每天观察鸡胚的存活情况以及存活鸡胚成瘤及移植瘤生长情况(以肉眼见移植瘤≥2 mm为成瘤阳性)。
1.4.2观察肿瘤细胞数对鸡胚成瘤率及鸡胚活力的影响 选取发育良好的12日鸡胚,收集处于生长对数期的ATC FRO细胞,用培养基将细胞密度调为每20 μL分别含有2×106、4×106、6×106、8×106、10×106个细胞,每组10只,每只接种20 μL细胞悬液;对照组接种20 μL的无菌生理盐水。每天观察鸡胚的存活情况以及存活鸡胚成瘤及移植瘤生长情况(以肉眼见移植瘤≥2 mm为成瘤阳性)。
1.4.3观察鸡胚移植瘤的原位生长情况 选取发育良好的12日鸡胚10个,收集处于生长对数期的ATC FRO细胞,用培养基将细胞密度调为每20 μL含有6×106个的细胞,将配好的细胞悬液接种在CAM上,每天取出两只,观察移植瘤的颜色、大小、性状及诱导血管生成的情况,Olympus数码相机拍照并用直尺测量体积(V=1/2(长径×短径2)[7],绘制生长曲线。
1.4.4观察移植瘤的组织形态学 选取生长良好的移植瘤标本,经100 mL/L甲醛固定、常规石蜡包埋、切片以及HE染色。用光学显微镜(BHS205444型)观察组织形态并拍照。
1.5统计学处理实验数据采用SPSS 18.0统计软件进行单因素分析。各实验组的存活率与成瘤率选用χ2检验(α=0.05),P<0.05为差异有统计学意义。所有图片采用Image-Pro Plus 6.0处理,移植瘤生长曲线图形采用OriginPro 8.5绘制。
2结果
2.1胚龄对鸡胚成瘤率及鸡胚活力的影响接种不同胚龄的CAM与存活鸡胚数和成瘤鸡胚数的关系(表1)。不同胚龄的鸡胚存活率差异有统计学意义(P=0.016),不同胚龄的鸡胚成瘤率差异无统计学意义(P=0.596)。
2.2肿瘤细胞数对鸡胚成瘤率及鸡胚活力的影响接种不同数量的ATC FRO细胞与存活鸡胚数和成瘤鸡胚数的关系(表2)。接种不同数量的FRO细胞数与鸡胚存活率差异有统计学意义(P=0.003),接种不同数量的FRO细胞数与鸡胚成瘤率差异有统计学意义(P=0.005)。
2.3鸡胚移植瘤原位生长情况在12日龄CAM上接种20 μL含6×106个细胞数的ATC FRO细胞,在接种后的第2天及以后每天取2个鸡胚观察鸡胚移植瘤生长情况。在透明的CAM上接种20 μL的ATC FRO细胞悬液后,白色的细胞悬液如白色薄膜贴在CAM上,边界清楚。肿瘤细胞接种第2天,白色细胞悬液向中心汇聚生长,出现微弱的血管反应(图1A)。第3天,白色肿瘤组织开始向周围侵入生长,肿瘤组织周围的毛细血管向肿瘤组织呈放射状生长,颜色鲜红,CAM的透明度开始降低(图1B)。第4天,肿瘤组织的厚度开始增加,周围的毛细血管开始增粗,颜色深红,CAM透明度进一步降低(图1C)。第5天,肿瘤组织向周围CAM侵入生长加快,且厚度也增加,营养肿瘤组织的血管增粗明显,颜色暗红,CAM透明度消失,肿瘤向外侵入生长旺盛(图1D)。第6天,肿瘤组织向外侵入生长减慢,白色肿瘤组织表面出现坏死,周围血管变化不明显(图1E)。鸡胚移植瘤瘤体生长曲线呈“S”型,可以直观的看到,第1天至第4天,肿瘤瘤体缓慢生长,在第5天,肿瘤生长迅速增加并达到高峰,第6天开始,肿瘤生长开始减慢(图2)。

表1 不同胚龄对鸡胚成瘤率及鸡胚活力的影响

表2 不同数量的ATC细胞对鸡胚成瘤率及鸡胚活力的影响
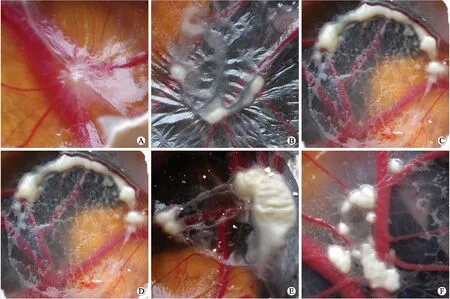
图1 鸡胚移植瘤的生长情况

图2 鸡胚移植瘤的生长曲线
2.4移植瘤的组织形态学观察肉眼观ATC鸡胚移植瘤组织为乳白色,形态不规则,边界清楚,有些因缺血表面出现坏死,质软易碎,切面为淡黄色(图1F)。光镜下见鸡胚移植瘤瘤细胞排列紊乱,形态不规则,细胞核大且深染,形态多样,有核分裂相,细胞质少(图3A),其与人ATC组织结构(图3F)相似。肿瘤细胞侵入正常组织中,其中红色箭头区为肿瘤细胞区,细胞核大且深染,黑色箭头区为正常的鸡胚绒膜尿囊膜纤维组织,细胞呈条索状,排列整齐,胞核小,胞质多,黄色箭头所指区为淋巴细胞,细胞核小且染色深,整个区域为炎症反应区(图3B)。在炎症反应区的淋巴细胞中可见侵入的瘤细胞(图3C);在正常组织中可见营养肿瘤的管道(图3D);在正常组织中可见瘤栓(图3E)。
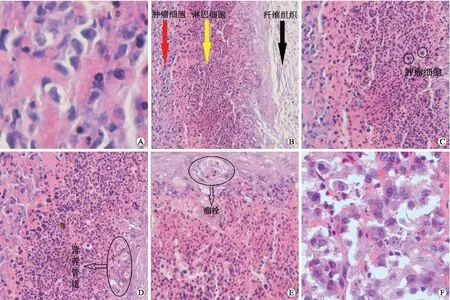
图3 鸡胚移植瘤的HE染色
3讨论
用人ATC细胞株FRO建立鸡胚移植瘤模型,国内外尚未见报道。本实验首次将FRO细胞接种在CAM上,肿瘤组织在CAM存活生长,并且呈现向周围组织侵入生长的趋势,HE染色显示肿瘤形态与人甲状腺未分化癌组织形态相似,证明了建立甲状腺未分化癌鸡胚移植瘤模型的成功。
CAM即鸡胚尿囊发育过程中的尿囊体壁中胚层与绒毛膜脏壁中胚层融合形成的一层透明薄膜。CAM含有丰富的毛细血管丛,并且与周围多孔的外壳紧贴,有利于气体与营养物质交换。这些特点使CAM成为鸡胚的重要呼吸器官,也使它能有效地支持移植瘤组织的生长;同时,它又是天然的膜性屏障,可以模拟肿瘤在侵袭过程中的基底膜作用[8]。鸡胚具有简便、快捷、经济、实验周期短、操作简单、培养方便、不需要特殊设备等优点[9]。因此,鸡胚广泛用于新生血管生成、微循环、肿瘤生物等方面的研究[10],尤其用于抗肿瘤的侵袭生长[11]。孙辉等[12]利用裸鼠甲状腺原位TA-K细胞微量注射法,成功建立人甲状腺未分化癌裸鼠原位移植模型。虽然裸鼠模型能够很好地模拟人甲状腺未分化癌的生长、侵袭、转移,但裸鼠的饲养条件要求高,实验周期长,价格比较昂贵,大多实验室受到限制,而发育初期的鸡胚,免疫系统不健全排异反应小,类似免疫缺陷的裸鼠。
在预实验中,我们借鉴张斌等[6]在CAM上接种肿瘤细胞的方法并适当改变,在剥离气室膜时,我们首先在白色气室膜上滴数滴无菌生理盐水,使白色气室膜变成透明色,小心地用注射针头在气室膜中央挑一小口,然后用小镊子轻轻剥除上层的气室膜,此操作减少对CAM膜的损伤,大大降低操作难度,使鸡胚存活率接近100%。因此,我们只在接种细胞浓度与胚龄方面作进一步研究,并观察肿瘤的生物学特征及形态学特征。
首先,我们选取9~13日龄的鸡胚分组研究,结果显示,不同胚龄与鸡胚存活率差异有统计学意义,11日龄与12日龄的明显高于其他日龄,9日龄与10日龄可能胚龄过小、抗环境变化的能力弱,容易死亡。13日龄的鸡胚由于免疫系统已初步发育,对于异种移植物可能有排斥作用,也易于死亡。在免疫系统未发育之前,肿瘤细胞在CAM上生长情况不同。所以,我们选择存活率与成瘤率都较高的12日鸡胚做进一步研究。
其次,细胞种类不同,接种的细胞数也有差别。大多文献上选用的细胞数达到106个。因此,我们将细胞悬液分别配成每20 μL分别含有2×106、4×106、6×106、8×106、10×106个的细胞。结果显示,不同细胞数与鸡胚存活率差异有统计学意义。在一定的细胞数范围内,肿瘤细胞数越多,成瘤率越高,但超出一定的范围,成瘤率反而降低,说明在鸡胚承受的范围内细胞数多,成瘤的机会越大,但是当细胞数超越鸡胚承受能力时,肿瘤细胞数量越多,越容易导致鸡胚死亡。因此,从结果中我们选择存活率与成瘤率都相对高的6×106细胞数作进一步研究。
最后,我们观察接种后移植瘤的生长情况。从图片与数据的分析中,我们发现在接种后第5天,肿瘤生长达到旺盛状态,且周围血管也增粗增多,如果对肿瘤组织进行药物等其他方面的处理,选择第5天效果会更好。此外,我们将CAM移植瘤组织的HE染色切片与人ATC组织的HE染色切片进行比较,发现它们的组织形态相似,且充分保持未分化状态,这说明了ATC CAM移植瘤可模拟ATC在人体内的生长模式。
甲状腺未分化癌鸡胚尿囊膜移植瘤模型的成功建立为以后甲状腺未分化癌的研究提供了一个方便、简单、可视的模型。该模型可用于甲状腺未分化癌生长特性、血管生成机制、筛选肿瘤化疗药物、肿瘤对放疗敏感性及基因片段治疗肿瘤等方面的研究。但是,由于鸡胚是未成熟动物,各个组织器官未发育完善,所以我们在以后的研究中应该充分考虑这一客观因素的影响。
参考文献:
[1] PITT SC, MOLEY JF. Medullary anaplastic and metastatic cancers of the thyroid[J]. Semin Oncol, 2010(37):567-579.
[2] ASCHEBROOK-KILFOY B, WARD MH, SABRA MM, et al. Thyroid cancer incidence patterns in the United States by histologic type[J]. Thyroid, 2011(21):125-134.
[3] GIUFFRIDA D, GHARIB H. Anaplastic thyroid carcinoma current diagnosis and treatment[J]. Ann Oncol, 2000, 11(9):1083-1089.
[4] LANG BH, LO CY. Surgical options in undifferentiated thyroid carcinoma[J]. World J Surg, 2007, 31(5):969-977.
[5] ARE C, SHAHA AR. Anaplastic thyroid carcinoma: biology, pathogenesis, prognostic factors, and treatment approaches[J]. Ann Surg Oncol, 2006, 13(4):453-464.
[6] 张斌,刘庆勇,陈杰,等. 人肾癌鸡胚模型的建立及其肿瘤生物学特性的研究[J]. 西安交通大学学报:医学版,2012, 31(1):68-70.
[7] ZHANG YM, HE LC. Suppression of tumor-induced angiogenesis by taspine isolated from Radix et Rhizoma Leonticis and its mechanism of actioninvitro[J]. Cancer Lett, 2008, 262(1):103-113.
[8] DIOLAITI D, BERNARDONI R, TRAZZI S, et al. Functional cooperation between TrkA and p75(NTR) accelerates neuronal differentiation by increased transcription of GAP-43 and p21(CIP/WAF) genes via ERK1/2 and AP-1 activities[J]. Exp Cell Res, 2007, 313(14):2980-2992.
[9] YE F, CHEN H,LIANG Z, et al. Establishment of a cervical cancer model via inoculating SiHa Cells into humanized severe combined immunodeficient mice[J]. Eur J Gynaecol OncoL, 2006, 27(6):566-572.
[10] TUFAN AC, SATIROGLU-TUFAN NL. The chick embryo chorioallantoic membrane as a model system for the study of tumor angiogenesis, invasion and development of anti-angiogenic agents[J]. Curr Cancer Drug Targets, 2005, 5(4):249-266.
[11] WOLF K, ALEXANDER S, SCHACHT V, et al. Collagen-based cell migration modelsinvitroandinvivo[J]. Semin Cell Dev Biol, 2009, 20(8):931-941.
[12] 孙辉,王金国,张德恒,等. 人甲状腺未分化癌细胞系TA-K裸鼠原位移植模型的建立[J]. 中国普外基础与临床杂志,2002,9(5):322-324.
