2型糖尿病合并肥胖患者胃旁路术中核心体温监测
2014-06-15吴雅琴山艳庄敏
吴雅琴,山艳,庄敏
(上海交通大学附属第六人民医院,上海200233)
我国糖尿病患病形势严峻,20岁以上人群中男性和女性糖尿病的患病率分别达10.6%和8.8%,总体患病率已达9.7%,而糖尿病前期的患病率更是高达15.5%,每年糖尿病新发人数约101万[1-2]。英国的前瞻性糖尿病研究显示,即使结合各种新的治疗方法,仅有<1/3的糖尿病患者可以得到良好控制[3]。大部分患者仍持续产生大血管及微血管的并发症,糖尿病是造成心脏及卒中相关死亡的危险因素,还是肾功能衰竭、失明以及>60%的非外伤性下肢截肢的原因疾病。糖尿病通常与肥胖并存,约90%的2型糖尿病患者肥胖或是体重超重。目前,腹腔镜胃旁路术作为治疗2型糖尿病合并肥胖患者的有效治疗手段,已被国际糖尿病联盟和美国糖尿病协会等相继认可[4-6]。糖尿病患者较正常人存在着脂质代谢紊乱,周围血管病变,内皮细胞和凝血机制异常的可能性大,导致术后感染几率增高,切口愈合迟缓,围手术期风险大。研究表明,术中低体温可使心血管意外的发生率增高;降低机体代谢率,延缓多种药物代谢时间;降低凝血机制,低温可增加手术中和手术后渗血量;降低机体免疫力,使术后伤口感染等并发症的发生率增高;影响患者的预后,延长住院时间[6-8]。因此,监测2型糖尿病合并肥胖患者行腹腔镜胃旁路术术中体温变化并及时干预是手术室护理的重要环节之一。本研究通过持续监测行腹腔镜胃旁路术的2型糖尿病合并肥胖患者的核心体温,了解此类患者手术期间基础体温的变化,了解低体温对于术后并发症发生率的影响,为指导术中体温干预措施的研究提供理论依据。
1 对象与方法
1.1 对象选择2012年6月—2014年3月在我院普外科行择期手术的2型糖尿病合并肥胖患者100例。随机分为观察组和对照组各50例。观察组中男23例,女27例;平均年龄(47.5±10.5)岁,体重(87.3±10.0)kg,BMI(32.17±4.35)kg/m2。对照组中,男20例,女30例,平均年龄(45.9±12.4)岁,平均体重(86.3±13.2)kg,BMI(31.91±3.65)kg/m2;两组患者术前年龄、体重、体重指数比较差异无统计学意义(P>0.05)。手术适应证参考《中国糖尿病外科治疗专家指导意见(2010)》:①2型糖尿病患者BMI>27.5 kg/m2,向心性肥胖(女性腰围>85 cm,男性>90 cm);②生活方式和药物治疗难以控制血糖或伴有合并症,尤其具有心血管风险因素;③年龄<65岁或身体一般状况较好,手术风险较低;④术前胰岛功能大于正常水平[9]。
1.2 方法观察组和对照组手术方式均采用全身麻醉下腹腔镜胃旁路术。对照组采用常规保温措施即在患者双下肢覆盖毛毯(恒温36℃),手术区域常规铺无菌巾,仅暴露手术部位,患者输入液体及冲洗液为室温下液体。观察组采用加热毯包裹双下肢,加热毯保持40°C恒温,输入液体及冲洗液加温至37℃。两组患者手术室温度恒定为22~24℃,湿度为40%~60%。
1.3 体温监测方法患者全身麻醉诱导后将惠普监护仪EXACON温敏探头置入鼻咽部,深度为鼻翼至同侧下颌角距离。术中连续监测患者鼻咽温度作为中心体温,出现体温低于36℃判定为术中低体温;中心体温36~34℃为轻度低温;34~32℃为中度低体温,32℃以下为重度低体温[10]。
1.4 寒战等级根据Guffin等[11]提出的划分标准,分5级:0级:没有寒战;1级:立毛肌收缩或外周血管收缩;2级:1组肌肉轻微活动;3级:超过1组肌肉的中等强度活动;4级:持续性的全身肌肉强烈活动。
1.5 统计学方法采用SPSS 20.0软件计量资料采用成组t检验,计数资料采用χ2检验。
2 结果
2.1 两组患者手术前和手术中不同时间体温值见表1。
2.2 两组患者手术中不同时间段体温下降值见表2。
2.3 两组患者其他相关资料情况见表3。
表1 两组患者手术前和手术中不同时间体温值(℃,±s)
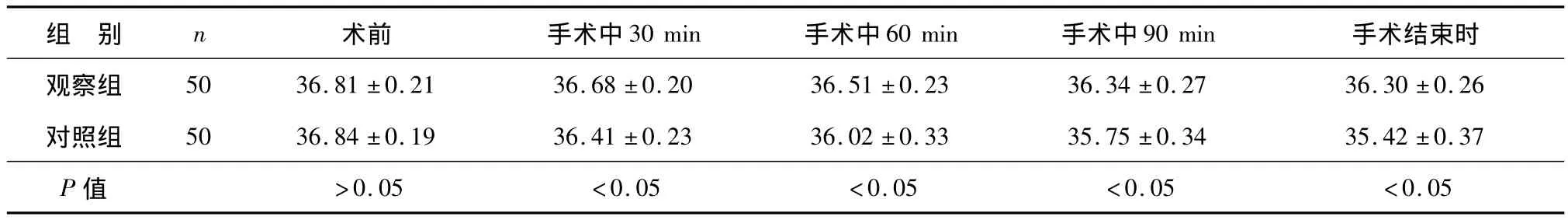
表1 两组患者手术前和手术中不同时间体温值(℃,±s)
组别n术前手术中30 min手术中60 min手术中90 min 手术结束时观察组50 36.81±0.21 36.68±0.20 36.51±0.23 36.34±0.27 36.30±0.26对照组50 36.84±0.19 36.41±0.23 36.02±0.33 35.75±0.34 35.42±0.37 P值>0.05<0.05<0.05<0.05<0.05
表2 两组患者手术中不同时间段体温下降值(℃,±s)
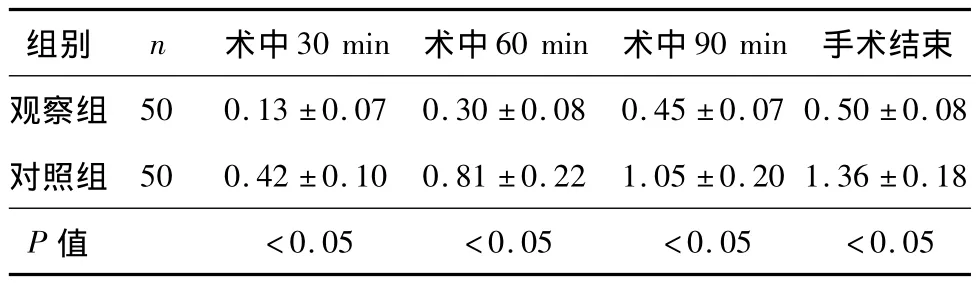
表2 两组患者手术中不同时间段体温下降值(℃,±s)
手术结束观察组50 0.13±0.07 0.30±0.08 0.45±0.07 0.50±0.组别n术中30 min术中60 min术中90 min 08对照组50 0.42±0.10 0.81±0.22 1.05±0.20 1.36±0.18 P值<0.05<0.05<0.05<0.05
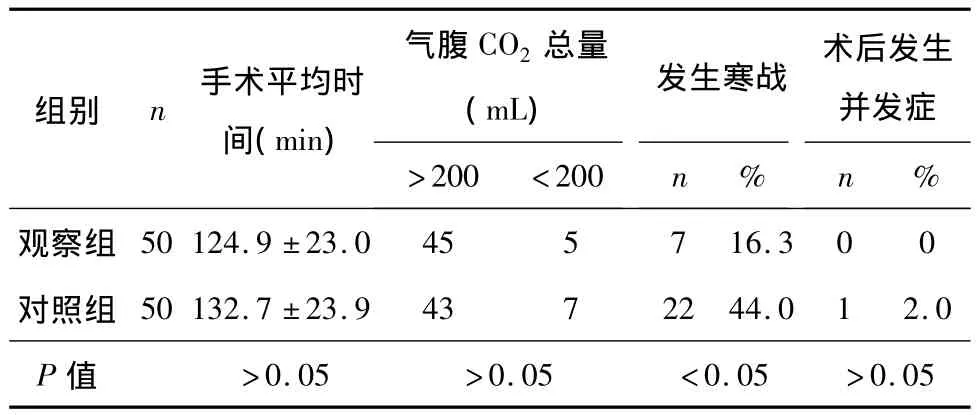
表3 两组患者其他相关资料情况
3 讨论
3.1 2 型糖尿病合并肥胖手术在我国的开展情况20世纪80年代起由美国开始实行以治疗病态性肥胖的2型糖尿病患者为主的胃旁路手术并意外发现术后患者可以得到完全的糖尿病缓解[12]。根据近年的调查显示,全球减重代谢疾病中心开展的手术中,胃旁路术占5成[13]。主要开展国家由欧美为主,在亚洲手术普及率低,主要国家及地区为印度及中国台湾,而我国尽管糖尿病及肥胖人数众多,目前传统治疗无法在根本上阻止糖尿病及各种并发疾病的发生和发展,因此,代谢性手术在我国具有广阔的前景。
3.2 手术中核心体温监测的意义
3.2.1 手术风险由于接受手术的患者是以2型糖尿病合并肥胖的特殊人群,与正常人相比,不论在手术期间的心脑血管意外、窒息发生率和呼吸衰竭等并发症还是手术恢复期术后感染,伤口愈合延迟方面都更易发生。另一方面,低体温也是手术患者心脑血管意外、围手术期出血和术后感染的因素之一。
3.2.2 体温监测的意义糖尿病合并肥胖患者与普通患者相比存在高代谢表现,尽管目前普遍建议围手术期保温措施是值得应用的,但对于重度肥胖患者,术中体温变化监测数据少,围手术期处理方案仍是值得探讨的话题。因此,作为国内开展的新型手术方式之一,有必要研究核心体温的变化,并讨论在围手术期护理方面如何积极应对,减少各类并发症的发生。
3.3 术中低体温的高危因素
3.3.1 低体温的影响因素研究表明,腹腔镜手术术中极易发生低体温(<36℃),其原因包括麻醉引起血管热量丧失,输入冷液体、体温中枢受麻醉剂抑制,身体暴露和腹腔冲洗等因素,还和CO2气腹有关。手术时由于身体热量的重新分配,即体内中心热量向外周转移,体内与外周间温差越大,转移越快,表现为中心温度的显著降低。随着手术的进一步进行,体温下降主要是由于热量的散失超过了代谢产热,约75%的热量通过皮肤对流和辐射等途径散失,而热量的散失取决于皮肤和环境之间的温度差,温度差越大,散热量越多。
3.3.2 手术过程中的体温变化研究显示,两组患者体温随手术进程逐渐降低,手术结束时为体温最低点。在手术过程中的相同体温记录点,对照组患者较观察组患者核心体温有显著降低,两组比较差异有统计学意义。两组患者手术时间以及对CO2气腹的使用量比较差异无统计学意义。对照组麻醉复苏后有22例发生寒战(3级2例,2级7例,1级13例),观察组患者仅7例发生寒战(2级1例,1级6例)。尽管两组患者术后并发症发生率无统计学差异,但对照组患者有1例于术后第6天发生腹腔感染,而观察组患者无术后并发症的发生。术中使用加温措施能有效维持患者的体核温度,尽管两组患者手术时间类似,但良好的基础体温能减少患者麻醉复苏时间,并且显著地改善苏醒后寒战发生,观察组患者无论在复苏后寒战的强度还是频率均低于对照组。因此,手术期间需要巡回护士加强患者保温措施。
3.4 低体温的防治研究发现,糖尿病合并肥胖患者与普通患者类似,术中仍存在进行性下降的低体温表现,术中能量器械的使用并不会保持患者体核温度,而低体温主要影响患者术后寒战的发生及寒战的强度,但与术后并发症的发生并无显著相关性,尽管目前对于此类患者并非需要强制使用加温措施,但保温能提升患者围手术期舒适度,提高围手术期护理质量。
3.4.1 保持手术室恒温,减少机体散热防止核心体温下降最简单有效的方法是升高环境温度,减少经皮肤的热量丢失,因此建议手术室室温宜控制在22~24℃,湿度保持在40%~60%,加盖被单并尽量减少皮肤裸露时间。
3.4.2 加温措施的应用由于手术中绝大部分的代谢热量是经由皮肤丢失。皮肤主动加温是减少热量丧失有效便捷的方法,建议加温毯包裹四肢及非手术区域的躯干,温度应恒定保持略高于体温,40~45℃较为合适,如果加热毯过热可能会导致灼伤。此外,术中输液预热(37℃左右)也是减少热量损失,预防低体温的有效方法,但过高的输液温度仍会破坏血液成分,因此保温影响有限。如果条件允许,维持腹腔镜气腹的CO2加热37℃也是减少低体温的有效措施。
3.4.3 心理护理患者术前精神紧张加之禁食等术前准备,导致体温调节能力不足,建议加强患者在手术室内的心理疏导,尽可能减少陌生感及恐惧感,有助于缓解焦虑情绪,达到一定程度上的心理护理。
4 小结
维持手术患者术中体温恒定能改善患者术后寒战和麻醉苏醒延迟的发生率,降低术后感染率。本研究中,恒温措施是通过加温毯包裹肢体,输注加温溶液来完成的,但如采用多种联合复温方式或可进一步改善腹腔镜胃旁路术术中低体温的发生,如气腹的加温[14]。监测2型糖尿病合并肥胖患者行腹腔镜胃旁路术术中体温变化并及时加强保温措施是手术室护理的重要一环,能减少患者术后不良反应的发生,提高护理安全。
[1]King H,Aubert RE,Herman WH.Global burden of diabetes,1995-2025:prevalence,numerical estimates,and projections[J].Diabetes Care,1998,21(9):1414-1431.
[2]Yang W,Lu J,Weng J,et al.Prevalence of diabetes amongmen and women in China[J].N Engl J Med,2010,362(12):1090-1101.
[3]Turner RC,Cull CA,Frighi V,etal.Glycemic controlwith diet,sulfonylurea,metformin,or insulin in patientswith type2 diabetes mellitus:progressive requirement for multiple therapies(UKPDS 49).UK Prospective Diabetes Study(UKPDS)Group[J].JAMA,1999,281(21):2005-2012.
[4]Mingrone G,Panunzi S,De Gaetano A,etal.Bariatric surgery versus conventionalmedical therapy for type 2 diabetes[J].N Engl J Med,2012,366(17):1577-1585.
[5]Schauer PR,Kashyap SR,Wolski K,etal.Bariatric surgery versus intensivemedical therapy in obese patients with diabetes[J].N Engl JMed,2012,366(17):1567-1576.
[6]Torossian A.Survey on intraoperative temperaturemanagement in Europe[J].Eur JAnaesthesiol,2007,24(8):668-675.
[7]Putzu M,Casati A,BertiM,et al.Clinical complications,monitoring andmanagementof perioperativemild hypothermia:anesthesiological features[J].Acta Biomed,2007,78(3):163-169.
[8]刘小颖,吴新民.围术期低体温[J].中华麻醉学杂志,2003,23(9):712-7 l4.
[9]郑成竹,丁丹.中国糖尿病外科治疗专家指导意见(2010)[J].中国实用外科杂志,2011,31(1):54-58.
[10]孙育红.腹腔镜胆囊切除术中患者体温变化的观察[J].中华护理杂志,2009,44(10):935-936.
[11]Guffin A,Girard D,Kaplan JA.Shivering following cardiac surgery:hemodynamic changes and reversal[J].J Cardiothorac Anesth,1987,1(1):24-28.
[12]PoriesWJ,Swanson MS,MacDonald KG,et al.Who would have thought it?An operation proves to be themost effective therapy for adult-onset diabetes mellitus[J].Ann Surg,1995,222(3):339-352.
[13]Buchwald H,Oien DM.Metabolic/bariatric surgery worldwide 2011[J].Obes Surg,2013,23(4):427-436.
[14]胡雪飞,邓琳,李世艳,等.气腹加温对腹腔镜手术患者术中体温及术后寒战的影响[J].当代护士(学术版),2012,(11):78-79.
