尿蛋白膜保存法与直接冻存法的成本效益分析
2014-06-15王明铭刘雪姣贾露露孙颖高友鹤李明喜
王明铭,刘雪姣,贾露露,孙颖,高友鹤,李明喜
尿蛋白膜保存法与直接冻存法的成本效益分析
王明铭1,2*,刘雪姣1,3*,贾露露4,5,孙颖1,高友鹤5,李明喜1
1 中国医学科学院 北京协和医学院 北京协和医院 肾内科,北京 100730 2 河北省邢台市人民医院 肾内科,河北 邢台 054000 3 首都医科大学附属北京安贞医院 肾内科,北京 100029 4 首都医科大学附属北京儿童医院,北京 100045 5 中国医学科学院 北京协和医学院 基础医学研究所 病理生理学系,北京 100005
为了比较尿液蛋白PVDF膜富集保存法 (尿膜) 和尿液直接冻存法两种方法的优缺点。通过比较两种方法在时间、所占空间、费用、蛋白降解程度及大样本临床实践性方面的区别。发现在所占空间、电费方面及临床实践性方面尿膜保存法优于直接冻存法,而在时间及耗材花费方面直接冻存法优于尿膜保存法。因此尿蛋白的尿膜保存法比直接冻存法有更强的实际应用价值。
尿液蛋白,富集保存方法,成本效益分析
尿蛋白质组学研究是人类蛋白质组学研究的重要组成部分。尿液蛋白质组学中主要的实验技术包括:尿蛋白的富集、分离及质谱鉴定三部分。高效全面的富集尿蛋白是进行后续研究的重要基础。目前常用的尿蛋白保存方法为尿液直接冻存法,富集蛋白方法包括有机溶剂沉淀法、超速离心法、冻干法和超滤法等[1]。其中有机溶剂沉淀法富集的蛋白种类最多,重复性也较好,是常用的尿液蛋白质分离和富集方法。许多研究发现在富集尿蛋白的有机溶剂中,综合富集效率、富集蛋白种类及重复性等因素,丙酮沉淀法效果较佳,应用较为普遍[2]。但上述方法步骤较繁琐、富集时间较长,不适于处理临床大样本量、大体积、低蛋白浓度及含盐高的尿液标本。因此,我们建立了一种简便易行、节能环保的尿蛋白富集保存方法——尿膜(Urimem) 富集保存法[3]。这种方法同时解决了尿蛋白富集和保存两个尿蛋白质组学中的重要步骤,可将尿蛋白直接结合到PVDF膜上,长期冷冻保存。简化了尿蛋白富集操作流程,节约了大量储存空间,使大样本量、大体积、低蛋白浓度的尿液蛋白储存成为可能,成为临床尿液蛋白质组学的研究基础。本文对尿液蛋白PVDF膜富集保存法和传统直接冻存法的成本效益进行了比较分析。
1 材料与方法
1.1 主要仪器和材料
50 mL离心管:(Corning centristar),超低温冰箱:–86 ℃ ULT FREEZER(Thermo Forma公司),低温离心机:BECKMAN COULTERTM Avanti TMJ-25contriguge (BECKMAN公司),0.2 μm PVDF膜:(Whatman公司) DZ-300A多功能真空封装机,AP系列无油隔膜真空泵:(天津奥特赛恩斯仪器有限公司)。
1.2 尿液收集
按常规留取尿液方法留取北京协和医院肾内科2012–2013年住院患者肾活检 (本院1 000例)前晨尿标本[4],尿常规检验确定尿蛋白浓度。尿液收集后立即冷却至4 ℃,5 000×g离心40 min去除脱落细胞、碎屑等,留取上清尿液。所有患者留取尿液前均签署知情同意书。
1.3 尿蛋白富集及保存
1.3.1 尿液直接冻存法
由上述步骤得到尿液样品50 mL三管直接冻存到–80 ℃冰箱中,尿蛋白富集参见文献[4]。
1.3.2 Urimem富集保存法
放置4张圆形滤纸在真空抽滤过滤瓶上(10 cm2过滤面积),将一张激活的PVDF膜置于滤纸上,将1 mol/L的磷酸二氢钠磷酸氢二钠缓冲液 (pH 6.0) 7 mL加入15 mL离心尿液。真空抽吸过滤瓶并加入22 mL离心尿液,调整真空泵压力使滤液通过PVDF膜滴下,整个过滤时间约4 min。结合蛋白的Urimem置于烤灯下约3–4 min,将干燥的膜及标签放置在无菌密封膜中,真空密封机封口,保存在–80 ℃冰箱[3]。每例患者留取3份Urimem,编码扫描后入库登记 (图1)。
1.4 评价指标
分别从两种方法操作时间、费用、样本占用冰箱空间等方面作成本效益分析,以最小成本分析法对两种方法进行比较[5]。
1.5 统计方法
应用SPSS13.0软件,两组间计量资料分别做正态性检验,符合正态分布后,两组计量资料采用独立样本t检验,P<0.05为有统计学意义。
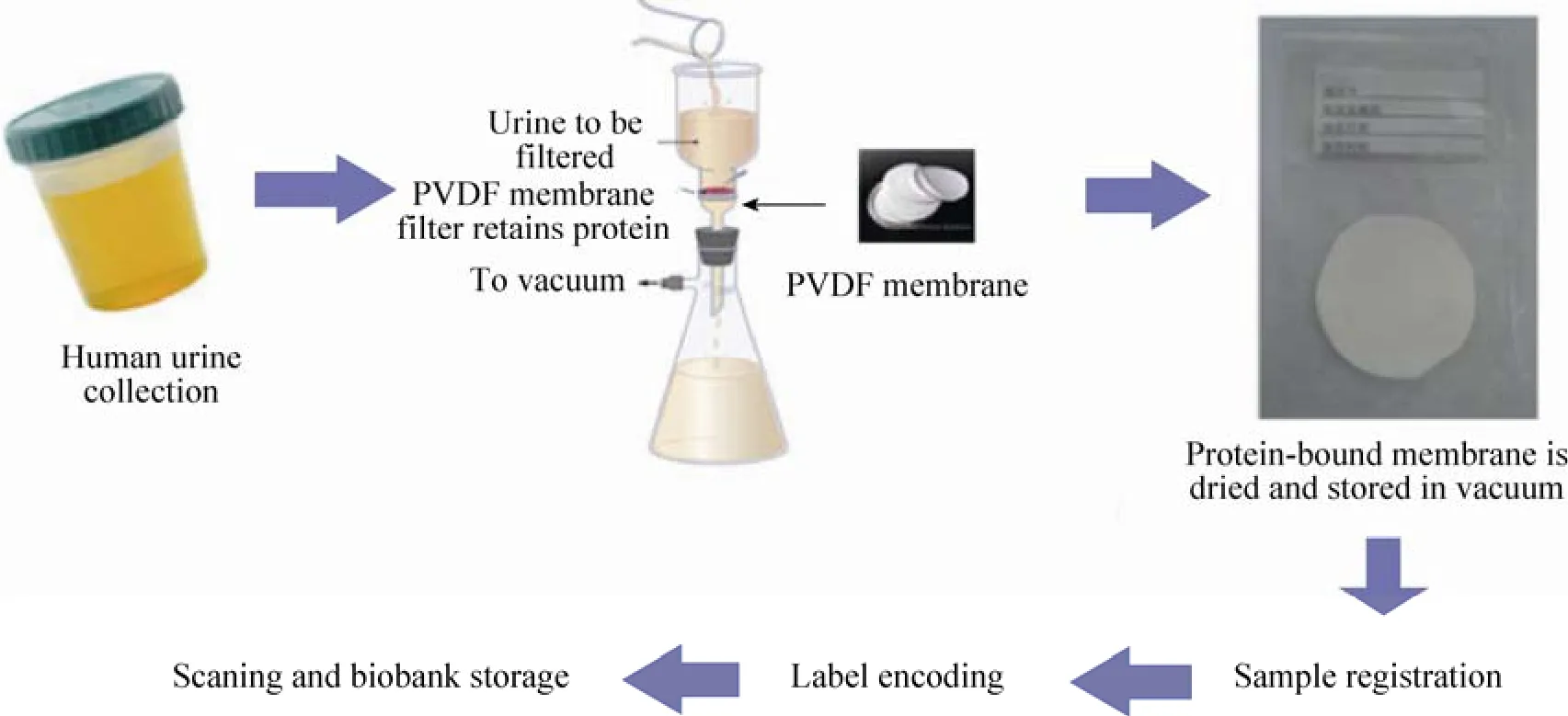
图1 尿膜尿蛋白富集保存法流程图Fig. 1 The flow chart of enrichment and preservation of urinary proteins using urimem.
2 结果与分析
两种方法成本分析见表1。
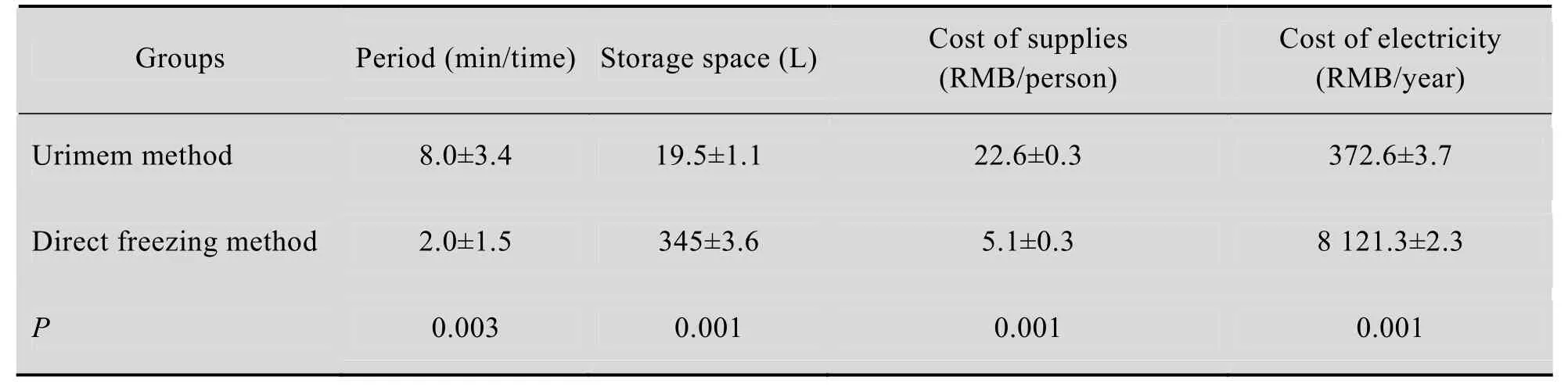
表1 两种方法成本分析Table 1 The analysis of two methods
2.1 所需时间
直接冻存法每次尿液收集及冻存需 (2.0± 1.5) min,Urimem法 (8.0±3.4) min/次;包括尿液过滤 (4.0±2.1) min、尿膜烤干 (3.0±1.3) min及封口 (1.0±0.5) min。
2.2 占用空间
直径3.5 cm、高度12 cm的50 mL离心管在冰箱中所占体积为12 cm×3.14×(3.5 cm/2)2=115 cm3,1 000例患者3管尿液所占空间为115 cm3×3管×1 000例= (345.0±3.6) L。
Urimem经过真空负压封口后塑封袋面积为6.5 cm×10 cm=65 cm2,单张膜的厚度不足0.1 cm,1 000例患者3份Urimem所占空间为65 cm2×0.1 cm×3管×1 000例= (19.5±1.1) L。
2.3 花费
2.3.1 耗材花费
直接冻存法50 mL离心管1.7元/个,每人3个花费 (5.10±0.30) 元/人。
膜保存方法需 (22.58±0.30) 元/人。包括PVDF膜22.10元/人 (30 cm×3 m/盒,约3 000元,可用于直径47 mm,面积10 cm2的圆形滤过膜407个,每张膜约7.37元,每人3张膜花费22.1元),滤纸0.48元/人 (直径12.5 cm 100张滤纸约16元/包,每次过滤尿液需用与滤过膜同样大小的4张滤纸,每包滤纸可用100例次,每人3次可供33人,花费0.5元/人)。
2.3.2 电费
直接冻存法每人3管尿液,占用低温冰箱体积为115 cm3×3管×1 000例=345 L,Thermo 85 L低温冰箱 (24 h功率5 kW) 需5个。医院平均电费0.89元/度,1 000例患者保存一年电费为5个×365 d×0.89元/度×5 kW= (8121.3±2.3) 元。
1 000例患者Urimem占用空间为65 cm2× 0.1 cm×3管×1 000例=19.5 L,保存一年电费为1个×365 d×0.89元/度×5 kW×19.5/85= (372.6±3.7) 元。
3 讨论
尿液蛋白质组学已日益受到国内外学者的重视,与其他生物标本相比,尿液收取具有无创、方便、易于大量留取等优点[6]。尿蛋白的组成主要包括血液经肾小球滤过的蛋白,肾脏和泌尿道中细胞分泌的蛋白及脱落细胞碎片等[7]。尿蛋白质组可以反映肾脏和泌尿生殖道功能的变化,有助于早期发现、诊断肾脏疾病以及治疗随访分析[8];另外,尿液中蛋白成分类似于血液,尿蛋白质组检测也可以反映其他器官的病理生理改变[9-10];尿液可能会成为生物标志物的金矿[11]。但尿蛋白质组受很多因素影响有较大的变异性,需大量的尿液样本用于潜在生物标志物的临床验证及评估。我们建立的Urimem尿蛋白富集保存法,具有简便易行、标本可长期保存等优点[3,11]。剪碎的Urimem在裂解液中洗脱,经过聚丙烯酰胺凝胶电泳,比较–80 ℃和室温下保存18 d的尿蛋白,发现二者电泳后蛋白条带相同,包括白蛋白及其他尿液中的高峰度蛋白;Urimem保存的尿蛋白,在室温、4 ℃、–20 ℃及–80 ℃ 4种不同温度条件下呈现相同的蛋白条带[3]。说明尿蛋白吸附到PVDF膜干燥后,不仅在低温下可以长期储存;甚至在常温下,也能保存较长时间,Urimem可用于蛋白质组学及疾病生物标志物的研究。但该方法与传统的尿液直接冻存法的成本效益比较,还需进一步分析明确。
我们对尿液直接冻存法和尿膜法从样本处理所需时间、样本占用空间及花费等几个方面进行了比较。以一年1 000例样本量计算,尿液直接冷冻法占用的空间 (345 L)约为尿膜法(19.5 L)的17倍。我们只需1个85 L冰箱就可保存4年4 000例患者Urimem标本,采用直接冻存法一年尿液标本就需要5个冰箱来保存。采用Urimem保存尿液标本显著减少生物样本库占用空间,减少了科研用地,适用于临床长期多次随访,大样本量尿蛋白的富集与保存及大数据库的建立。
样本处理及保存的总费用方面,尿膜法也优于直接冻存法。尽管Urimem耗材花费为直接冻存法的4倍,但1年电费直接冻存法 (8 121.3元) 约为尿膜法 (372.6元) 的21倍。如果计算大型冰箱采购及维护管理费用,直接冻存法的支出将明显增加;而尿膜法减少了多个冰箱采购和样本库维护费用,样本保存时间越长,Urimem保存法的成本优势越明显。
虽然样本处理时间尿膜法比直接冻存法略长,但与直接冻存比较,Urimem富集保存尿蛋白还具有蛋白降解率低、稳定性好等优点。为防止细菌繁殖及尿蛋白降解变性,尿液必须在短时间内低温冻存[12];且低温冻存不能完全阻止尿蛋白的降解,尿液在转运和实验过程中反复冻融也会加速蛋白的降解[13];Zhou等研究显示尿液保存在–80 ℃冻融后使蛋白降解14%,而–20 ℃则大部分蛋白会降解[14]。此外与干燥状态相比,尿蛋白在液体环境中更易发生降解。这些均极大影响了临床尿液蛋白质组学研究,Urimem富集的尿蛋白可冻干保存,蛋白稳定性提高,很好地克服了这些弊端。
尿液直接冷冻后,后续进行尿蛋白富集,传统富集方法步骤繁琐,富集蛋白所需有机试剂,均有较强的挥发性,对人体的毒副作用及对环境的污染明显[15];Urimem法每10 cm2PVDF膜可吸附保存20 mL尿液中的蛋白[3],富集效率高,环保,更适于长期、大规模操作。另外,临床样本的收集和后续研究很可能不在同一地点,这给标本的收集和运输带来很大不便。而尿膜法操作简便易行,便于运输。
4 结论
尿蛋白的膜保存法是一种简单经济的尿蛋白富集和储存方法,和尿液直接冻存法相比,有保存时间长、占用空间小、便于运输、操作性强等成本—效益优点,适用于大规模尿液蛋白样本的富集及保存。使临床大量尿液蛋白标本的保存成为可能,为临床尿液蛋白质组学研究奠定了基础。
REFERENCES
[1] Rodriguez-Suarez E, Siwy J, Zurbig P, et al. Urine as a source for clinical proteome analysis: from discovery to clinical application. Biochim Biophys Acta, 2014, 1844(5): 884–898.
[2] Thongboonkerd V. Current status of renal and urinary proteomics: ready for routine clinical application? Nephrol Dial Transplant, 2010, 25(1): 11–16.
[3] Jia L, Liu X, Liu L, et al. Urimem, a membrane that can store urinary proteins simply and economically, makes the large-scale storage of clinical samples possible. Sci China Life Sci, 2014, 57: 1–4.
[4] Liu XJ, Li MX, Sun W, et al. Analysis of factors influencing acetone precipitation of urinary proteins. Chin J Nephrol, 2011, 27(1): 51–52 (in Chinese).刘雪姣, 李明喜, 孙伟, 等. 丙酮沉淀法富集尿液蛋白的影响因素分析. 中华肾脏病杂志, 2011, 27(1): 51–52.
[5] Liu Q. Analysis of commonly used evaluation methods of medical economics. China J Modern Med, 2009, 19(12): 1913–1915 (in Chinese).刘勤. 卫生经济学常用评价方法浅析. 中国现代医学杂志, 2009, 19(12): 1913–1915.
[6] Albalat A, Mischak H, Mullen W. Clinical application of urinary proteomics/peptidomics. Expert Rev Proteomics, 2011, 8(5): 615–629.
[7] Hoorn EJ, Pisitkun T, Zietse R, et al. Prospects for urinary proteomics: exosomes as a source of urinary biomarkers. Nephrology (Carlton), 2005, 10(3): 283–290.
[8] Decramer S, Gonzalez DPA, Breuil B, et al. Urine in clinical proteomics. Mol Cell Proteomics, 2008, 7(10): 1850–1862.
[9] Sun W, Li F, Wu S, et al. Human urine proteome analysis by three separation approaches. Proteomics, 2005, 5(18): 4994–5001.
[10] Zurbig P, Dihazi H, Metzger J, et al. Urine proteomics in kidney and urogenital diseases: Moving towards clinical applications. Proteomics Clin Appl, 2011, 5(5/6): 256–268.
[11] Gao Y. Urine-an untapped goldmine for biomarker discovery? Sci China Life Sci, 2013, 56(12): 1145–1146.
[12] Pennemans V, Rigo JM, Penders J, et al. Collection and storage requirements for urinary kidney injury molecule-1 (KIM-1) measurements in humans. Clin Chem Lab Med, 2012, 50(3): 539–543.
[13] van de Vrie M, Deegens JK, van der Vlag J, et al. Effect of long-term storage of urine samples on measurement of kidney injury molecule 1 (KIM-1) and neutrophil gelatinase-associated Lipocalin (NGAL). Am J Kidney Dis, 2014, 63(4): 573–576.
[14] Zhou H, Yuen PS, Pisitkun T, et al. Collection, storage, preservation, and normalization of human urinary exosomes for biomarker discovery. Kidney Int, 2006, 69(8): 1471–1476.
[15] Thongboonkerd V. Practical points in urinary proteomics. J Proteome Res, 2007, 6(10): 3881–3890.
(本文责编 陈宏宇)
Comparison of cost-effectiveness between urimem and direct freezing for urinary protein preservation
Mingming Wang1,2*, Xuejiao Liu1,3*, Lulu Jia4,5, Ying Sun1, Youhe Gao5, and Mingxi Li1
1 Department of Nephrology, Peking Union Medical College Hospital, Chinese Academy of Medical Sciences/Peking Union Medical College, Beijing 100730, China 2 Department of Nephrology, Xingtai People's Hospital, Xingtai 054000, Hebei, China 3 Department of Nephrology, Beijing Anzhen Hospital, Capital Medical University, Beijing 100029, China 4 Beijing Children's Hospital, Capital Medical University, Beijing 100045, China 5 Department of Physiology and Pathophysiology, National Key Laboratory of Medical Molecular Biology, Institute of Basic Medical Sciences, Chinese Academy of Medical Sciences Peking Union Medical College, Beijing 100005, China
To compare two enrichment and preservation methods of urinary proteins, stored in polyvinylidene difluoride (PVDF) membrane (Urimem) or direct freezing, we examined the differences between the two methods in time, space, costs of supplies and electricity, degree of protein degradation and convenience of the sample handling. The urimem method is superior in the storage space, the cost of electricity and the clinical convenience compared to the direct freezing method. However, the direct freezing method is superior in the time and the cost of supplies to the urimem method. The enrichment and preservation of urinary proteins using urimem have more cost-effective benefits compared to those of the direct freezing method.
urine proteins, enrichment and preservation methods, cost-effective analysis
February, 26, 2014; Accepted: April 14, 2014
Mingxi Li. Tel: 86-10-69155351; Fax: 86-10-69155058; Email: mingxili@hotmail.com
王明铭, 刘雪姣, 贾露露, 等. 尿蛋白膜保存法与直接冻存法的成本效益分析. 生物工程学报, 2014, 30(7): 1128–1133.
Wang MM, Liu XJ, Jia LL, et al. Comparison of cost-effectiveness between urimem and direct freezing for urinary protein preservation. Chin J Biotech, 2014, 30(7): 1128–1133.
Supported by: Health and the Welfare industry Research Special Funds (No. 200702008), Key Projects in the National Science and Technology Pillar Program during the Twelfth Five-Year Plan Period (Nos. 2011BA110B00, 2011BA110B05).
Youhe Gao. Tel: 86-10-69156493; Fax: 86-10-65212284; Email: youhegao@163.com
*These authors contributed equally to this study.
卫生公益性行业科研专项基金 (No. 200702008),“十二五”国家科技支撑计划 (Nos. 2011BA110B00, 2011BA110B05) 资助。
时间:2014-05-28 网络出版地址:http://www.cnki.net/kcms/doi/10.13345/j.cjb.140099.html
