四氯化碳诱导小鼠肝脏纤维化的差异蛋白质组学
2014-06-15郭改改吴红星刘明伟丁琛秦钧杨晓明
郭改改,吴红星,刘明伟,丁琛,4,秦钧,4,杨晓明
研究报告
四氯化碳诱导小鼠肝脏纤维化的差异蛋白质组学
郭改改1,3,4,吴红星2,3,刘明伟3,丁琛3,4,秦钧3,4,杨晓明3
1 安徽医科大学病理生理学教研室,安徽 合肥 230032 2 浙江大学生命科学研究院,杭州 浙江 310058 3 国家蛋白质组学重点实验室 北京蛋白质组研究中心,北京 102206 4 军事医学科学院放射与辐射医学研究所,北京 100850
以四氯化碳 (Carbon tetrachloride,CCl4) 诱导小鼠肝组织纤维化为研究模型,发现并探讨纤维化肝组织与正常肝组织在蛋白质组水平上的差异。实验小鼠 (C57 BL/6) 随机分为两组,由橄榄油和四氯化碳诱导15周,并分别对这两组肝组织的全蛋白表达谱进行质谱检测,应用GO (Gene Ontology) 功能分类分析和KEGG (Kyoto Enyoolpedia of Genes and Genomes) 信号通路的富集分析方法对鉴定到的全蛋白表达谱进行差异表达分析。在对照组和实验组中,我们分别鉴定到17 382和20 486条特异性肽段,图谱平均利用率大于50%,共计鉴定到蛋白4 991种 (蛋白特异性肽段个数至少为1),其中差异表达蛋白有2 135种 (差异倍数大于或等于2),表达上调蛋白1 264种,下调蛋白871种。纤维化肝脏组织中与细胞外基质组成 (Extracellular matrix organization)、细胞骨架组成 (Cytoskeleton organization)、有机磷酸代谢 (Organophosphate metabolic process)、细胞定位 (Cellular localization) 和细胞组分调节 (Regulation of cellular component organization) 相关蛋白的表达是上调的;另外,与小分子代谢 (Small molecule metabolic process)、蛋白质转运 (Protein transport) 和有机氮化合物的代谢 (Organonitrogen compound metabolic process),以及四吡咯的合成过程 (Tetrapyrrole biosynthetic process) 有关蛋白的表达是下调的。信号通路富集分析结果表明,纤维化与VEGF和T细胞受体信号调节通路密切相关。结果提示,纤维化的形成不仅是一个复杂的信号转导过程,更是一个炎症与免疫相互促成的结果;增强肝实质细胞的存活,降低相关信号的传递及接收都有可能对纤维化的发生和发展起到抑制效果。
四氯化碳,肝脏组织纤维化,蛋白质组学
从世界范围来看,饮酒、肝炎病毒感染和非酒精性脂肪性肝炎是促使肝组织慢性损伤发展形成纤维化、肝硬化和肝癌的三大主要原因[1]。纤维化的肝脏组织内细胞外基质蛋白 (Extracellular matrix proteins,ECM) 明显增多,例如:胶原蛋白Ⅰ、Ⅲ和Ⅳ、纤维连接蛋白、弹性蛋白、层粘连蛋白、透明质酸和蛋白多糖等,这些蛋白主要是由肝星形细胞 (Hepatic stellate cells,HSCs) 和其分化形成的肌纤维样母细胞分泌而来[2-5]。静止期的HSC细胞,储存大量的维甲酸,并合成胶质纤维酸性蛋白质,处于激活状态下的HSC细胞,逐步分化形成肌纤维样母细胞,胞内储存的维甲酸和新合成的胶质纤维酸性蛋白质不断减少,同时合成大量胞外基质蛋白和α-平滑肌肌动蛋白 (α-smooth muscle actin,α-SMA)。细胞外基质积累最初形成结节,随着肝组织内部结构的改变进而发展形成肝硬化,并伴随肝功能障碍的产生[6]。
四氯化碳模型常用于肝脏纤维化治疗药物评估[1,7,8]。氧存在条件下,四氯化碳被还原,氯原子与碳原子间化学键发生断裂,形成多种氧自由基,引起细胞膜、核酸、功能蛋白等大分子的过氧化反应。早在20世纪70年代,就有研究显示肝纤维形成是一个可逆化过程[9],Schaffner等也证明肝纤维化是慢性肝损伤发展进程中最后一个可逆化病理应答阶段[10-11]。本研究以四氯化碳诱导小鼠肝脏组织纤维化为模型,探讨纤维化肝脏组织与正常肝组织在蛋白质组水平上的差异。
1 材料与方法
1.1 材料
1.1.1 实验动物与分组
纯系、雄性8周至10周龄C57 BL/6小鼠(北京华阜康生物科技股份有限公司) 10只,体重为 (20±2) g,随机平均分为两组,一组为对照组,腹部皮下注射橄榄油进行处理,另一组为实验组,腹部皮下注射四氯化碳 (溶解于橄榄油) 进行诱导。
1.1.2 试剂
CCl4购自北京化学试剂公司,橄榄油购自Sigma公司,乙腈和水购自Avantor Performance Materials 公司,Masson染色试剂盒购自北京中山金桥公司。
1.1.3 主要仪器
Rigol-L3000高效液相色谱 (北京普源精电科技有限公司),Nano LC-ultra高效液相色谱(Eksigent公司),Triple-TOF 5600 Plus (AB SCIEX公司)。
1.2 方法
1.2.1 纤维化动物模型
诱导剂为含40%四氯化碳的橄榄油溶液,诱导期间一周注射两次,第1次以每100 g小鼠体重,按0.5 mL的计量进行皮下注射,第2次以0.3 mL的计量进行注射,诱导期限为15周[12]。
1.2.2 纤维化鉴定
小鼠肝组织进行石蜡包埋与组织切片,应用Masson染色方法进行病理学鉴定[13]。
1.2.3 蛋白样品制备、分离与质谱鉴定
肝组织样品0.5 g,8 mol/L Urea裂解液中充分裂解;各组中包含的5只小鼠肝脏组织分别提供80 μg蛋白样品,合并后进行还原烷基化(共计400 μg),加入二硫苏糖醇 (Dithiothreitol,DTT) 至终浓度为1 mmol/L,56 ℃,反应30 min;冷却后,加入碘乙酰胺 (Iodoacetamide,IAA) 至终浓度为2 mmol/L,避光反应30 min;再次加入DTT至终浓度为1 mmol/L,避光反应15 min;向反应体系中加入1 mmol/L CaCl2、5倍体积25 mmol/L Tris (pH 8.2) 和8 μg胰蛋白酶,37 ℃,消化8–12 h。
肽段样品首先用Rigol-L3000高效液相色谱进行第一次分离,溶液A:水-乙腈 (V∶V= 98∶2);溶液B:水-乙腈(V∶V=2∶98),NH3·H2O调节pH 10。色谱柱类型:AGELA C18,5 μm,150 A° 4.6 mm×250 mm;柱温45 ℃,流速1 mL/min,液相中A在不同时间点所含比例(A/A+B) 为:95% (0 min)、88% (5 min)、78% (21 min)、68% (32 min)、10% (36 min)、95% (40 min),每组共计接收40个级分,其中30个为有效级分。
1.2.4 蛋白质的定性与定量
将第一次分离所得的30个级分分别溶解于100 μL溶液C中,12 000 r/min,离心10 min,取上清,相邻3个样品合并后进行第二次分离和蛋白鉴定,蛋白样品上样载量为1 μg。肽段样品第二次分离中溶液C:水-乙腈-甲酸(V∶V∶V= 98∶1.9∶0.2),溶液D:乙腈-水-甲酸 (V∶V∶V= 98∶1.9∶0.2),pH 3。第二次分离中溶液C在不同时间点所含比例 (C/C+D)为:95% (0 min)、92% (5 min)、77% (21 min)、47% (55 min)、37% (65 min)、5% (75 min),喷雾电压2.5 kV,毛细管温度为RT,碰撞能量为Rolling CE(系统根据一级质谱信息,及预设参数自动调整),一级采集质量范围:350–1 250 Da,二级采集质量范围:100–1 500 Da,富集柱类型:自制,填料C18,填料直径5 μm,柱内径100 μm,长20 mm,分离柱类型:自制,填料C18,填料直径3 μm,柱内径75 μm,长120 mm,流速:330 nL/min,系统柱压:≤4 000 PSI。
搜索引擎: ProteinPilot Software Beta (4.2),数据库:NCBI_Mus musculus Ref-seq (34 361 proteins, updated on 07-04-2012),一级误差:10 ppm,二级误差:20 ppm。
我们应用基于强度的绝对定量方法(Intensity based absolute quantification, or iBAQ)[14-15],对鉴定到的蛋白质进行定量,依照两组内iBAQ值之间的比值对特定蛋白的表达变化进行评定。
2 结果
2.1 四氯化碳诱导肝脏组织纤维化模型
随机分配的两组小鼠中,对照组注射橄榄油进行诱导,实验组注射四氯化碳 (溶剂为橄榄油) 进行诱导。在肝脏组织纤维化模型建立过程中,一周期限之内,实验对象接受诱导剂注射次数为两次,诱导持续时间为15周。在进行蛋白质组学分析之前,首先对实验组和对照组肝脏组织的纤维化程度进行病理学鉴定 (图1A)。两组肝组织的Masson染色结果显示,在四氯化碳诱导小鼠的肝脏组织染色结果中,由Masson染色的胶原蛋白 (呈蓝色) 明显比对照组肝脏组织的胶原蛋白多。另外,该结果还显示,胶原蛋白主要分布于细胞外基质中,并且成纤维状态存在,表明四氯化碳诱导15周致使小鼠肝脏纤维化形成 (图1B)。
2.2 组织全蛋白表达谱分析
在进行差异表达蛋白谱分析之前,样品首先进行高效液相色谱分离,随后,对实验组和对照组肝脏组织的蛋白质表达全谱进行质谱鉴定,其中,对照组小鼠肝脏组织全蛋白表达谱鉴定结果中,10个组分质谱扫描谱图的平均利用率>50%,得到高可信度肽段共计17 382;实验组中,谱图的平均利用率>50%,得到的高可信度肽段共计20 486;两组共计鉴定到4 991种蛋白 (特异性肽段数量大于或等于1),其中对照组鉴定到4 527种蛋白,实验组鉴定到4 797种蛋白 (图2A)。另外,差异表达蛋白有2 135种,实验组中,表达上调的蛋白有1 264种 (与对照组的iBAQ比值大于或等于2),表达下调的蛋白 (与对照组的iBAQ比值小于0.5) 有871种 (图2B)。
2.3 差异表达蛋白谱分析
首先,我们对表达上调的1 264种蛋白和表达下调的871种蛋白进行了GO生物功能富集分析,结果显示,表达上调的蛋白除了具有细胞外基质组成功能 (Extracellular matrix organization)以外,还具有细胞骨架组成 (Cytoskeleton organization)、有机磷酸代谢(Organophosphate metabolic process) 的功能;另外,四氯化碳诱导组中,表达下调的蛋白在小分子代谢(Small metabolic process)、蛋白质转运(Protein transport)和有机氮化合物的代谢 (Organonitrogen compound metabolic process) ,以及四吡咯的合成过程 (Tetr-apyrrole biosynthetic process) 有明显的富集现象 (图3A和3B,附表2)。
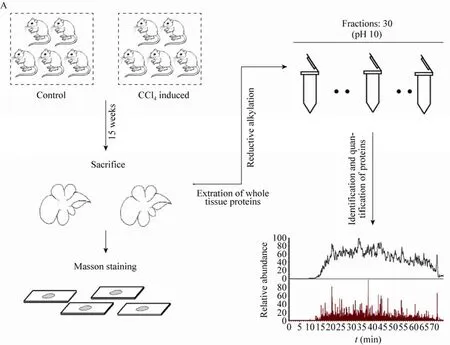

图1 对照组与四氯化碳诱导组小鼠肝脏组织中全蛋白表达谱的鉴定流程 (A) 及肝脏组织纤维化病理学鉴定 (B)Fig. 1 A workflow for proteome screening of CCl4-induced and control liver (A) and pathological analysis of liver fibrosis (B).

图2 两组肝脏组织中全蛋白表达谱的蛋白鉴定数量 (A) 和四氯化碳诱导肝脏组织中差异表达蛋白的数量(B)Fig. 2 General view of liver proteome identified by MS platform in two groups (A) and Differentially expressed proteins in CCl4-induced mouse liver tissue compared to control group (B).


图3 四氯化碳诱导小鼠肝脏组织中差异表达蛋白的GO_BP富集分析 (A) 及其统计学分析 (B) (P<0.01)Fig. 3 GO_BP enrichment analysis of differentially expressed proteins in CCl4-induced mouse liver tissue (A) and its statistical analysis (B). P<0.01.
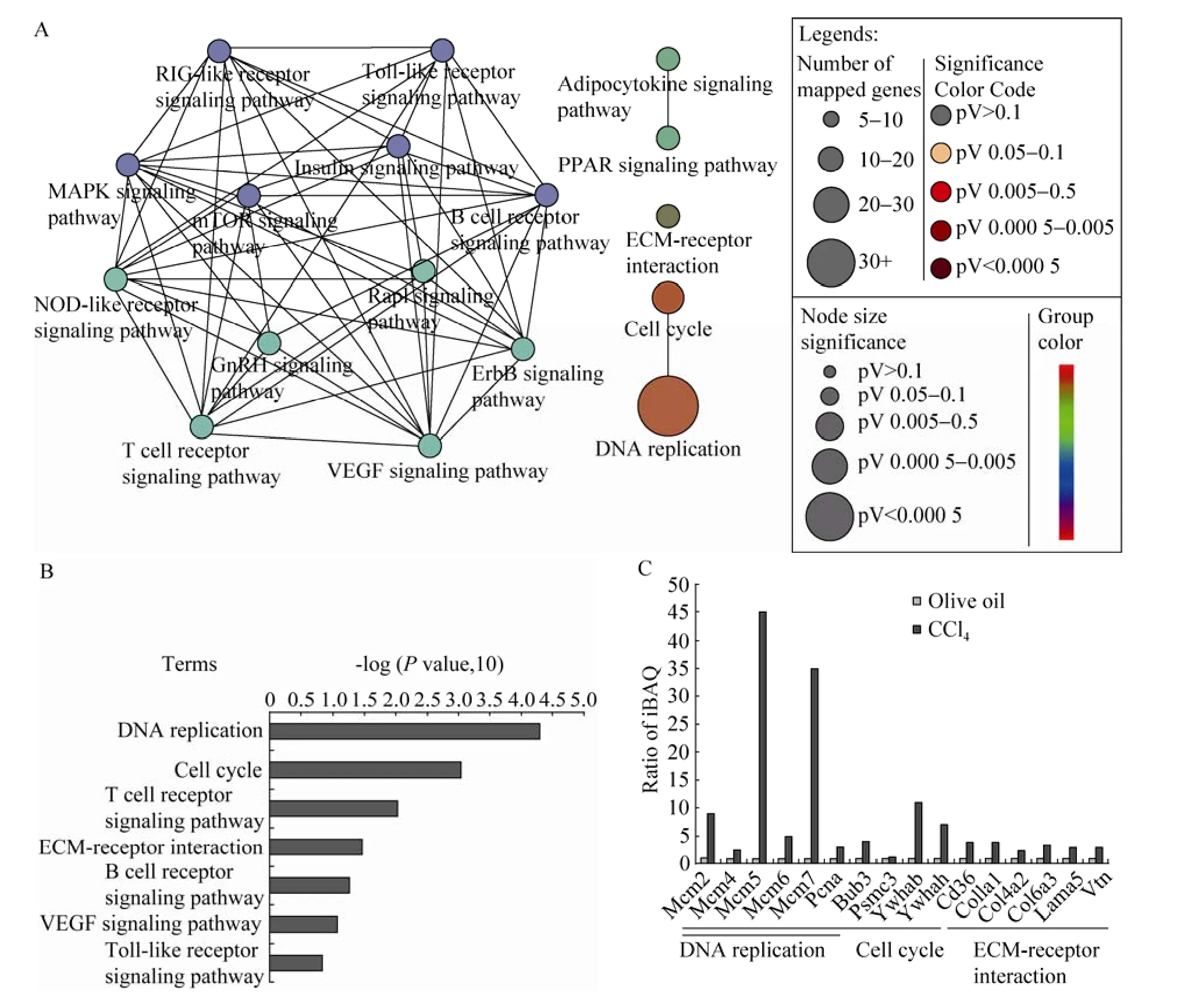
图4 表达上调蛋白的信号通路富集分析(A:四氯化碳诱导小鼠组织中上调表达蛋白的KEGG信号通路富集分析;B:四氯化碳诱导小鼠肝脏组织上调表达蛋白中显著富集通路的统计学分析;C:DNA复制、细胞周期和细胞外基质-受体相互作用信号通路中鉴定到的蛋白在两组中的表达量)Fig. 4 Enrichment analysis of signaling pathways in up-regulated proteins. (A) KEGG_pathway enrichment analysis of up regulated proteins in CCl4-induced mouse liver tissue. (B) Statistical analysis of KEGG_pathways enriched in up regulated proteins in CCl4-induced mouse liver tissue. (C) Relative abundance of identified proteins that belong to DNA replication, cell cycle and ECM-receptor interaction in two groups.
2.4 表达上调蛋白的信号通路分析
为了对纤维化肝组织代谢特征得到更进一步的认识,我们对在纤维化肝组织中差异表达蛋白调节的信号通路进行了分析,上调表达的1 264种蛋白的KEGG信号通路分析结果显示,实验组中与VEGF、T细胞受体、B细胞受体和Toll样受体等信号通路相关蛋白有明显的上调趋势 (图4A、4B),提示四氯化碳诱导的肝纤维化过程与免疫系统中天然免疫和获得性免疫均密切相关,与Park[1]、Iredale[5]和Radaeva等[16]的研究结果相符。另外,四氯化碳诱导组中DNA复制、细胞周期和细胞外基质-受体相互作用这3个信号通路有显著的富集现象(图4C),提示,纤维化进程中,肝实质细胞或是非实质细胞经历了再生和增殖的过程,而这一现象可能与细胞外基质-受体相互作用是相联系的。

图5 表达下调蛋白的信号通路分析(A:四氯化碳诱导小鼠组织中下调表达蛋白的KEGG信号通路富集分析;B:四氯化碳诱导小鼠肝脏组织下调表达蛋白中显著富集信号通路鉴定到的蛋白数量)Fig. 5 Enrichment analysis of signaling pathways in down-regulated proteins. (A) KEGG_pathway enrichment analysis of proteins down regulated in CCl4-induced mouse liver tissue. (B) Protein identifications of down regulated pathways in CCl4-induced mouse liver tissue.
2.5 表达下调蛋白的信号通路分析
对表达下调的871种蛋白进行KEGG信号通路分析,我们发现,从信号通路鉴定蛋白数量上看,四氯化碳诱导组中发现有20种属于剪切体的蛋白表达是下调的 (图5A),提示,纤维化后, 肝脏细胞内大量功能蛋白质的结构和表达发生变化,这很可能与蛋白在mRNA水平的剪切结果有关。另外,从信号通路相关蛋白的鉴定概率 (Number of mapped genes) 来看,与硫胺素代谢(Thiamine metabolism)、聚糖降解(Other glycan degradation)、SNARE相关囊泡运动(SNARE interactions in vesicular transport)、牛磺酸和亚牛磺酸代谢(Taurine and hypotaurine metabolism)、初级胆酸合成(Primary bile acid biosynthesis)以及泛酸与CoA的合成(Pantothenate and CoA biosynthesis)通路相关蛋白的富集度都高于18%,其中在硫胺素代谢通路里的蛋白覆盖率达到50% (图5B)。硫胺素属于胞内诸多代谢酶类的辅酶[17];硫胺 (维生素B1) 缺乏症能够导致人类特定脑区域和实验动物模型局灶性脑坏死[18],同时,Giada[19]等在对大鼠模型中的研究结果,也证明硫胺素缺乏会引起氧化氮的产生减少、血管功能异常。综合以上研究结果显示,纤维形成可能与肝组织和神经细胞代谢功能异常是密切相关的,另外,血管循环系统的功能异常有可能与纤维形成过程相关。
3 讨论
20世纪90年代至今,质谱应用已经从同位素发现和鉴定,扩展到生物研究领域,它的飞跃发展,使得解决大规模覆盖生物蛋白质组问题成为可能[20]。目前,蛋白质组学策略中倾向于采用预分级分离和延长HPLC/MS/MS鉴定梯度的手段,来克服样品的复杂性问题[21],但这些常用方法实验周期长、成本高。而本研究串联使用高效液相反相色谱,对肽段样品进行两次分离,不仅使样品复杂度得到降低,还令工作效率得到提升[22]。
我们选用四氯化碳诱导的肝纤维化模型进行研究,首次提出纤维形成不仅与VEGF信号通路相关,还与T细胞受体、B细胞受体和Toll样受体信号通路等多个通路的激活密切联系。同时,纤维化肝组织中,与细胞外基质-受体相互作用有关的诸多蛋白的表达有明显上调现象,因此,我们提出,纤维化形成最初可能是“纤维诱导信号”向正常组织或细胞的传入过程,例如:肝实质细胞坏死、炎症细胞的聚集或是HSC细胞的过度激活,即包括细胞因子的信号传导作用也包含膜受体的信号接收过程。因此,降低细胞外基质与肝组织内不同类型细胞的相互作用,中断胞外信号向正常肝细胞内部的转导,理论上,会对纤维化的发展起到一定的治疗作用。
肝纤维化已成为威胁人类健康的重要问题之一[23]。肝脏组织受到药物、酒精或物理等损伤后,枯否氏细胞、肝实质细胞、胆管细胞、和T 细胞等多种细胞之间通过信号传导作用,迅速构成炎性微环境[24],这种微环境刺激静止期的肝脏星形细胞HSC分化发育形成肌纤维样母细胞,激活的肌纤维样母细胞具有表达平滑肌肌动蛋白 (a-SMA) 和多种胞外基质蛋白的特性,并最终促进纤维化的形成[25-27]。总而言之,纤维化中出现不同类型细胞的异常激活与增殖现象,我们的研究结果首次从蛋白质组学角度上证明,四氯化碳诱导的肝纤维化与DNA复制以及细胞周期相关蛋白的表达相关,由此得出,如果从保护肝实质细胞的角度来进行药物筛选,也将有可能缓解肝纤维化的进程。
REFERENCES
[1] Park O, Jeong WI, Wang L, et al. Diverse roles of invariant natural killer T cells in liver injury and fibrosis induced by carbon tetrachloride. Hepatology, 2009, 49(5): 1683–1694.
[2] Bataller R, Brenner DA. Liver fibrosis. J Clin Invest, 2005, 115(2): 209–218.
[3] Iredale JP. Models of liver fibrosis: exploring thedynamic nature of inflammation and repair in a solid organ. J Clin Invest, 2007, 117(3): 539–548.
[4] Friedman SL, Rockey DC, Bissell DM. Hepatic fibrosis 2006: report of the third AASLD single topic conference. Hepatology, 2007, 45(1): 242–249.
[5] Friedman SL. Mechanisms of hepatic fibrogenesis. Gastroenterology, 2008, 134(6): 1655–1669.
[6] Friedman SL. Hepatic stellate cells: protean, multifunctional, and enigmatic cells of the liver. Physiol Rev, 2008, 88(1): 125–172.
[7] Ma JQ, Ding J, Zhang L, et al. Ursolic acid protects mouse liver against CCl4-induced oxidative stress and inflammation by the MAPK/NF-κB pathway. Environ Toxicol Pharmacol, 2014, 37(3): 975–983.
[8] Li W, Wu Y, Zhu C, et al. Anti-fibrosis effects of Huisheng oral solution in CCl4-induced hepatic fibrosis in rat. Indian J Pharmacol, 2014, 46(2): 216–221.
[9] Soyer MT, Ceballos R, Aldrete JS, et al. Reversibility of severe hepatic damage caused by jejunoileal bypass after reestablishment of normal intestinal continuity. Surgery, 1976, 79(5): 601–604.
[10] Schaffner F, Klion FM. Chronic hepatitis. Annu Rev Med, 1968, 19: 25–38.
[11] Albanis E, Friedman SL. Hepatic fibrosis. Pathogenesis and principles of therapy. Clin Liver Dis, 2001, 5(2): 315–334, v–vi.
[12] Wasser S, Tan CE. Experimental models of hepatic fibrosis in the rat. Ann Acad Med, 1999, Singapore. 28: 109–111.
[13] Nagaraj N, Wisniewski JR, Geiger T, et al. Deep proteome and transcriptome mapping of a human cancer cell line. Mol Syst Bil, 2011, 7: 548.
[14] Nakamura T, Sakata R, Ueno T, et al. Inhibition of transformin growth factor beta prevents progression of liver fibrosis and enhances hepatocyte regeneration in dimethylnitrosamine-treated rats. Hepatology, 2000, 32(2): 247–255.
[15] Michael JP. Reversibility of liver fibrosis and cirrhosis following treatment for hepatitis C. Gastroenterology, 2002, 122: 1525–1528.
[16] Radaeva S, Sun R, Jaruga B, et al. Natural killer cells ameliorate liver fibrosis by killing activated stellate cells in NKG2D-dependent and tumor necrosis factor-related apoptosis-inducing ligand–dependent manners. Gastroenterology, 2006, 130(2): 435–452.
[17] Liu S, Miriyala S, Keaton MA, et al. Metabolic effects of acute thiamine depletion are reversed by rapamycin in breast and leukemia cells. PLoS ONE, 2014, 9(1): e85702.
[18] Hamada S, Hirashima H, Imaeda M, et al. Thiamine deficiency induces massive cell death in the olfactory bulbs of mice. J Neuropathol Exp Neurol, 2013, 72(12): 1193–1202.
[19] Giada CR, Capettini LS, Cruz JS, et al. Thiamine deficiency leads to reduced nitric oxide production and vascular dysfunction in rats. Nutr Metab Cardiovas Dis, 2014, 24(2): 183–188.
[20] Nagaraj N, Wisniewski JR, Geiger T, et al. Deep proteome and transcriptome mapping of a human cancer cell line. Mol Syst Biol, 2011, 7: 548.
[21] Thakur SS, Geiger T, Chatterjee B, et al. Deep and highly sensitive proteome coverage by LC-MS/MS without prefractionation. Mol Cell Proteomics, 2011, 10(8): M110. 003699.
[22] Ding C, Jiang J, Wei JY, et al. A fast workflow for identification and quantification of proteomes. Mol Cell Proteomes, 2013, 12(8): 2370–2380.
[23] Zhao Q, Feng Y, Jia X, et al. Proteome analysis of hepatic non-parenchymal cells of immune liver fibrosis rats. Sci China Life Sci, 2014, 57(3): 303–314.
[24] Friedman SL. Liver fibrosis--from bench to bedside. J Hepatol, 2003, 38(Suppl 1): S38–53.
[25] Mann DA, Smart DE. Transcriptional regulation of hepatic stellate cell activation. Gut, 2002, 50(6): 891–896.
[26] Liu C, Gaca MD, Swenson ES, et al. Smads 2 and 3 are differentially activated by transforming growth factor-beta (TGF-beta) in quiescent and activated hepatic stellate cellse constitutive nuclear localization of Smads in activated cells is TGF-beta-independent. J Biol Chem, 2003, 278(13): 11721–11728.
[27] Canbay A, Friedman S, Gores GJ. Apoptosis: the nexus of liver injury and fibrosis. Hepatology, 2004, 39(2): 273–278.
(本文责编 郝丽芳)
Differential proteome analysis of carbon tetrachlorideinduced mouse liver fibrosis
Gaigai Guo1,3,4, Hongxing Wu2,3, Mingwei Liu3,Chen Ding3,4, Jun Qin3,4, and Xiaoming Yang3
1 Department of Pathophysiology, Anhui Medical University, Hefei 230032, Anhui, China 2 College of Life Sciences, Zhejiang University, Hangzhou 310058, Zhejiang, China 3 Beijing Proteome Research, State Key Laboratory of Proteomics, Beijing 102206, China 4 Institute of Radiation Medicine, Academy of Military Medical Sciences, Beijing 100850, China
To explore the differential proteome pattern in mouse fibrosis liver in comparison to wild type. Mice were fed with carbon tetrachloride or olive oil vehicle for 15 weeks. Mouse livers from both groups were collected and submitted to MS platform for proteome screening. GO (Gene Ontology) biological process and KEGG (Kyoto Enyoolpedia of Genes and Genomes) pathway enrichment analysis were used to analyze differentially expressed proteins. As the results, we identified 17 382 and 20 486 unique peptides in control and carbon tetrachloride-induced groups, respectively. A total of 4 991 proteins (at least 1 unique peptide matched) were identified, of which 2 135 were differentially expressed (≥2 fold). In fibrosis mouse liver 1 264 proteins were up regulated and 871 proteins were down regulated. Proteins associated with DNA replication, cell cycle, ECM-receptor interaction, and splicesome were significantly increased in carbon tetrachlorideinduced group. Proteins associated with small molecule metabolic process, protein transport, organonitrogen compound metabolic process, and tetrapyrrole biosynthetic processes were down regulated in carbon tetrachloride-induced mouse liver fibrosis tissue. Bioinformatics findings showed that fibrosis was closely related to the regulation of VEGF and T cell receptor signaling pathway, and further suggested that liver fibrosis was a complex signal transduction process that many biological processes such as liver metabolism, inflammation, and immune response are involved. Based this study, we can envision that protection of protein metabolism in liver parenchymal cells and blocking of inflammatory signaling transduction may be beneficial for liver fibrosis therapy.
carbon tetrachloride, liver fibrosis, proteomics
February 25, 2014; Accepted: May 6, 2014
Xiaoming Yang. E-mail: xmyang2@nic.bmi.ac.cn Jun Qin. E-mail: jqin@bcm.edu
郭改改, 吴红星, 刘明伟, 等. 四氯化碳诱导小鼠肝脏纤维化的差异蛋白质组学. 生物工程学报, 2014, 30(7): 1105−1114.
Guo GG, Wu HX, Liu MW, et al. Differential proteome analysis of carbon tetrachloride-induced mouse liver fibrosis. Chin J Biotech, 2014, 30(7): 1105−1114.
Supported by: National Natural Science Foundation of China (No. 31170779).
国家自然科学基金 (No. 31170779) 资助。
