载脂蛋白E等位基因ε4在重型脑损伤急性期脑电活动中作用
2014-06-14贺绪智徐伦山许民辉张承蕖
贺绪智,徐伦山,许民辉,但 炜,张承蕖,董 倩
1.第三军医大学大坪医院野战外科研究所神经外科,重庆 400042;2.重庆医科大学附属一院神经外科,重庆 400016
近年来研究发现,遗传因素在创伤性脑损伤 (Traumatic brain injury,TBI)后的病情发展方面起不同程度的作用[1,2]。已有研究证明,遗传因素载脂蛋白E(Apolipoprotein E,APOE)基因及其启动子区多态性是影响TBI急性期病情及预后的重要因素[3~8]。脑电图在监测TBI伤情发展方面具有重要作用。本文先前的研究发现,APOE基因多态性影响轻-中型TBI急性期脑电活动的改变[9]。为了解在重型TBI患者的急性期,APOE基因多态性对脑电活动是否有相似的作用,我们进行了研究。结果报告如下。
1 资料与方法
1.1 一般资料 本研究纳入标准:(1)有确切的TBI病史;(2)为闭合性颅脑损伤,且在伤后48 h内入院;(3)格拉斯哥昏迷评分,(Glasgow Coma Scale,GCS)≤8;(4)手术患者的首次脑电图监测在术后进行(伤后72 h内)。排除标准:(1)伤前有颅脑损伤、颅内占位性病变、颅脑手术及脑炎等病史;(2)既往有严重的中枢神经系统遗传变性、精神病、高血压、糖尿病、痴呆及癫痫等疾病;(3)低温及应用对脑电图有影响的药物后行脑电图监测;(4)有严重的合并伤;(5)首次脑电图监测后血肿明显扩大或再手术;(6)头皮损伤或手术切口影响脑电图监测;(7)因患者烦躁影响脑电图监测。
按以上标准,收集第三军医大学大坪医院神经外科2008年9月-2013年3月重型TBI患者65例,其中男性47例,女性18例,平均年龄40.83岁。记录每例患者的相关临床资料。
1.2 脑电图监测 采用美国Cadwell公司16导动态脑电图记录仪,所有患者均按照国际10/20系统安放盘状电极,作16导单极导联(Fp1、Fp2、F3、F4、C3、C4、P3、P4、O1、O2、F7、F8、T3、T4、T5、T6),耳电极为参考电极,盘状电极用火棉胶固定于头皮。检测时间:限定在伤后1周内,伤后1~3 d和5~7 d内各作一次>24 h的连续脑电图监测,确保能采集到足够无严重干扰的脑电图。
1.3 脑电图变化情况判读 参照Hockzday[10]对昏迷或清醒患者脑电图分级判读方法,结合本研究病例脑电图均以慢波或平坦脑电波为主的特点,将脑电图结果分为5级,Ⅰ级:以α节律为主,但其指数偏低,伴有θ或δ波;Ⅱ级:以θ节律为主,或伴少量α、β波;Ⅲ级:以δ节律为主,或伴少量平坦波(暴发-抑制波)或α昏迷、β昏迷;Ⅳ级:以平坦脑电波为主(波幅10~20 μⅤ),间或有少量θ、δ波;Ⅴ级:单一平坦脑电波。每次脑电图监测结果均按上述标准分级。对每例患者,与第一次比较,如脑电图分级由Ⅰ向Ⅴ级方向发展,判定为脑电图恶化;反之,判定为脑电图稳定。
1.4 APOE基因型鉴定 根据前期的研究方法[9],运用聚合酶链反应限制性片段长度多态性(PCRRFLP)对所有患者进行APOE基因型检测。将电泳结果与表1加以对照,得出分型结果。见表1。

表1 不同APOE基因片段判读简图
1.5 统计学处理 采用SPSS 15.0统计软件进行分析,计数资料采用χ2检验;非条件二分类Logistic多因素回归分析引起伤后脑电图恶化的相关因素。
2 结果
2.1 脑电图结果 本组65例首次脑电图均异常,主要表现为局部或普遍性慢波或平坦波,低波幅,按上述脑电图分级标准判读。见表1。

表2 各次脑电图分级结果及恶化情况
2.2 APOE基因鉴定结果 本组65例患者经检测共 有5种基因型:ε2/3为10例;ε2/4为1例;ε3/3为42例;ε3/4为11例;ε4/4为1例。其中APOEε4携带者13例。ε2、ε3、ε4等位基因分布频率符合遗传学Hardy-Weinberg平衡定律。
2.3 ε2、ε3、ε4 等位基因与重型 TBI后脑电图变化的关系 65例患者脑电图恶化21例,其中8例为ε4携带者(n=13),13例为非ε4携带者(n=52),前者比例(61.5%)明显高于后者(25%,P=0.0117);而 ε2、ε3 携带者中脑电图恶化的比例与非ε2、ε3携带者比较,差异无统计学意义(P>0.05)。见表3。
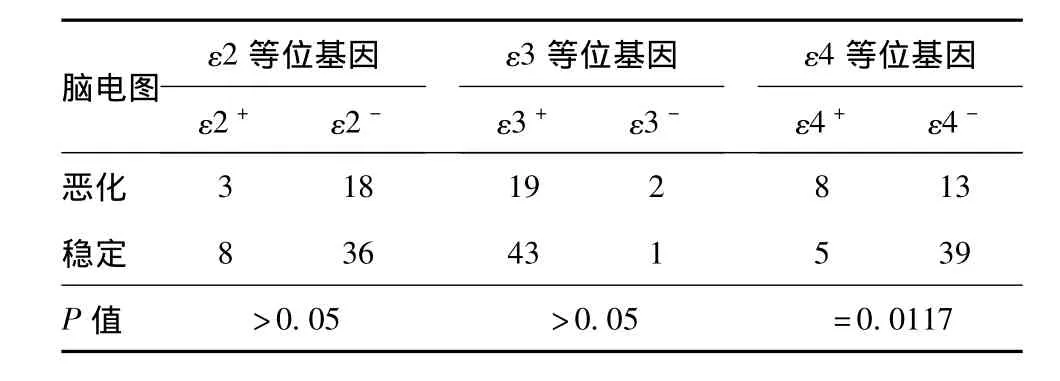
表3 ε2、ε3、ε4携带者脑电图变化情况
2.4 脑电图变化组相关临床资料比较 脑电图恶化组与脑电图稳定组在性别、年龄、烟酒嗜好、GCS评分、受伤机制及临床治疗等构成上差异无统计学意义(P >0.05)。见表4。

表4 脑电图恶化组与脑电图稳定组相关临床资料比较
应用非条件二分类logistic回归多因素分析ε2、ε3、ε4携带者脑电图变化情况与性别、年龄、烟酒嗜好、GCS评分、CT表现、临床治疗及受伤机制等因素的相关性。结果显示,ε4与脑电图恶化存在显著的相关性 (P=0.016,OR=4.8,95%CI=1.33~17.29)。
3 讨论
TBI是随机事件,其发生与遗传因素关系不大,但是,TBI后病情的发展及预后,与遗传因素有着密切的联系[1,2]。目前研究表明,遗传因素 APOE 多态性既影响TBI早期阶段的病理改变[3]和急性期的病情发展[5-8],同时也影响重型 TBI的预后[11]。这些影响不仅发生在 TBI后的神经生物学代谢方面,同时也发生在TBI后的脑电活动方面[9]。
3.1 AOPE多态性与重型TBI apoE是血浆中重要的载脂蛋白,编码apoE的基因(AOPE)具有多态性,包括 APOEε2、APOEε3、APOEε4 3 个等位基因,分别表达apoE2、apoE3和 apoE4 3种不同的蛋白亚型[12]。脑是合成 apoE的第二大器官。在中枢神经系统里,apoE促进突触发生,同时也调节胆固醇、磷脂及硫脂(sulfatides,ST)的运输,在调节神经损伤的修复及脑抗炎免疫应答方面,apoE也发挥着重要作用[13~15]。这些作用存在 APOE亚型特异性,在重型TBI患者中也有体现,与非APOEε4携带者比较,APOEε4携带者6个月后的神经心理学和神经行为学功能更差[16],2年后脑功能的康复好转率,APOEε4 携带者明显偏低[11](P < 0.05)。另外,APOEε4也是重型TBI迟发性癫痫的危险因素,而APOEε2是保护性因素[17]。但是,近期的一些报道又有不同的意见[18,19],研究者认为,APOEε4 与重型脑伤的预后无相关性。这几项研究都是在TBI的后期。研究发现,在 TBI的急性期,白色人种的APOEε4与TBI早期阶段的病理改变及严重性有关[3,4],黄色人种的 APOEε4 及其启动 -491AA 是TBI急性期病情恶化的危险因素[5~8],但 APOE 多态性与TBI急性期CT影像学上的血肿增加和迟发性血肿无关[20]。这些研究提示,APOEε4在 TBI急性期就开始发挥负向调节作用,这种负向调节作用不完全发生在形态学上,可能也发生在apoE参与的神经代谢或脑功能上起负向调节作用。我们前期对轻-中型 TBI的研究证实了这一点,并发现APOEε4对轻-中型TBI患者急性期的脑电图起负向调节作用[9]。本文同时对重型 TBI的急性期,APOEε4在脑电活动方面是否也起负向调节作用进行研究。
3.2 APOEε4对重型TBI后脑电图的影响 本研究发现,13例APOEε4携带者中,8例出现脑电图恶化,52例非APOEε4中,仅13例出现脑电图恶化,差异有统计学意义(P=0.0117)。而 ε2、ε3携带者出现脑电图恶化与非ε2、ε3携带者比较,差异无统计学意义 (P>0.05)。再应用非条件二分类logistic回归多因素分析性别、年龄、烟酒嗜好、GCS评分、CT 表现、临床处理、受伤机制等因素与 ε2、ε3、ε4 携带者脑电图恶化的相关性,结果显示,ε4与脑电图恶化存在明显的相关性 (P=0.016,OR=4.8,95%CI=1.33~17.29)。这些结果提示,在重型 TBI的急性期,APOEε4也参与了神经电生理的负向调节作用。Lehtovirta等[21]首先在阿尔采默病(AD)患者中观察到 APOE基因多态性对脑电图的影响。研究发现,在AD患者脑电图普遍慢化的基础上,APOEε4携带者的脑电图波形明显更慢。随后的系列研究均提示,在 AD患者的早期和进展期,APOEε4携带者脑电图参数与非APOEε4携带者比较都存在明显差异[22-24]。这些研究提示,APOEε4在AD患者的早期和进展期都参与了神经电生理方面的负向调节作用。我们先前的研究发现,APOEε4也参与了轻-中型TBI急性期脑电活动的负向调节作用[9]。本研究结果提示,apoEε4也参与了重型TBI急性期脑电活动的负向调节作用。AD是慢性病,TBI是急性病,apoE都参与了二者的病理生理过程,其确切机制还有待进一步研究。但已经发现,AD和TBI有一个共同的病理改变,即脑内β-淀粉状蛋白(Aβ)沉积,而APOEε4促进了这一共同的病理改变[25,26]。这可能就是 AD 和 TBI患者APOEε4携带者脑电图改变有相似之处的原因。
3.3 APOEε4影响重型TBI后脑电图的作用机制
脑电图来源于大脑皮质层锥体细胞及其顶树突突触后电位的综合波,突触后电位在神经细胞物质代谢过程中产生,因此,脑电图波的周期和节律将受神经细胞物质代谢速度的影响。在重型TBI的急性期,APOEε4影响脑电图的可能机制有:(1)与AD的发病学相似,促进Aβ沉积[26],可以发生在重型TBI后的数小时之内,伤后5d左右达高峰[27],可能损害胆碱能神经;(2)促进重型TBI急性期(<5d)兴奋性天冬氨酸神经递质释放和提高乳酸丙酮酸比率[28],从而出现神经细胞电生理的差异;(3)增加重型TBI急性期伤侧大脑半球的血流量,并在伤后24 h内开始出现脑血流量的增加,使相应供血区域神经细胞的代谢也具有 APOE亚型特异性[29];(4)参与促进重型TBI急性期脑特异性蛋白(S-100B)和神经元特异性烯醇化酶(NSE)的释放[30],高浓度的S-100B具有神经毒性作用。这些机制所引起的代谢或神经毒性作用都可直接或间接引起神经细胞突触后电位的变化,从而使脑电图改变也具有APOE基因亚型特异性。
本研究正在进一步扩大样本量,用数字化信息技术定量分析脑电活动与APOE基因表达剂量依赖关系,并跟踪调查患者中后期的脑电图改变及预后,更深入研究APOE基因多态性与重型TBI后脑电图变化的关系,从而通过应用无创伤的脑电图监测进行早期预测APOEε4在重型TBI中的特异性损害,指导临床早期个性化治疗APOEε4对重型TBI患者的特异性损害,进一步改善重型TBI的预后。
[1]Weaver SM,Chau A,Portelli JN,et al.Genetic polymorphisms influence recovery from traumatic brain injury[J].Neuroscientist,2012,18(6):631-644.
[2]Sun XC,Jiang Y.Genetic susceptibility to traumatic brain injury and apolipoprotein E gene[J].Chin J Traumatol,2008,11(4):247-252.
[3]Smith C,Graham DI,Murray LS,et al.Association of APOE e4 and cerebrovascular pathology in traumatic brain injury[J].J Neurol Neurosurg Psychiatry,2006,77(3):363-366.
[4]Friedman G,Froom P,Sazbon L,et al.Apolipoprotein E-epsilon4 genotype predicts a poor outcome in survivors of traumatic brain injury[J].Neurology,1999,52(2):244-248.
[5]江涌,孙晓川,夏玉先,等.载脂蛋白E基因型及启动子区多态性与颅脑损伤病情发展的相关性研究[J].中国神经精神疾病杂志,2006,32(5):431-435.
[6]江涌,孙晓川,夏玉先,等.载脂蛋白E基因多态性与颅脑损伤的相关性[J].中华创伤杂志,2005,21(7):520-523.
[7]Jiang Y,Sun X,Gui L,et al.Correlation between APOE-491AA promoter in epsilon4 carriers and clinical deterioration in early stage of traumatic brain injury[J].J Neurotrauma,2007,24(12):1802-1810.
[8]Jiang Yong,Sun Xiaochuan,Xia Yuxian,et al.Effect of APOE polymorphisms on early responses to traumatic brain injury[J].Neuroscience Letters,2006,408(2):155-158.
[9]贺绪智,孙晓川,但炜,等.载脂蛋白E基因多态性与轻-中型颅脑损伤急性期脑电图改变的相关性[J].中华创伤杂志,2008,4(8):619-623.
[10]Hockaday JM.EEG changes in acute cerebral anoxia from cardiac or respiratory arest[J].Electnoenceph Neurophysiol,1965,18(6):5751.
[11]Alexander S,Kerr ME,Kim Y,et al.Apolipoprotein E4 allele presence and functional outcome after severe traumatic brain injury[J].Neurotrauma,2007,24(5):790-797.
[12]Weisgraber KH,Rail SC,Mahley RW.Human E apoprotein hererogeneity:cysteine—arginine interchanges in the amino acid sequence of the apoE isoforms[J].Biol Chem,1981,256(17):9077-9083.
[13]Han X.The role of apolipoprotein E in lipid metabolism in the central nervous system[J].Cell Mol Life Sci,2004,61(15):1896-1906.
[14]Mauch DH,Nagler K,Schumacher S,et al.CNS synaptogenesis promoted by glia-derived cholesterol[J].Science,2001,294(5545):1354-1357.
[15]Han X,Cheng H,Fryer JD,et al.Novel role for apolipoprotein E in the central nervous system.Modulation of sulfatide content[J].Biol Chem,2003,278(10):8043-8051.
[16]Ariza M,Pueyo R,Matarín Mdel M,et al.Influence of APOE polymorphism on cognitive and behavioural outcome in moderate and severe traumatic brain injury[J].Neurol Neurosurg Psychiatry,2006,77(10):1191-1193.
[17]Miller MA,Conley Y,Scanlon JM,et al.APOE genetic associations with seizure development after severe traumatic brain injury[J].Brain Injury,2010,24(12):1468-1477.
[18]Olivecrona M,Wildemyr Z,Koskinen LO.The apolipoprotein E epsilon4 allele and outcome in severe traumatic brain injury treated by an intracranial pressure-targeted therapy[J].J Neurosurg,2010,112:1113-1119.
[19]Pruthi N,Chandramouli BA,Kuttappa TB,et al.Apolipoprotein E polymorphism and outcome after mild to moderate traumatic brain injury:a study of patient population in India[J].Neurol India,2010,58(2):264-269.
[20]Jiang Y,Sun XC,Gui L,et al.Lack of association between apolipoprotein E promoters in 84 carriers and worsening on computed tomography in early stage of traumatic brain injury[J].Aeta Neurochir Suppl,2008,(105):233-236.
[21]Lehtovirta M,Partanen J,Kononen M,et al.Spectral analysis of EEG in Alzheimer's disease:relation to apolipoprotein E polymorphism[J].Neurobiol Aging,1996,17(4):523-526.
[22]Lehtovirta M,Partanen J,Könönen M,et al.A longitudinal quantitative EEG study of Alzheimer's disease:relation to apolipoprotein E polymorphism[J].Dement Geriatr Cogn Disord,2000,11(1):29-35.
[23]Canuet L,Tellado I,Couceiro V,et al.Resting-state network disruption and APOE genotype in Alzheimer's disease:a lagged functional connectivity study[J].PLoS One,2012,7(9):e 46289.
[24]Babiloni C,Benussi L,Binetti G,et al.Apolipoprotein E and alpha brain rhythms in mild cognitive impairment:a multicentric electroencephalogram study[J].Ann Neurol,2006,59(2):323-334.
[25]Horsburgh K,McCarron MO,White F,et al.The role of apolipoprotein E in Alzheimer's disease,acute brain injury and cerebrovascular disease:evidence of common mechanisms and utility of animal models[J].Neurobiol Aging,2000,21(2):245-255.
[26]DeKosky ST,Abrahamson EE,Ciallella JR,et al.Association of increased cortical soluble abeta42 levels with diffuse plaques after severe brain injury in humans[J].Arch Neurol,2007,64(4):541-544.
[27]Marklund N,Farrokhnia N,Hånell A,et al.Monitoring of β-amyloid dynamics after human traumatic brain injury[J].J Neurotrauma,2013 Jul 7.[Epub ahead of print]
[28]Kerr ME,Ilyas Kamboh M,Yookyung K,et al.Relationship between apoE4 allele and excitatory amino acid levels after traumatic brain injury[J].Crit Care Med,2003,31(9):2371-2379.
[29]Kerr ME,Kamboh MI,Kong Y,et al.Apolipoprotein E genotype and CBF in traumatic brain injured patients[J].Adv Exp Med Biol,2006,(578):291-296.
[30]Olivecrona Z,Koskinen LO.The release of S-100B and NSE in severe traumatic head injury is associated with APOE ε4[J].Acta Neurochir(Wien),2012 ,154(4):675-680.
