一种基于光纤倏逝波生物传感器检测单核细胞增生李斯特氏菌方法的建立
2014-06-13刘金华孟日增聂丹丹王玮琳王浩天
刘金华,刘 韬,孟日增,聂丹丹,王玮琳,王浩天
(1.吉林出入境检验检疫局,吉林 长春130062;2.吉林大学药学院,吉林 长春130021)
单核细胞增生李斯特氏菌(Listeria monocytogens,LM)是一种重要的食源性致病菌,他能引起人类和动物李斯特氏菌病。人和动物感染LM可引起单核细胞增多症、脑膜炎、败血症和流产,严重威胁人类健康和社会经济的发展[1,2]。该菌可通过眼睛及破损皮肤、粘膜进入体内而造成感染,该菌在4℃的环境中仍可生长繁殖,也是冷藏食品中威胁人类健康的主要病原菌之一,因此,在卫生微生物检验中是一种重要的检测目标[3]。目前LM常用的检测方法一般以生化培养鉴定、血清学检测等为主[4]。光纤生物传感器是激光技术和现代低消耗的光纤技术共同发展的产物,是目前应用较为广泛的生物传感器之一[5,6]。本研究基于光纤倏逝波生物传感器技术建立一种快速、高效检测单核细胞增生李斯特氏菌的方法,该方法为LM的卫生检验提供一种新的技术手段。
1 材料与方法
1.1 实验菌株
产气荚膜梭菌(Clostridium perfringens,ATCC13124)、绵羊李斯特氏菌(listeria ivanovii,ATCC19119)、英诺克李斯特氏菌(listeria innocua,ATCC19119)、金 黄 色 葡 萄 球 菌 (Staphylococcus aureus,ATCC25923)、肠炎沙门氏菌(salmonella enteritidis,ATCC13076)、鼠伤寒沙门氏菌(Salmonella typhimurium,ATCC13311)、大 肠 埃 希 菌(Escherichia coli,ATCC25922)、蜡 样 芽 胞 杆 菌(Bacillus cereus,ATCC11778))、单核细胞增生李斯 特 氏 菌 (Listeria monocytogens,LM,ATCC19111)、空肠弯曲杆菌(Campylobacter jejuni,ATCC33291)等均为本实验室保存菌种。
1.2 主要仪器与试剂
光纤生物传感器,聚苯乙烯光纤均由中国科学院长春光学精密机械研究所提供。LM多克隆抗体、LM单克隆抗体、纳米量子点CdFe标记的抗LM的多克隆抗体均由本实验室制备,磷酸盐缓冲液PBS购自北京索莱宝科技有限公司,牛津琼脂OXA、胰酪胨大豆酵母浸膏肉汤(TSB-YE)等LM培养基均购自北京兰伯瑞技术有限责任公司,1-乙基-3-(3-二甲氨基丙基)碳二亚胺盐 (EDC)购于北京晶美有限公司。
1.3 CdTe量子点与LM多克隆抗体的偶联
取1ml的水溶性CdTe量子点与1ml PBS(pH=7.4)缓冲液混合,将400μl的LM多克隆抗体(1mg/ml)加入到上述混合液中,然后将100μl新制备的EDC溶液(4mg/ml)加入到混合液中,样品在37℃培养箱中避光反应2个小时,然后4℃过夜。将2.5ml反应混合液(包含1.0ml量子点,1.0ml PBS,400μl抗体,100μl EDC)5 000r/min离心2min,取上清液,上清用截留分子量为100000的超滤膜反复进行超滤,去除小分子物质和未反应的CdTe量子点,收集超滤膜截留的CdTe-抗体偶联物,然后用PBS(pH7.4)溶解,4℃避光保存备用。
1.4 光纤的包被
按Sai V V等人方法[7],对光纤进行LM抗体包被,将光纤表面先用清洗液(浓HCl:乙醇体积比为1∶1)清洗10min,再用浓硫酸清洗10min,接下来在超纯水中煮沸10min,使光纤表面具有亲水的极化层。然后将处理好的光纤放入15μg/ml LM单抗的溶液中浸泡2h,取出用去离子水洗净,即制成用于检测单核细胞增生李斯特氏菌光纤探针。
1.5 检测灵敏度的确定
将LM菌株在TSB-YE液体培养基中42℃培养18h-24h。琼脂平板进行计数。将包被LM的单克隆抗体的光纤分别插入浓度为3×100CFU/ml、3×101CFU/ml、3×102CFU/ml、3×103CFU/ml、3×104CFU/ml、3×105CFU/ml和3×106CFU/ml的LM菌溶液中孵育10min,加阴性对照,PBS清洗3遍后再与100μg/ml标记量子点的多抗反应10min,用去离子水洗净上机测量结果。
1.6 特异性试验
用建立的方法对上述产气荚膜梭菌、绵羊李斯特氏菌、英诺克李斯特氏菌、金黄色葡萄球菌、肠炎沙门氏菌、伤寒沙门氏菌、大肠埃希菌、蜡样芽胞杆菌、单核细胞增生李斯特氏菌、空肠弯曲杆菌进行特异性交叉试验,同时设空白对照。
1.7 人工添加样品的检测
取鸡肉25g加入225ml的TSB-YE液体培养基中,分别加入单核细胞增生李斯特菌悬液,使其浓度分别达到5CFU/ml,10CFU/ml,20CFU/ml,30CFU/ml,40CFU/ml,50CFU/ml。均质后取2 ml上清,煮沸灭菌,各取1ml用于检测。每组试验重复3次。
2 结果与讨论
2.1 灵敏度实验结果
将纯培养的菌液用PBS缓冲液稀释成3×100-3×106CFU/ml的浓度梯度,当LM菌体浓度为3×101-3×106CFU/ml时,可检测到明显的阳性信号;当菌液浓度小于3×101CFU/ml时结果为阴性。故该方法对LM检测的灵敏度可达到3×101CFU/ml,见图1。
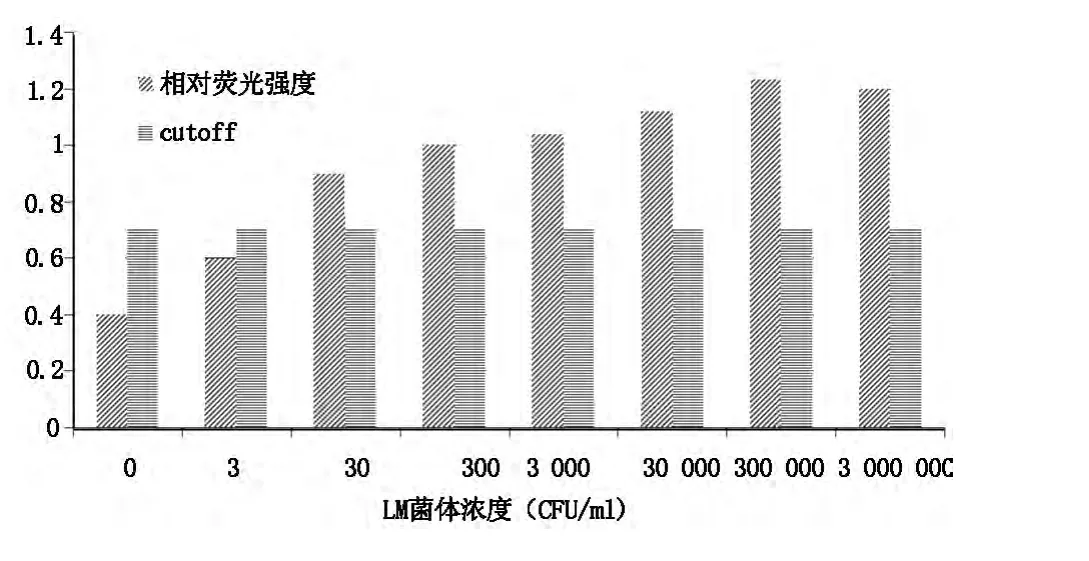
图1 单核细胞增生李斯特氏菌灵敏度的检验
2.2 特异性实验结果
用建立的光纤倐逝波生物传感器分别对105CFU/ml不同菌株的菌液检测,显示该方法对于单核细胞增生李斯特氏菌具有较好的特异性,可以得到较明显信号。其他菌株的检测结果均为阴性,结果见图2。
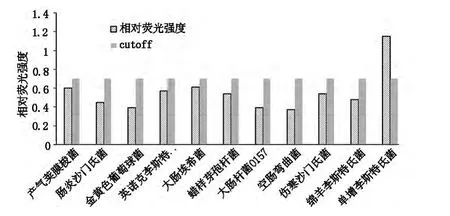
图2 单核细胞增生李斯特氏菌特异性的检验
2.3 人工添加样品的检测
将标准LM稀释到一定浓度加入鸡肉中,检测结果如表1所示,其检测灵敏度可达到30CFU/ml,即在样品中若含有30CFU/ml的在单核细胞增生李斯特氏菌即可被检出,而对于20CFU/mL的浓度的样品3次检测中可能有1-2次结果为阳性。
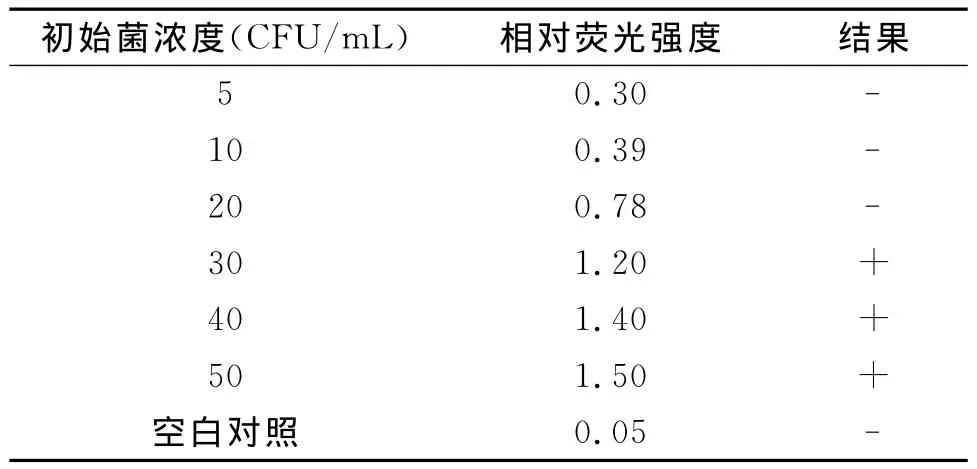
表1 人工感染样品检测结果
3 讨论
光纤倏逝波生物传感器是以光纤和光电转换器件为主要转换元件的一种光电转换设备[8],他主要是利用倏逝波场来激发光纤表面标记在生物分子上的荧光染料,从而检测通过特异性反应附着于纤芯表面倏逝波场范围内的生物分子[9,10]。由于倏逝波是光在光纤中以全反射传播时产生的部分穿透界面的光波,他只存在于界面附近薄层内,只对来自光纤界面附近极薄的一层荧光分子进行荧光激发和收集,而样品中游离的荧光分子则几乎不会被激发和收集,这样便省去了传统生化检测方法中繁冗复杂的清洗步骤,简化了操作步骤,将检测时间从常规分析的几个小时缩短到十几分钟,大大缩短了检测时间提高了检测效率[11,12]。
当光纤倏逝波生物传感器检测目标菌时,光纤表面固定的生物识别分子抗体与目标菌发生特异性反应,进而与荧光染料标记的检测抗体结合,使荧光染料固定于光纤表面,倏逝波激发出荧光,其中部分荧光进入光纤,通过信号转换器将光信号转换为物理信号,之后经过放大处理,获得数据。通过检测是否激发出荧光信号及荧光信号的强度大小来分析待测物的有无及含量。与其他生物检测手段相比,光纤生物传感器具有如下优点:首先该方法不受光纤表面倏逝波场以外的生物分子的干扰具有较高的检测灵敏度;其次该技术操作简单,测量用时较短可应用于现场检测[9]。在本研究试验中,用纳米量子点做荧光标记物,相对于传统的有机荧光染料来说,纳米量子点具有更高的灵敏性和稳定性。使用纳米量子点代替传统的荧光染料检测病原微生物,能够获得了更强的荧光强度,更长的发光时间以及能够对荧光信号更精确的检出,从而使得大大的提高了检测的灵敏度。本实验中,完成一次检测过程只需30 min,而且该检测方法具有较高的灵敏度和较好的特异性,使得该技术具有较好的应用前景。
[1]段 霞.单核细胞增生李斯特氏菌胶体金免疫层析方法的建立[D].南昌大学,2011.
[2]梁雄燕,顾玉芳,杨玉莹,等.鸡单核细胞增生性李斯特菌病诊断与病原鉴定[J].中国家禽,2014,36(1):59.
[3]赵 静,孙海娟,冯叙桥,等.食品中食源性致病菌污染状况及其监测技术研究进展[J].食品安全质量检测学报,2013,4(5):1353.
[4]罗雁非,贾芙蓉,丁 旭,等.胶体金标记单克隆抗体测定单增李斯特菌试剂盒制备[J]。中国实验诊断学,2009,17(12):1231.
[5]毕卫红,郭 璇,王凌霄.免标记光纤生物传感器的研究进展[J].燕山大学学报,2013,37(3):189.
[6]李 博,郑 磊,王 前,等.电化学DNA生物传感器设计及在医学检验中的应用进展[J].分子诊断与治疗杂志,2011,3(1):46.
[7]Rabbany SY,Donner BL,Ligler FS.Optical immunosensors[J].Crit Rev Biomed Eng,1994,22(6):307.
[8]Anderson GP,Rowe-Taitt CA,Ligler FS.Raptor:A Portable,Automated Biosensor[C].Proceedings of the First Joint Conference on Point Detection for Chemical and Biological Defense,Williamsburg,Virginia,23-27October,2000:138-144.
[9]Carolina Beres,Fabio Vieira,Batistade Nazare,et al.Tapered plastic optic fiber-based biosensor-Tests and application[J].Biosensors and Bioelectronics,2011,30(1):328.
[10]单 聪,陈西平.光纤倏逝波生物传感器在微生物检测中的应用[J].卫生研究,2010,39(2):254.
[11]黄惠杰,翟俊辉,赵永凯,等.多探头光纤倏逝波生物传感器及其性能研究[J].中国激光,2004,31(6):718.
[12]徐锁生,魏 华.光纤倏逝波生物传感器及其研究进展[J].生物技术通讯,2008,19(1):148.
