MR氢质子波谱在多发性硬化中的初步研究*
2014-06-12袁蕾蕾
袁蕾蕾
(泰山医学院附属泰山医院放射科,山东 泰安市 271000)
多发性硬化(multiple sclerosis, MS )是中枢神经系统最常见的慢性进行性脱髓鞘疾病,发病年龄常始于中青年人,病理学的改变以中枢神经系统内多处白质的炎症脱髓鞘和胶质瘢痕(硬化斑块)为特征,因此是一种空间上多发的疾病同时也是中青年非外伤性致残的原因之一[1]。本研究旨在运用1H-MRS对多发性硬化患者颅脑内几个重要代谢物的的改变与健康对照组进行比较,讨论其与脑内对应部位的病理改变是否一致,从而探索1H-MRS在多发性硬化中的应用价值。
1 材料与方法
1.1 研究对象
收集2010年3月至2013年12月具有完整临床资料并经我院神经内科三位专家根据McDonald标准一致诊断为多发性硬化的患者28例,其中合并脊髓损害者5例,合并小脑损害者1例,男13例,女15例,年龄18~62岁,平均年龄(31.5±11.6)岁,以30~45岁左右多见,本组为18例。病程2~140个月,平均为(48.6±44.3 )个月。同期对25例无任何中枢神经系统疾病病史、症状和体征的正常志愿者作为对照组,其中男10例,女15例,年龄18~65岁,平均年龄(35.5±10.7)岁,行常规MRI扫描均未见异常。完整临床资料包括入院常规、脑脊液检查、诱发电位刺激、扩展残疾状态量表(EDSS )评价以及用药情况。
为探讨多发性硬化(MS )中病灶及其周围NAWM的代谢物及NAA/Cr, Cho/Cr比值的改变,本研究作以下分组:A组:强化斑块(活动性斑块)[1]即T1WI表现为等低信号T2WI呈高信号而FLAIR呈高信号且有强化表现者,包括急性斑块和慢性活动性斑块;B组:无强化斑块(慢性静止性斑块)[2]即T1WI表现为等低信号T2WI呈高信号而FLAIR呈高信号但无强化表现者;C组:斑块(包括强化者与非强化者)周围表现正常的脑白质(NAWM);D组:正常健康对照组。
1.2 MRI及1H-MRS检查方法
全部病例均采用Siemens公司Magnetom Avanto 1.5T MRI超导型全身MRI扫描机,头部八通道相控阵线圈,首先行颅脑MRI平扫,大部分病例平扫后注入Gd-DTPA行增强扫描,并取得颅脑轴位、矢状位、冠状位三方位图像作为定位识别图像,利用点分辨波谱序列(PRESS)获取二维多体素波谱图像(2D-CSI ) 。
1.2.1平扫常规行轴位、矢状位扫描,扫描序列包括:
(1)自旋回波序列(spin echo SE ) T1加权像(Tl WI ):重复时间(TR) =500 ms,回波时间(TE ) = 7.7 ms,层厚=5 mm,层间距=1.5 mm,视野(FOV ) =200 mm×230 mm,矩阵=336×512,带宽(BW ) =130 Hz,扫描时间(TA ) =2∶23。
(2)快速自旋回波(turbo spin echo,,TSE)序列 T2加权像(T2WI) :TR=4000 ms,TE=95 ms,层厚=5 mm,层间距=1.5 mm,,视野=200 mm×230 mm,,矩阵=344 ×512,带宽=100Hz,TA=1∶20。
(3)液体衰减翻转恢复序列(FLAIR ) TR=9000 ms,TE=108 ms,TI=2500 ms, 层厚=5 mm,层间距=1.5 mm,视野=200 mm ×230 mm,矩阵=344×512,,带宽=130 Hz,TA=2∶28。
(4)增强扫描 增强扫描对比剂选用通用药业公司生产的钆双胺,采用经手背静脉注射,注射速率约1.0 ml/s,剂量0.1 mmol/kg。均行横断位、矢状位、冠状位三个断面T2WI(扫描参数同平扫T2 WI)和T1 WI扫描。
1.3 H-MRS检查方法
采用PRESS序列进行MRS扫描,以横断位、矢状位、冠状位T2WI图像作为MRS的定位图像,获取二维多体素波谱图像(2D-CSI)。TR=1500 ms,TE=135 ms,感兴趣体积(VOI )范围为80 mm×80 mm×10 mm,其中层厚为10 mm,每一体素大小为10 mm×10 mm×10 mm,病灶较小者选择8 mm×8 mm×10 mm,以尽量使病灶充满一个体素为原则,务求所得数据精确。同时采用化学位移饱和法进行水抑制。
1.4 数据分析和统计
采用Siemens Syngo MR2002B数据分析软件对波谱的几个重要代谢物(NAA,Cho, Cr, Lac)进行后处理,分别获得相关代谢物比率即NAA/Cr, Cho/Cr。使用统计软件SPSS12.0进行统计学处理,上述数据均进行正态性分布检验,符合正态分布情况下做统计学差异检验,不符合者则先行变量变换符合正态分布后再采用独立样本t检验,检验标准以P<0.05为有统计学意义。比较内容如下:第一组:强化病灶(A组)与未强化病灶(B组)病灶;第二组:强化病灶(A组)与病灶周围NAWM组(C组)第三组:未强化病灶(B组)与病灶周围NAWM (C组);第四组:未强化病灶(B组)与健康对照组(D组):第五组:病灶周围NAWM (C组)与健康对照组(D组)。
2 结 果
各组的NAA/Cr, Cho/Cr比值及各组间比较如下。第一组:强化病灶(A组)的NAA/Cr值为1.49±0.49,无强化病灶(B组)的NAA/Cr值为1.77±0.28.二者相比差异无统计学意义(P>0.05 ),而Cho/Cr值分别为2.49±0.76和1.49±0.36,二者相比差异有统计学意义(P<0.05 ) 。(表1)
第二组:强化病灶(A组)的NAA/Cr值为1.49±0.49,NAWM(C组)的NAA/Cr值为1.90±0.26,二者相比差异有统计学意义(P<0.05 ),而Cho/Cr值分别为2.49±0.76和1.37±0.29二者相比差异有统计学意义(P<0.05 )。 (表2)
第三组:无强化病灶(B组)的NAA/Cr值为1.77±0.28,NAWM(C组)NAA/Cr值为1.90±0.26,二者相比差异有统计学意义(P<0.05 ),而Cho/Cr值分别为1.49±0.36和1.37±0.29,二者相比差异无统计学意义(P>0.05 )。(表3)
第四组:无强化病灶(B组)的NAA/Cr值为1.77±0.28,健康对照组(D组)的NAA/Cr值为2.01±0.19,二者相比差异有统计学意义(P<0.05 ),而Cho/Cr值分别为1.49±0.36和1.21±0.36,二者相比差异有统计学意义(P<0.05 )。(表4)
第五组:NAWM (C组)的NAA/Cr值为1.90±0.26,健康对照组(D组)的NAA/Cr值为2.01±0.19,二者相比差异有统计学意义(P<0.05 ),而Cho/Cr值分别为1.37±0.29和1.21±0.36,二者相比差异有统计学意义(P<0.05 ) 。(表5)
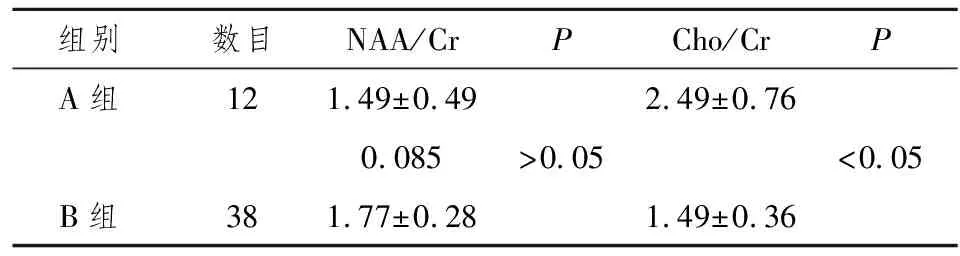
表1 强化病灶(A)与无强化病灶(B) NAA/Cr 、Cho/Cr比值比较

表2 强化病灶(A)与病变周围NAWM(C)NAA/Cr 、Cho/Cr比值比较

表3 无强化病灶(B)与病变周围NAWM(C)NAA/Cr 、Cho/Cr比值比较

表4 无强化病灶(B)与健康对照组(D)NAA/Cr 、Cho/Cr比值比较

表5 NAWM(C)与健康对照组(D)NAA/Cr 、Cho/Cr比值比较
3 讨 论
本研究利用 H-MRS技术对多发性硬化的病变及周围NAWM区进行了常见代谢物的检测。利用代谢物的比值的改变提供了多发性硬化的一些特征性病理改变的信息。NAA的变化提示多发性硬化并非传统观念的单纯的脱髓鞘病变,NAA的减少特异性的反映了MS轴索的损伤及神经元的功能异常,而NAA的持续减低提示轴索的丢失或损伤是不断进行的[3],无论病灶处于活动期还是静止期,但是两者的病理改变有所不同。
多发性硬化主要病理特征是中枢神经系统炎症性细胞在血管周围的浸润,相对小的病灶融合成多发性硬化的脱髓鞘斑块,主要位于脑室旁和视神经,也就是接近脑脊液的部位。免疫组化证实多发性硬化病灶的早期炎症病灶以T细胞为主,而晚期主要为B细胞。有研究证实常规MRI发现的病灶周围强化的患者比没有强化的患者脑脊液细胞穿孔素的mRNA表达增加,提示与血脑屏障破坏有关。
胆碱复合物(Cho )增高反映了髓鞘的崩解、含有胆碱的膜磷脂的释放和膜翻转增多。在活动性斑块中,与慢性静止性斑块相比Cho的明显升高,提示其与急性炎症有密切的关系。以上提到病灶周围强化的MS患者脑脊液穿孔素增加,穿孔素作为细胞毒性T细胞的作用之一就是可以直接破坏少突胶质细胞和内皮细胞,在NO和氧自由基的协同下,穿孔素造成上述组织破坏[4]。
病灶周围NAWM中,NAA/Cr比值较正常对照组减少,而Cho/Cr比值升高,提示常规MRI未显示病灶的白质中可能存在微观病理改变包括弥漫性星形细胞的过度增生、小斑片状的水肿、血管周围间隙的浸润、异常变薄的髓磷脂和轴突的丢失。因此颅脑多发性硬化是一种脑内广泛脱髓鞘及伴有复杂性炎症反映的疾病。部分学者[5]认为组织成分的改变可能比增强扫描最早观察到的结果提前1周。因此1H-MRS对脑内代谢物的敏感性使得它可能在病灶未显示之前就能监测到异常,这对于多发性硬化的早期诊断具有绝对优势。
MS的最常见临床类型是复发一缓解型(RR )是以多组神经功能障碍的加重与缓解为特征。继发进展型(PS)是功能障碍持续数年且进行性加重[6]。Miki Y等[7]通过研究常规MRI上正常白质的波谱图像,可以鉴别多发性硬化的RR型和PS型。在这两种类型的患者中,常规MRI表现正常的白质均可显示NAA/Cr比率降低。但是,与RR型患者和对照组相比,在PS型患者中比率降低更为显著。因此,对常规MRI上表现正常的白质进行波谱分析可以鉴别MS的PS型和RR型。从而可对继发进展型MS进行早期的干预治疗,防止和延缓神经元病变和轴索丢失所致的永久性神经功能丧失。常规MRI上表现正常的白质中所见的波谱异常表现与轴索损伤、功能障碍的程度以及病变的进展相关[8]。
一些学者[9]认为1H -MR可能将急性孤立的MS斑块与肿瘤鉴别。在这两类疾病中,均可见Cho, Lip, Lac的升高,但是显著NAA的降低更支持肿瘤的诊断。其他学者注意到急性斑块中,也可有NAA水平的明显降低。
有研究证实应用扩散和灌注等多种功能手段可进一步提高诊断的特异性[10]如急性斑块典型表现为扩散受限,导致高信号,肿瘤常非如此;MS斑块不显示高灌注,但肿瘤可有高灌注。Cha等[11]应用T2*平面回波成像(EPI)灌注技术研究了1000余例肿瘤和14例MS斑块,在50%的斑块中发现垂直脑室表面的一些线样低信号结构提示为小静脉。统计在大于1.5 mm的斑块,均显示有这些异常的线样结构。肿瘤病灶内未显示异常线样结构。因此,MRS结合MR灌注有助于急性孤立MS的斑块与肿瘤的鉴别。另外,1H-MRS还可用于病程的随访和监测治疗反应并通过NAA的监测可对MS的致残程度进行评估,并预测预后情况。本研究中有2例处于急性期的患者,均在治疗后4个月复查1H-MRS,可监测到Cho较前明显降低,而NAA变化不大。由于样本过少,因此未作各比值的统计学分析。但这提示1H-MRS可能可以作为临床治疗情况监测的有力手段。随着1H-MRS技术的提高和多发性硬化的研究深入,这将成为一项热点课题。
对于多发性硬化的诊断和病灶的检测,MRI依然是最敏感的检查。尽管1H-MRS还有很多的不足,但对于多发性硬化来说,它利用代谢物的峰值提供了多发性硬化的病灶内及病灶周围表现正常的脑白质一些特征性病理改变的信息,并能与病理改变很的联系起来,有助于我们对多发性硬化的脱髓鞘和非脱髓鞘病理改变的认识。还可以从一定程度上帮助我们鉴别复发一缓解型和继发进展型。1H-MRS结合MR灌注将有助于急性孤立MS斑块与肿瘤的鉴别。1H-MRS还可用于病程的随访和监测治疗反应。随着1H-MRS技术的提高和多发性硬化的研究深入,相信1H-MRS对于多发性硬化的应用空间将会越来越广阔。
[1] Ferguson B, Matyszak MK, Esiri MM, et al.Axonal damage in acute multiple sclerosis[J].Brain, 1997, 20:389-399.
[2] 魏岗之.神经系统脱髓鞘性病变[M].北京:中国中医药出版社,2003:50-77.
[3] Lara A, Roomer C.MR Spectroscopy of the Brain[M].Brazil, 2003: 10-11.
[4] Danielson ER, Ross B.Magnetic resonance spectroscopy diagnosis of neurological diseases[M].New York: Maral Dekker, 1999:5-22.
[5] Tartaglia MC, Narayanan S, De-Stefano N, et al.Choline is increased in pre-lessional normal appearing white matter in multiple sclerosis[J].J Neurol, 2002, 249:1382-1390.
[6] Michael D, Phi如s MD.Clinical application: Neurodegenerative Disorders[J].Neuroimage, 2002, 15(3): 537-546.
[7] Miki Y,Grossman R, Udipa J, et al.Differences between relapsing-remitting and chronic progressive multiple sclerosis as determined with quantitative MR imaging[J].Radiology, 1999, 210:769-774.
[8] Cha S, Pierce S, Knipp EA, et al.Dynamic contrast enhanced T2-weighted MR imaging of fume factive demyelinating lesions[J].AJNR,2001, 22: 1109-1116.
[9] Law M, Cha S, Knapp EA, et al.Proton MR spectroscopy,Rcbv/perfusion-weighted MR imaging in demyelinating disease[J].Presented at the 39th annual meeting of the American Society of Neuroradiology, Boston, April 2002.
[10] Arnold DL, de Stefano N, Narayanan S, et al.Proton MR spectroscopy in musclerosis in advances in multiple sclerosis[J].Neuroimage Chin North Am, 2000,10:789.
[11] Cha S, Knopp EA, et al.Perivenular demyelination depicted on dynamiccontrast-enhanced T2-weighted MR imaging[J].Presented at the 39th annual meeting cAmerican Society of Neuroradiology, Boston, April 2005.
