氯化铵应用研究进展
2014-06-11孙明帅王富民蔡旺锋张旭斌贾志方
孙明帅,王富民,蔡旺锋,张旭斌,贾志方
(1天津大学化工学院,天津 300072;2天津临港高新技术发展有限公司,天津 临港 300457)
氯化铵是一种重要的化工产品,主要来源于其他化工产品生产过程的副产物,广泛用于化肥、医药、食品、湿法冶金、电池等领域。联碱法生产纯碱、天然卤水生产小苏打和合成氨基酸工艺中的废液中都含有大量的氯化铵[1-2],其中联碱法生产纯碱过程副产的氯化铵占中国氯化铵总量的90%以上。
全球范围内氯化铵的年总消耗量并不高,其生产主要集中在中国。由于天然碱的缺乏,中国纯碱企业多采用联碱法生产纯碱,联碱法生产纯碱工艺每生产1 t纯碱就会副产1 t氯化铵[3]。2012年中国氯化铵总产量达1280万吨,占世界氯化铵总产量的95%,居世界第一。而且随着国家经济的快速发展,产量还在不断增加。2004—2012年中国氯化铵每年的总产量增长趋势如图1所示,可以看出近十年间氯化铵的总产量增长了一倍,而且还在快速增长。
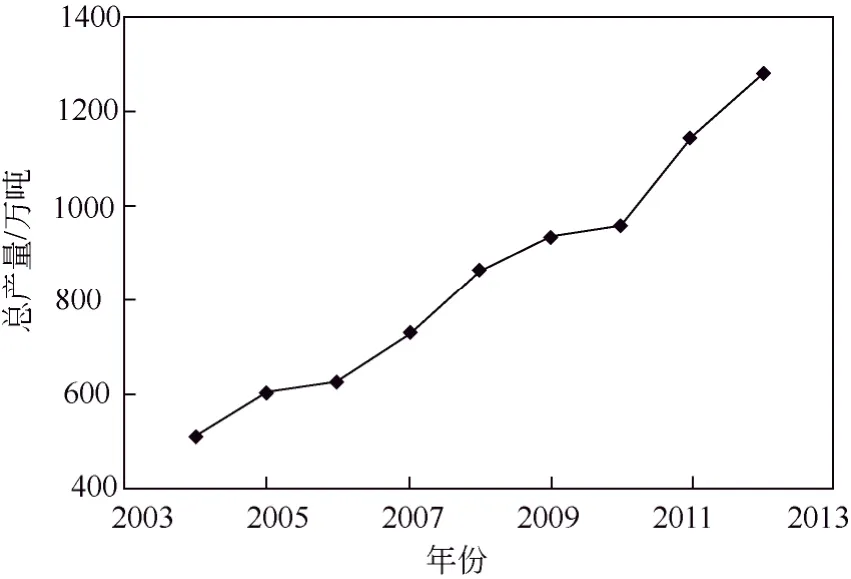
图1 中国氯化铵年总产量变化趋势
在中国,数量如此巨大的氯化铵有95%以上作氮肥使用。氯化铵含氮量为26%,90%左右的农用氯化铵用来生产复合肥[4],但氯化铵做氮肥有很大的局限性。氯化铵产品通常为粉状结晶体,属于难成粒物质,易吸潮结块,流动性差难以实现机械化施肥。氯化铵由于本身的理化性质,采用常规技术很难获得颗粒产品给产品运输和田间使用都带来极大不便[5-6]。氯离子仅是作物必需的一种微量养分,长时间使用会导致土壤中大量氯离子残留,造成土壤酸化和板结问题,于干旱少雨地区及排水不利的盐碱地中施用会加重土壤盐害[7],对于忌氯作物如茶叶、烟草、马铃薯、柑橘等不宜施用[8]。近几年中国尿素产量迅猛增加,氯化铵的市场价格受尿素的影响很大。尿素具有含氮量高、颗粒度好不易结块、易于贮存和运输等优点,作为氮肥具有氯化铵无可比拟的优势,极大地挤压了氯化铵的市场份额和价格空间,大部分氯化铵迟迟找不到出路而大量富余滞销或者廉价出售,成为严重制约纯碱工业经济效益的瓶颈,不利于中国纯碱工业的良态发展,亟待寻找合适的利用方式[9-11]。因此如何实现氯化铵的高附加值成为联碱企业急需解决的问题。
高纯度氯化铵在食品行业和医药生产中有着重要的应用。在食品行业高纯度的氯化铵用于酵母菌的培养和食品中的加工助剂;医药生产中,氯化铵是止咳糖浆和氯化铵甘草合剂的重要成分。生产高纯度氯化铵如试剂氯化铵以及开发食品级、药用氯化铵等能极大提高氯化铵的商业价值,但这几种应用领域对氯化铵的总体需求量很小,很难从整体上根本解决中国数量庞大的氯化铵的出路问题。
氨碱法采用生石灰分解 NH4Cl回收 NH3的工艺,该过程需用大量的生石灰并产生大量氯化钙,能耗高而且浪费大量水资源,大量的氯化钙直接排放进海水中,既造成了氯离子等资源的浪费,又破坏了生态环境[12-14]。
将氯化铵分解制 NH3和 HCl、Cl2或以氯化铵为氯源合成其他化学品成为解决中国氯化铵产能过剩、实现氯化铵高附加值的重要思路,在无机化工特别是有机氯化工领域中具有很大的应用潜力。
1 氯化铵制NH3和HCl工艺
1.1 氯化铵直接热分解反应
NH4Cl加热至100 ℃开始显著挥发,337.8 ℃分解为NH3和 HCl气体,一般认为350 ℃时完全分解。反应方程式如式(1)。
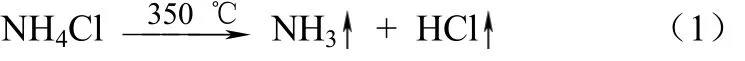
NH4Cl直接加热分解实际上并没有实现HCl和NH3的分离,温度降低时HCl和NH3会重新结合生成NH4Cl固体。实现两种气体的分离,常用的方法是向反应体系加入其他物质如碱性金属氧化物或者酸性物质与其中一种气体发生反应,预先分离出另一种气体。
1.2 氯化铵间接热分解制NH3和HCl工艺
NH4Cl间接分解制NH3和HCl有硫酸氢盐法、镁含氧化合物法、ZnO熔融分解法等。
1.2.1 硫酸氢盐法
硫酸氢盐法制NH3和HCl工艺是在NH4Cl中加入酸性物质 NH4HSO4或 NaHSO4,然后升温至150~280 ℃,最合适的温度范围是200~260 ℃,反应生成HCl气体,反应过程及时用空气、蒸汽或者其他惰性气体将HCl带出,使反应继续进行;在第二步反应中,将混合物温度升高到280 ℃以上,(NH4)2SO4开始分解,生成 NH4HSO4和 NH3,NH4HSO4循环使用。反应方程式如式(2)、式(3)。
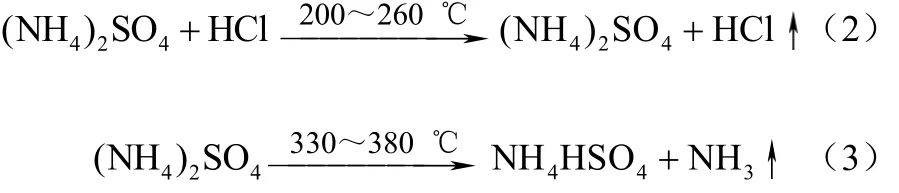
两步反应需严格控制反应温度,不然会在第一、二步反应分别生成NH4Cl固体和NH4HSO4固体,阻碍传热、堵塞管道。此外,还需通入惰性载气将生成的NH3及时带出反应体系,防止管道堵塞和减少热量损失[15]。
如图2所示,NH4HSO4分解氯化铵工艺过程中,以过量NH4HSO4为中间体,与NH4Cl混合后升温放出HCl气体,反应得到的NH4HSO4与(NH4)2SO4的混合物加入醇溶液后结晶分离,分离出的(NH4)2SO4分解制取 NH3和 NH4HSO4,NH4HSO4再与NH4Cl反应制取HCl气体。该工艺过程醇溶剂和NH4HSO4可以循环使用[16]。
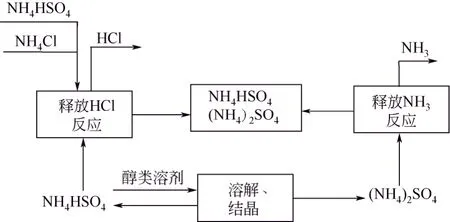
图2 NH4HSO4工艺流程示意图
硫酸氢盐法分解NH4Cl收率不高、反应速率低,对生产设备材质要求高,没有实现工业化生产,只停留在实验室基础研究阶段。
1.2.2 镁含氧化合物法制NH3和HCl工艺
镁含氧化化物法制 HCl和 NH3有 MgO、Mg(OH)2和MgOHCl 3种工艺路线,该分解工艺有2个主反应阶段:蒸氨过程和分解过程。以MgO工艺为例,将 MgO加入氯化铵水溶液中进行蒸氨反应放出NH3,控制反应温度为210~310 ℃;待 NH3完全释放,升温至350 ℃以上,水解放出HCl,最得到Mg(OH)2,再与NH4Cl循环反应[17],反应方程式如下。
(1)蒸氨过程
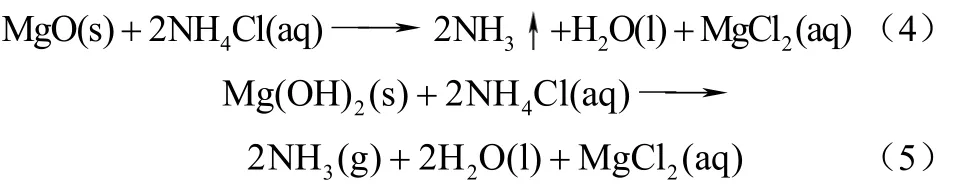
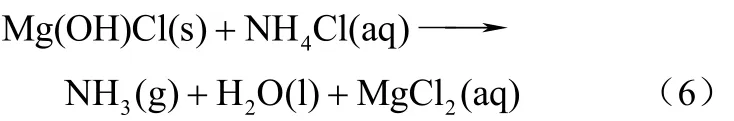
(2)分解过程

以分解1 t氯化铵为基准,对上述3种工艺过程的能耗进行分析,能耗最低的是 MgO工艺,其能耗约为1.03×107kJ/mol;其次是MgOHCl工艺,能耗约为3.82×107kJ/mol;能耗最高的是Mg(OH)2工艺,能耗为4.9×107kJ/mol。MgO工艺具有生产周期短、能耗低等多方面优势,是3种工艺中最具有工业应用价值的工艺路线,但工艺设备投资较大[18]。
1.2.3 ZnO熔融分解制NH3和HCl工艺
利用ZnO的两性性质,在高温下NH4Cl气化分解产生HCl和NH3,与熔融ZnO结合,生成含氯中间产物(NH4)2ZnCl4并释放出NH3[19]。NH3回收后将熔融物在高温条件下(大于307 ℃)水解释放出HCl,从而达到分离NH3和HCl的目的,并能得到 ZnO 循环使用。该工艺的原料配比n(ZnO)/n(NH4Cl)=0.7,分解温度为400 ℃,但转化率不高,恒温分解1 h,NH4Cl转化率不到90%[20]。
1.2.4 NH4Cl与有机胺反应制NH3和HCl工艺
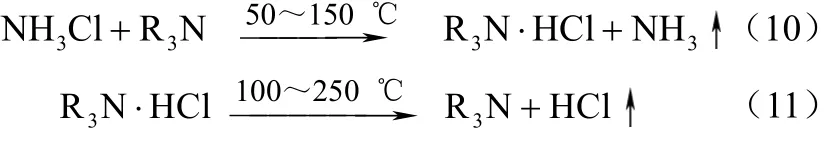
美国的Alfred Coenen,Maria Laach[21]在一篇专利中介绍了 NH4Cl与有机胺反应生制 NH3和 HCl的工艺。该工艺分为4个过程:第1步加热含NH4Cl的混合物放出NH3,混合物有可溶性有机胺的溶液和有机溶剂;第2步将生成的NH3抽出;第3步,进行精馏脱除极性溶剂和水得到胺盐;第4步加热胺盐混合物用惰性气如 N2将 HCl带出用水吸收HCl,也可用乙烯或乙炔与HCl直接混合进行氧氯化或氢氯化反应。该工艺需要精馏除去大量的水和有机溶剂,耗能较大。主要的反应方程式如式(10)、式(11)。
2 氯化铵制Cl2和NH3工艺
1889年,美国的 Ludwig Mond 将 NH4Cl在350 ℃条件下气化后通入 500~550 ℃装有球状MgO颗粒的床层,生成 NH3。在第 1步氯化铵与MgO反应至无NH3放出时,再将800~1000 ℃的干燥热空气通入床层开始第2步的反应,MgCl2被氧化生成MgO和 Cl2,Cl2被气流带出,出口气流Cl2体积分数在8%左右。第2步反应完成后降温至350 ℃左右,再通入气化的氯化铵进行下一轮循环反应[22-23]。反应方程式如式(12)、式(13)。
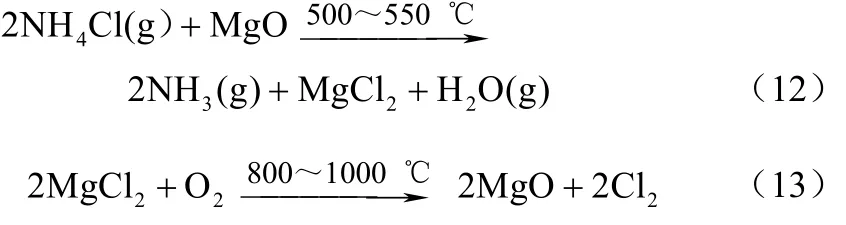
20世纪60年代,Shell Int. Research公司对上述工艺进行了改进,通过通入适量水蒸气同时控制第1阶段的反应深度使其生成MgOHCl,使用负载CuCl2、KCl和氯化稀土的颗粒硅胶的催化剂来加速第 2阶段 MgOHCl的氧化速度[24]。改进后,第 2步反应的温度较原始工艺大幅度降低。反应方程式如式(14)、式(15)。
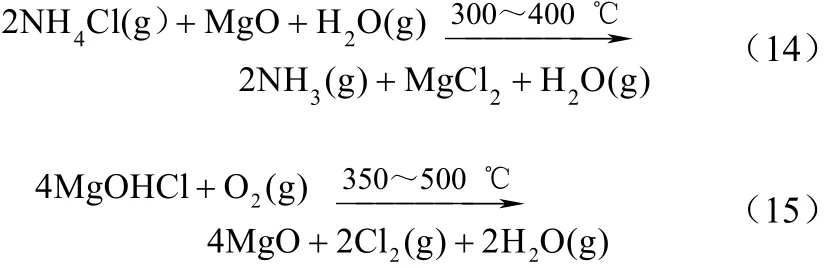
上述2种方法反应条件较苛刻,原始工艺第2步反应温度过高,改进工艺需严格控制反应深度才能顺利地进行循环反应。
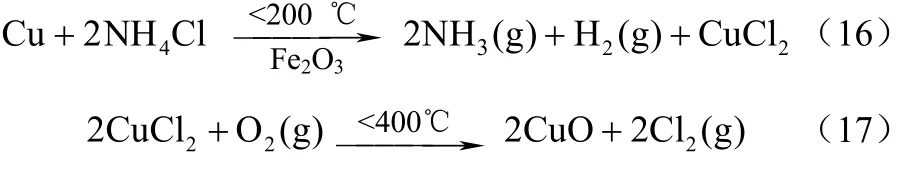
使用Fe2O3、KCl、LiCl等催化剂,氯化铵可与置换剂进行催化置换氧化反应,置换出NH3,再通入氧气将反应剩余物氧化放出氯气,常用的置换剂为Cu、Mn等。以金属Cu为置换剂、Fe2O3为催化剂与NH4Cl反应,生成NH3和Cl2,反应分两步完成,如式(16)、式(17)。
3 氯化铵制氯代烃和NH3工艺
氯化铵可与含有羟基、碳碳双键、碳碳叁键、氨基、巯基及醚类等有机物发生取代反应生成氯代烷烃。早在 1951年,Olin Mathieson 化学公司[25]在其一篇专利中提出在酸性或弱碱性催化剂存在条件下,氯化铵可以与含有活性O的有机物如甲醛、乙醛、乙醇、乙醚、酯或含S、N的类似物反应,生成相应的有机氯化物,反应温度一般在 250~500 ℃。
3.1 NH4Cl与低碳醇反应制氯代烃工艺
在催化剂存在条件下,氯化铵可与低碳醇如甲醇、乙醇发生复分解反应,生成氯代烷烃和NH3。氯化铵可与低碳醇反应制备卤代烷一般有 2种工艺,其流程示意图分别如图3和图4所示。
第1种工艺是将NH4Cl升温分解后与低碳醇蒸气混合通过催化剂床层进行反应,生成氯代烷、水和氨气,后经洗气装置和精馏塔依次分离得到氨水、氯代烷和未反应的低碳醇;第2种工艺是将低碳醇的蒸气通入ZnCl2和NH4Cl的熔液进行反应,得到氯代烷烃与水的混合气,经冷凝分离提纯得到氯代烃产物[26]。
3.1.1 NH4Cl与甲醇反应
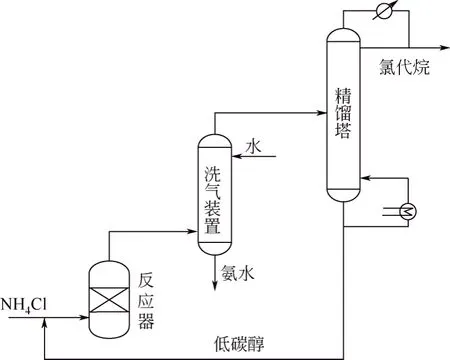
图3 NH4Cl与低碳醇反应的第一类工艺流程示意图
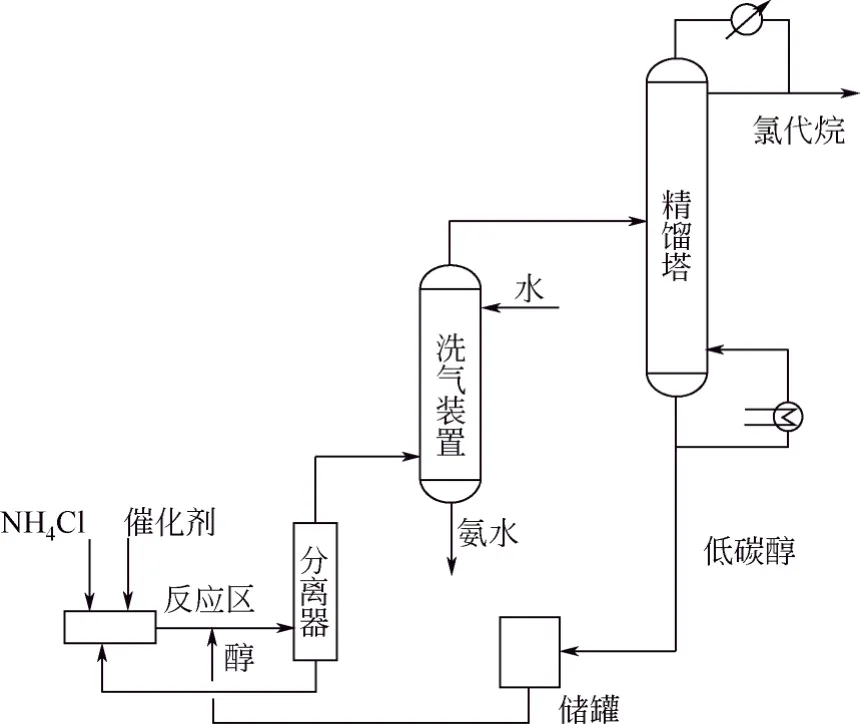
图4 NH4Cl与低碳醇反应的第二类工艺流程示意图
常压下,使用活性 Al2O3、活性炭或以活性炭为载体的碱金属化合物和锌化物等,氯化铵与甲醇进行复分解反应生成氯甲烷,反应温度 280~450 ℃。但该反应存在较多的副反应,除生成CH3Cl外,甲醇还会与NH3反应生成甲胺类物质以及甲醇发生分子间脱水反应生成二甲醚等。
主反应如式(18)、式(19)。
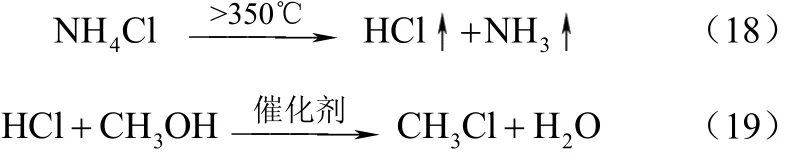
合并上述2个反应即得式(20)。
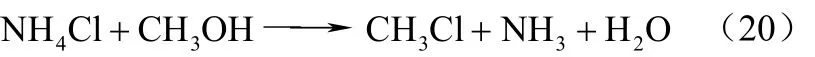
副反应为式(21)、式(22)。
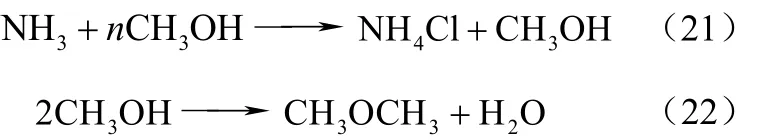
日本三菱化学公司开发了用于甲醇和氯化铵反应的固定床工艺和流化床工艺,以活性炭为载体浸渍锌化物做催化剂,将固体氯化铵加入固定床或流化床反应器中,甲醇经气化后通入到床层内部接触反应。使用活性Al2O3催化剂,在350 ℃条件下通入氯化铵、甲醇和水蒸气的混合物,摩尔比NH4Cl∶CH3OH∶H2O=1∶0.85∶2.5,空速 15000 h−1,CH3Cl收率为65%,NH3收率58%,甲胺收率7%,甲醚收率3%。使用CAL活性炭(12~18目)做催化剂时,CH3Cl的选择性提高,副产微量甲胺类和二甲醚[27]。
最新的研究以γ-Al2O3、高岭土、HZSM-5为载体,负载4% Co(NO3)2金属活性组分的催化剂条件下,氯化铵和甲醇摩尔比为1∶1.1,反应温度330~390 ℃,适宜空速为0.7 s−1时,效果最佳,甲醇的转化率达到 90%以上,氯甲烷收率可达到73.25%[28]。
3.1.2 NH4Cl与乙醇反应
NH4Cl与乙醇反应与甲醇类似,反应生成氯乙烷、水和氨气。以CuCl做主催化剂,将5.5 kg CuCl和1.8 kg NH4Cl及0.059 kg ZnCl2混合,于335~347 ℃熔融状态下通入乙醇蒸气,乙醇通入速率0.0059 kg/s,充分反应后9.1%的乙醇转化成氯乙烷,转化率很低[29]。反应方程式如式(23)。
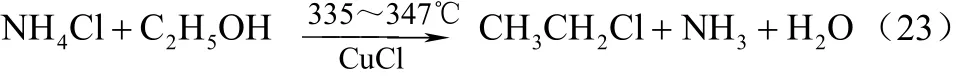
3.2 NH4Cl与乙炔反应制氯代烃工艺
材料工业中,最大的耗氯产品就是聚氯乙烯(PVC),2012年中国聚氯乙烯的产量达到 1326.2万吨,虽然中国的氯碱行业随着PVC的扩产进行了较大规模的扩产,但每年的氯元素的应缺口在170~230万吨。氯化铵中氯元素的质量分数为66%,直接以氯化铵为原料,利用其中的氯元素替代氯气合成PVC无疑能够缓解氯资源的紧张状况,减少电解氯化钠这类高耗能工艺在氯碱工业中的比重,大幅度降低PVC的生产成本,同时还能解决氯化铵作氮肥施用造成大量氯元素浪费的问题。
在 250~350 ℃、常压及催化剂存在条件下,乙炔与氯化铵反应生成氯乙烯和NH3,已知HgCl2和 BiCl3、PbCl2、BaCl2、LaCl3、MgCl2、ZnCl2、AlCl3或FeCl3对该反应有催化活性,载体可以是活性炭、SiO2、Al2O3、硅胶、分子筛中的一种或几种混合物。反应方程式如式(24)。

据有关专利报道,使用负载 LaCl3和 BaCl2的活性炭催化剂,将1∶1.2(摩尔比)的乙炔与氯化铵混合气通入装有上述催化剂的反应器中,控制反应温度在340 ℃,反应时间约120 s,反应产物用水吸收NH3后,剩余气体冷冻压缩即可得到液态氯乙烯产品。以乙炔计,反应的一次转化率在60%以上,氯乙烯的选择性大于95%[30]。
3.3 NH4Cl与乙烯氧氯化反应制氯代烃工艺
在氧氯化催化剂作用下,乙烯与O2和HCl发生氧氯化反应,主要生成 1,2-二氯乙烷,反应温度280~360 ℃,其中HCl可以是纯HCl,也可以是通过分解 NH4Cl产生 HCl。NH4Cl分解产生的NH3在O2存在条件下会发生燃烧反应,同时氧氯化反应也消耗氧气,两个反应耗氧出现竞争,烧氨反应导致NH3的收率降低。乙烯的燃烧及生成氯乙烷的反应在乙烯氧氯化的副反应中占有很大比例,催化剂中加入KCl可以抑制氯乙烷的生成,同时会明显降低催化剂的整体催化活性[31],副反应也会生成少量的1,1,2-三氯乙烷。主反应方程式如式(25)。
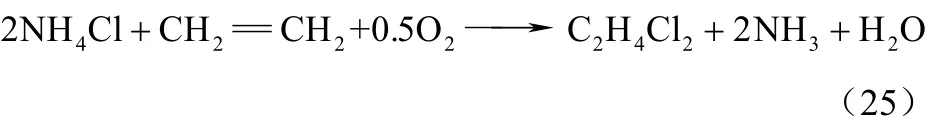
乙烯氧氯化反应的催化剂有多种,如含Fe、Cu的化合物,CuCl2的活性最好,使用负载CuCl2的催化剂,乙烯生成氯代烃的转化率最高只能达到40%,NH3回收率为80%。这种条件下,NH3燃烧只生成H2O和N2。但CuCl2做催化剂有一个缺点,氧氯化反应的温度条件下CuCl2易挥发,造成反应活性组分的流失,使催化剂活性降低[32-33]。
通过对催化剂的改良,抑制NH3的燃烧反应,减少烧氨反应对主反应产生的耗氧竞争,可以使反应更有利于烯烃的氧氯化反应。其中一种有效的方法是在催化剂上负载CsCl2,可以抑制NH3的燃烧反应,掺入其他稀土金属如Nd的化合物也可以抑制烧氨反应。
4 氯化铵与环氧乙烷反应制醇胺盐酸盐工艺
NH4Cl与环氧乙烷、水反应可以生成乙醇胺盐酸盐。在N2氛围下,将氯化铵、水和环氧乙烷加入反应釜混合,各反应物摩尔比为 n(NH4Cl)∶n(H2O)∶n(C2H4O)=1∶2.100∶(1.135~2.66),反应温度 50~60 ℃,充分反应后过滤,用甲醇洗涤,50 ℃条件下真空干燥得到单乙醇胺盐酸盐。未反应的环氧乙烷在 70~100 ℃条件下于反应釜内继续反应生成三乙醇胺盐酸盐,三乙醇胺盐酸盐经洗涤过滤后反应得到二乙醇胺盐酸盐[34-35]。
除以上各种应用工艺外,NH4Cl可以作高能氯化铵锌锰干电池的电解质,还可与稀土氧化物共热制备无水氯化稀土,与Mg2Si反应制备硅烷,处理电石渣制备纳米碳酸钙,制造水和二氧化硅,从粉煤灰中浸取锗,与NaNO2反应在热化学采油技术中广泛的应用于热化学解堵、稠油降黏和地层热化学压裂[36-44],与甲醛反应合成甲胺和甲酸等。
5 氯化铵应用展望
从前文分析可以看出,NH4Cl制取 NH3、HCl或Cl2的工艺过程,参与反应的多数是熔融态的盐、强酸或强碱性物质,具有很强的腐蚀性,对反应、输送设备的材质具有很高的要求,进而加大生产投入成本;而且反应温度较高,有的反应需要严格控制反应的进度,操作困难;此外多数采用间歇性操作,很难实现生产过程的连续性,以上反应只在特定场合有着一定的应用,不适合大规模应用来解决中国数量巨大的氯化铵整体出路的问题。氯化铵与低碳醇、乙炔、乙烯等有机物制备氯代烃的工艺应条件比较温和,相对于熔融态的反应状况腐蚀性要小得多,反应温度相对较低,而且很容易实现连续操作,得到的反应产物经济效益更高,具有更优越的应用价值。
在中国,氯化铵与低碳醇、乙炔、乙烯等有机物制备氯代烃的工艺并没有得到大规模的工业应用,只是停留在基础研究阶段,缺乏基本的工艺数据,90%以上的氯化铵仍是作为廉价的氮肥使用,严重制约着联碱企业的经济效益,还造成了大量资源的浪费及环境问题。在氯化铵的多种应用工艺中,NH4Cl参与的乙炔氢氯化和乙烯氧氯化合成氯乙烯的反应,能够充分利用氯化铵中数量庞大的氯资源并产出高附加值的氯乙烯产品,是解决中国氯化铵不合理利用现状、提高联碱企业经济效益的重要思路,具有重要研究意义。
[1]李继睿,禹练英. 小苏打生产废水中热法回收氯化铵工艺参数的选择[J]. 广州化工,2008,36(6):54-58.
[2]杨春光,郑艳梅,张立强,等. 从生产甘氨酸废水中回收氯化铵工艺研究[J]. 无机盐工业,2003,35(1):42-43.
[3]刘润静,赵晓凤. 氯化铵固相分解法生产氨新工艺的研究[J]. 纯碱工业,2012(3):3-5.
[4]王旭东,吴敏. 氯化铵转化与资源综合利用[J]. 化工生产与技术,2008,15(1):41-43.
[5]何克芝. 联碱企业生产颗粒氯化铵前景分析[J]. 纯碱工业,2003(6):16,28.
[6]尚建壮. 我国纯碱工业现状分析[J]. 现代化工,2007,27(3):63-65.
[7]翟广伟,韩明汉,梁耀彰,等. 氯化铵分解制NH3和HCl工艺[J].过程工程学报,2009,9(1):59-62.
[8]刘小平. 氯化铵的综合利用[J]. 中氮肥,1991(6):33-34.
[9]丁可敬,纪伟. 我国纯碱企业的现状与发展建议[J]. 纯碱工业,2004,1:1-3.
[10]曹卫宇,卢啸炀,陈国华,等. 颗粒氯化铵生产技术研究与探讨[J].纯碱工业,2012(4):22-24.
[11]孙杰,戴远玲. 谈氯化铵造粒方案的选择[J]. 纯碱工业,2011(3):42-43.
[12]李正明. 氯化铵的合理使用与发展前景[J]. 化肥工业,1997,25(1):11-l6.
[13]邵玉昌. 氯化铵的反应及应用[J]. 纯碱工业,2008(4):3-12.
[14]翁贤芬. 氧化锌熔融分解氯化铵工艺研究[J]. 无机盐工业,2010,42(9):33-35.
[15]Sasaki Hiromi,Takahara Yoshiyuki. Process for producing hydrogen chloride and ammonium:US,4293532[P]. 1981-10-06.
[16]张智新. 一种氯化铵制取HCl和NH3的方法:中国,102009954[P].2011-04-13.
[17]张智新. 氯化铵分解法:中国,1087062[P]. 1994-05-25.
[18]曾凤春. 氯化铵转化技术现状及展望[J]. 无机盐工业,2009,41(9):1-3.
[19]Ricks M J. Oxychlorination process:US,3867469[P]. 1975-02-18.
[20]Coenen A,Kosswig K,Balzer D. Method for preparing ammonia and hydrogen chloride from ammonium chloride:US,4305917[P].1981-12-15.
[21]Coenen A,Balzer D,Kosswig K,et al. Method for preparing ammonia and hydrogen chloride from ammonium chloride:US,4305917[P]. 1981-12-15.
[22]Mond L,Eschellmann George. Process of obtaining chlorine:US,416038[P]. 1889-10-26.
[23]Mond L. Process of obtaining chlorine:US,529130[P]. 1894-11-13.
[24]Carpmaels,Ransfod. A process for the preparation of ammonia and chlorine from ammonium chloride:GB,998216[P]. 1965-07-14.
[25]Churchill J W,Kenmore,Robert M Thomas,et al. Production of organic chlorides by reaction of organic compound with ammonium chloride:US,2755310[P]. 1951-07-17.
[26]钟劲光. 一种卤代烷烃的制备方法:中国,101407443A[P]. 2009-04-15.
[27]王之德. 氯化铵利用的新方向——制取氯甲烷和氨[J]. 化工进展,1988,7(3):38-39.
[28]孙玉捧,刘硕,尚建楠,等. 甲醇氯化铵法反应催化剂的研究[J]. 化学反应工程与工艺,2011,7(5):400-405.
[29]Churchill J W,Kenmore,Robert M Thomas,et al. Reaction of organic compounds with ammonium chloride:US,2755316[P].1956-07-17.
[30]姜标,钟劲光. 一种氯化铵分解制氯乙烯的方法:中国,101830773[P]. 2010-09-15.
[31]Ken Shiozaki Hyogo,Akira Ohnishi Kakogawa. Catalyst for oxychlorination of ethylene:US,4424143[P]. 1984-01-03.
[32]John D Scott. Oxychlorination catalyst composition and an oxychlorination process using it:US,5011808[P]. 1991-03-30.
[33]Borisov V A,D`yachenko A N,Kraidenko R I. Reaction of zinc oxide with ammonium chloride[J]. Russian Journal of Inorganic Chemistry,2012,57(4):499-501.
[34]薛守礼,薛芳,薛荔. 制备乙醇胺盐酸盐及联产品乙醇胺的方法:中国,102304055A[P]. 2010-01-04.
[35]Alfred C,Kurt K,Dieter B. Method for preparing ammonia and hydrogen chloride from ammonium chloride:US,4305917[P].1981-12-15.
[36]Zhao S,An H,Chen S. A study of a high-power,ammonium chloride zinc/manganese dioxide dry battery[J]. Journal of Power Sources,1998,76(2):218-220.
[37]时文中,张昕,赵永和,等. 氯化铵氯化氧化镧(铈)的反应过程及其动力学[J]. 过程工程学报,2005,5(1):23-28.
[38]朱国才,田君. 氯化铵法处理氟碳铈矿原矿提取稀土[J]. 中国有色金属学报,2000,10(5):701-704.
[39]朱国才,徐颖惠,池汝安,等. 氯化铵焙烧回收脱锰矿泥中的稀土及其动力学[J]. 化工冶金,2000,21(1):14-17.
[40]祁宏祥,汪康. 硅化镁-氯化铵法制备硅烷的工艺研究[J]. 化学工业与工程技术,2013,34(2):37-40.
[41]张爱华,朱敏,关云山,等. 氯化铵处理电石渣制备纳米碳酸钙的实验研究[J]. 科学技术与工程,2013(10):2880-2883.
[42]卢忠远,康明,姜彩荣,等. 利用电石渣制备多种晶形碳酸钙的研究[J]. 环境科学,2006,27(4):775-778.
[43]张军闯,王德智. 热化学采油技术应用研究[J]. 油气采收率技术,1999,6(4):62-66.
[44]袁红安,谢志海,李源鎏,等. NaNO2和NH4Cl酸催化反应动力学研究[J]. 内蒙古石油化工,2008(1):15-17.
