糠醛改性O-季铵化壳聚糖衍生物的合成及其抗菌性能
2014-06-11李玮李明春辛梅华
李玮,李明春,辛梅华
(华侨大学材料科学与工程学院,环境友好功能材料教育部工程中心,福建 厦门 361021)
壳聚糖作为天然抗菌高分子,具有无毒、生物相容性和生物降解性好、价格低廉等优点,但是在中性介质中溶解性差限制了其应用范围[1]。可以通过化学改性提高壳聚糖的水溶性,增强其抗菌活性,对壳聚糖的化学改性主要有烷基化、酰化和季铵化等,都能不同程度提高其水溶性。其中季铵化在提高水溶性的同时,由于引入正电性基团,能与带负电性的细胞膜结合,导致细菌细胞膜受损从而增强壳聚糖衍生物的抗菌效果[2]。
壳聚糖的NH2易与醛、酮类化合物反应生成席夫碱。席夫碱结构中含有C=N键,其中N原子上的孤对电子使壳聚糖具有良好的化学配位性能,因此壳聚糖希夫碱衍生物具有良好的生物活性[3]。近年来,壳聚糖席夫碱的研究在不断深入,已报道的有Santos等[4]研究的壳聚糖与水杨醛反应生成席夫碱。金晓晓等[5]制备了壳聚糖柠檬醛席夫碱,研究表明产物的抗菌活性随浓度的增加而增加,并且优于壳聚糖本身;进一步研究[6]表明壳聚糖肉桂醛席夫碱衍生物也具有较好的抗菌活性。Han等[7]制备了壳聚糖苯甲醛席夫碱,通过抑菌圈实验发现所得衍生物具有一定的抑菌效果。但壳聚糖与含有五元杂环的醛类反应生成的席夫碱衍生物的抗菌活性研究目前鲜有报道。因此在制备水溶性较好的O-季铵化壳聚糖基础上,进一步使之与糠醛反应制备 O-季铵化-N-呋喃亚甲基壳聚糖席夫碱及还原产物 O-季铵化-N-呋喃甲基壳聚糖衍生物,并比较研究其抗菌活性。
1 实验部分
1.1 主要仪器及试剂
TU-1810 紫外可见分光光度计,北京普析通用仪器公司;FD-1B-50冷冻干燥机,北京博医康实验仪器公司;NEXUSU 470型傅里叶变换红外光谱仪,美国Nicolet公司;AvanceⅡ型核磁共振分析仪,瑞士 Bruker公司;Vario MICRO元素分析仪,德国Elementa 公司;Universal V2.4F TA热分析仪,美国TA仪器有限公司;透析袋截留相对分子质量范围8000~14000,北京鼎国昌盛生物技术有限公司。
壳聚糖,相对分子质量10万,脱乙酰度85%,济南海得贝海洋生物工程有限公司;苯甲醛(98.5%),缩水甘油三甲基氯化铵(70%),硼氢化钠(96%),糠醛,上海国药集团化学试剂有限公司;其他试剂均为分析纯。大肠杆菌(E. coli,ATCC DH5α)和金黄色葡萄球菌(S. aureus,ATCC 26003)由华侨大学分子药物研究所提供。
1.2 O-季铵化壳聚糖的合成
[8]方法,将4.0 g壳聚糖、120 mL 2%的乙酸溶液和120 mL甲醇依次加入三颈瓶中, 搅拌溶胀1 h,将23.3 g苯甲醛溶解于80 mL甲醇后加入上述体系,50 ℃反应4 h,过滤洗涤。滤饼用5% NaHCO3溶液浸泡,过滤洗涤,60 ℃真空干燥得N-苯亚甲基壳聚糖席夫碱[CS (BA)],并研至粉末状。称取1.0 g CS(BA)于三颈瓶中,将4.38 g缩水甘油三甲基氯化铵溶于70 mL异丙醇及少量蒸馏水中,缓慢滴加到分散于40 mL异丙醇的CS(BA)的三颈瓶中。70 ℃反应8 h,抽滤,60 ℃真空干燥并研至粉末状,得 O-季铵化-N-苯亚甲基壳聚糖席夫碱[O-HTCC (BA)]。将1.0 g O-HTCC(BA)分散于150 mL 0.5 mol/L 盐酸-乙醇溶液中,40 ℃反应24 h。抽滤洗涤,干燥后用无水乙醇索氏提取,40 ℃真空干燥得O-季铵化壳聚糖(O-HTCC)。
1.3 O-季铵化-N-呋喃亚甲基壳聚糖的合成
将0.5 g O-HTCC充分溶解于40 mL蒸馏水中,加40 mL异丙醇,搅拌,向体系中加入溶于40 mL异丙醇的糠醛1.80 g,40 ℃反应6 h,得到O-季铵化-N-呋喃亚甲基壳聚糖席夫碱[O-HTCC(FF)]。NaBH4还原得产物 O-季铵化-N-呋喃亚甲基壳聚糖(O-FHTCC)。将O-HTCC(FF)和O-FHTCC过滤除去杂质,滤液用蒸馏水透析3天,冷冻干燥。
制备路线见图1。
1.4 产物的结构表征及热性能测试
采用溴化钾(KBr)压片,用傅里叶变换红外光谱仪测定各产物的红外光谱。采用氘代水(D2O)作溶剂,用WP100SY 型核磁共振分析仪测定产物的核磁共振氢谱(1H NMR)。用VARIO EL III元素分析仪对产物元素进行测定。在N2气氛下,以10 ℃/min的升温速率,在室温到500 ℃的范围内升温,用Universal V2.4F热分析仪测定产物的热重分析。
1.5 产物的抗菌性能测定
1.5.1 最低抑菌浓度测定
按照作者课题组的方法[9]配制样品溶液及培养基并在 121 ℃下高压灭菌 20 min。大肠杆菌(E.coli)及金黄色葡萄球菌(S. aureus)在培养基中培养一段时间,使菌液浓度约为108CFU/mL(分光光度法测定)。
将浓度为1×104μg/mL的样品溶液加入培养基中[10],配成质量分数分别为 0.4%,0.2%,0.1%,0.05%,0.025 %,0.0125%,0.00625%,0.00313%样品的培养液。再分别加入10 μL,108CFU/ mL的菌液,37 ℃振荡培养24 h,以相同样品浓度的空白培养液做参比测定其在600 nm 的吸光度。与前一个低浓度的吸光度差两个数量级并且培养液澄清透明所对应的样品浓度即为最低抑菌浓度。实验重复3次。
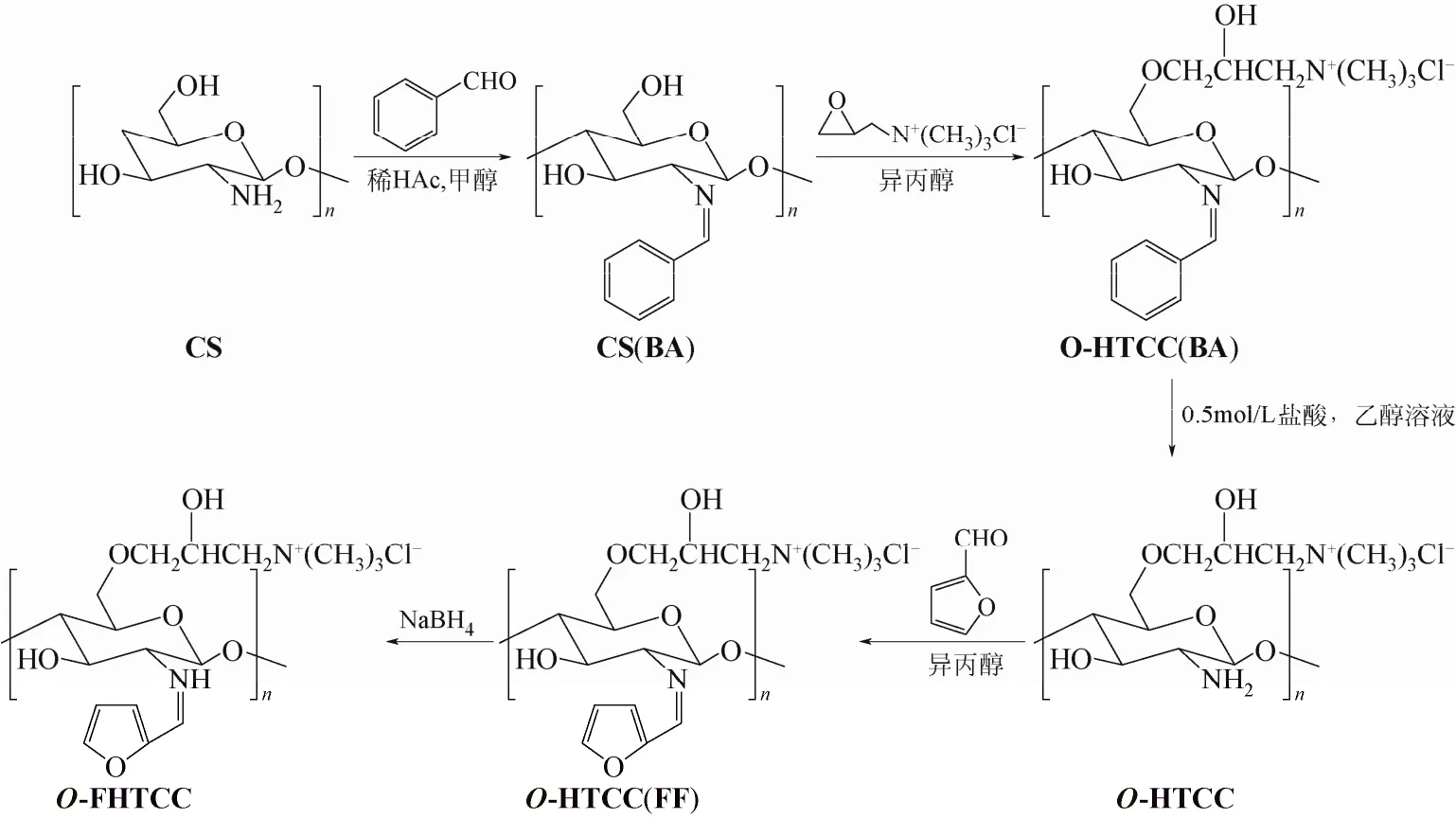
图1 O-季铵化-N-呋喃亚甲基壳聚糖的合成
1.5.2 抑菌率的测定
按照作者课题组的方法[11],在1.2 mL的pH值7.2培养基中加入0.8 mL样品溶液,同时分别加入大肠杆菌和金黄色葡萄球菌配成菌种浓度为 105~106CFU/mL的溶液,以10mL不加样品的空白培养基为对照。在37 ℃摇床中将大肠杆菌培养1 h,金黄色葡萄球菌培养0.5 h。分别取25 μL培养液均匀涂到控制板和样品板的琼脂培养基上,在恒温 37℃培养箱培养24 h,数出培养皿上的菌落数。按式(1)计算抑菌率。

2 结果与讨论
2.1 产物的FTIR分析
采用KBr压片法测得原料及产物的FTIR如图2。其中,a 为壳聚糖的红外吸收谱线,b为O-季铵化-N-苯亚甲基壳聚糖席夫碱的吸收谱线[O-HTCC(BA)],与a相比,b在1614 cm−1处的伯胺N—H弯曲峰消失,说明在—NH2发生了取代。并且在1588 cm−1处出现苯环C—C骨架吸收峰,880 cm−1附近出现苯环的单取代吸收峰,1640 cm−1附近吸收峰强度增大并且发生红移现象,表明C=N伸缩峰与酰胺吸收峰重叠[7],1500 cm−1附近出现季铵盐的CH2、CH3弯曲振动峰,950~1000 cm−1间出现的峰为季铵盐吸收峰[8],由FTIR说明产物为O-HTCC(BA)。c为 O-季铵化壳聚糖(O-HTCC)吸收谱线,与b相比,表征苯环的1580 cm−1和880 cm−1吸收峰基本消失,说明苯甲基已从氨基脱除,只有极少残余。d为O-季铵化-N-呋喃亚甲基壳聚糖席夫碱[O-HTCC(FF)]的吸收谱线,与c相比,910和757 cm−1出现呋喃环的特征峰[12],1500 cm−1处的峰增强说明呋喃骨架伸缩峰与季铵盐的CH2、CH3弯曲峰重叠,并且1614 cm−1处的伯胺N—H弯曲峰消失,说明呋喃环接枝在—NH2上。e为O-季铵化-N-呋喃亚甲基壳聚糖(O-FHTCC)的吸收谱线,与d相比,1640 cm−1附近的C=N伸缩峰大幅减弱。说明产物为 O-HTCC(FF)被还原后的目标产物O-FHTCC。
2.2 产物的1H NMR分析
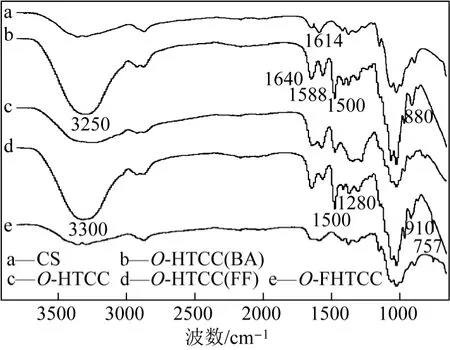
图2 原料及产物的FTIR谱图
以D2O为溶剂,测得O-季铵化-N-呋喃亚甲基壳聚糖席夫碱[O-HTCC(FF)]和 O-季铵化-N-呋喃亚甲基壳聚糖(O-FHTCC)的1H NMR谱图,如图3和图4所示。图3和图4中δ4.4~3.4为壳聚糖骨架的 H1,H2,H3,H4,H5,H6,H6'相对应的质子峰,δ=3.3附近为壳聚糖季铵盐N上的甲基质子峰[4]。图3中δ7.5~7.3、δ6.4~6.3为呋喃亚甲基席夫碱结构的质子峰,说明产物为O-HTCC(FF)。图4中δ2.8说明产物具有芳环结构(呋喃环具有芳环性质)[13],同时δ7.4、δ6.4~6.2为呋喃亚甲基质子吸收峰。

图3 O-HTCC(FF)的 1H NMR谱图
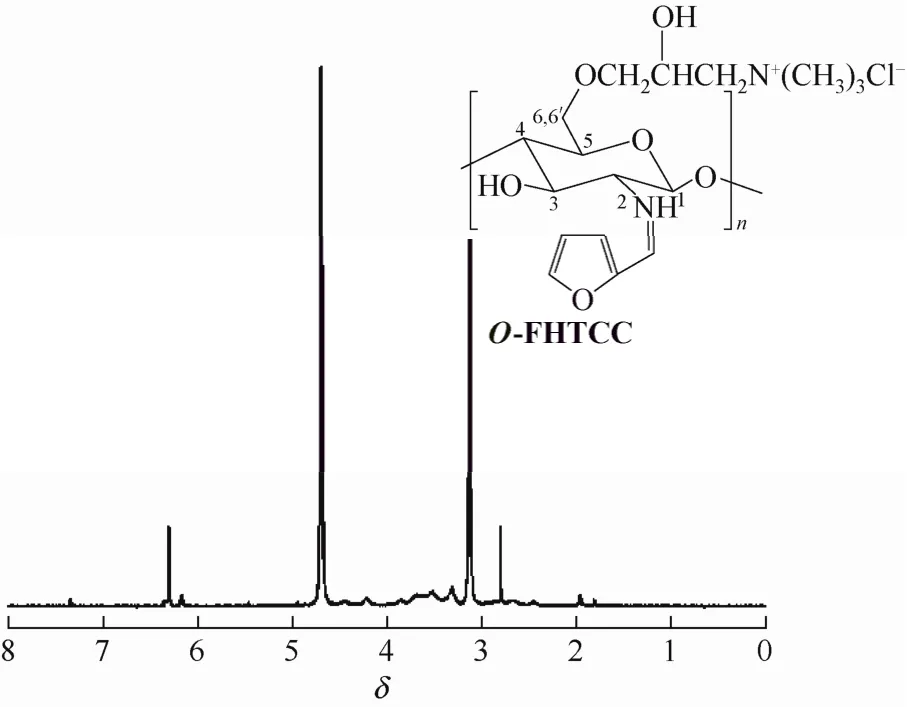
图4 O-FHTCC的 1H NMR谱图
2.3 产物的元素分析及取代度
产物的元素分析结果见表1,用C/N比计算各产物的取代度[14]。结果壳聚糖的脱乙酰度为84.32%,O-HTCC(BA)的N-苯亚甲基席夫碱取代度为76.14%,O-HTCC的季铵化取代度为46.35%,O-HTCC(FF)的 N-呋喃亚甲基席夫碱取代度为23.17%,O-FHTCC的 N-呋喃亚甲基取代度为23.17%。
2.4 产物的热重分析
在N2保护下,以10 ℃/min的速率升温,测定25~800 ℃范围产物的 TG,结果如图 5所示。在100 ℃以下3种产物均有失重现象出现,这是样品中的结晶水和自由水丢失所致。在 220~280 ℃范围3种产物的失重可能是壳聚糖的主链及侧链发生了降解[9]。由 TG曲线可以看出 O-HTCC(BA)的热稳定性大于 O-HTCC(FF),这是因为苯环中键长完全平均化,而作为五元杂环的呋喃环键长只有一定程度的平均化,因此苯环共轭体系稳定性大于呋喃环共轭体系[15]。而 O-FHTCC的热稳定性大于O-HTCC(BA)和O-FHTCC,是因为C—N键的稳定性大于C=N键。终产物O-FHTCC在200 ℃以下能稳定存在。
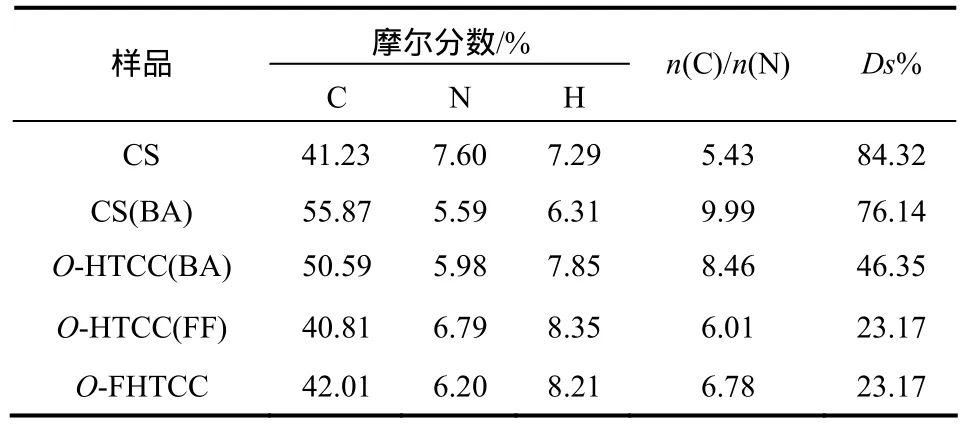
表1 产物的元素分析及取代度
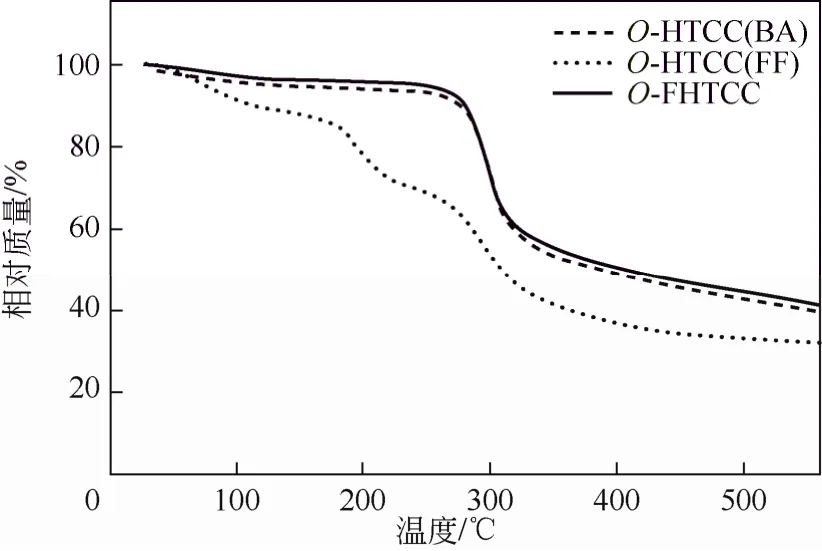
图5 产物的TG图
2.5 产物的溶解性试验
称取 0.1 g 的壳聚糖、N-苯亚甲基壳聚糖席夫碱、O-季铵化-N-苯亚甲基壳聚糖席夫碱、O-季铵化壳聚糖、O-季铵化-N-呋喃亚甲基壳聚糖席夫碱、O-季铵化-N-呋喃亚甲基壳聚糖分别于10 mL丙酮、氯仿、THF、2%乙酸等常见有机溶剂及水中,观察其溶解性能。结果,CS(BA)、O-HTCC(BA)、O-HTCC、O-HTCC(FF)、O-FHTCC 均不溶于常见有机溶剂中。而季铵化改性壳聚糖O-HTCC及呋喃杂环改性季铵化壳聚糖O-HTCC(FF)、O-FHTCC均能溶于水,这为产物在抗菌等方面的应用提供了可能性。
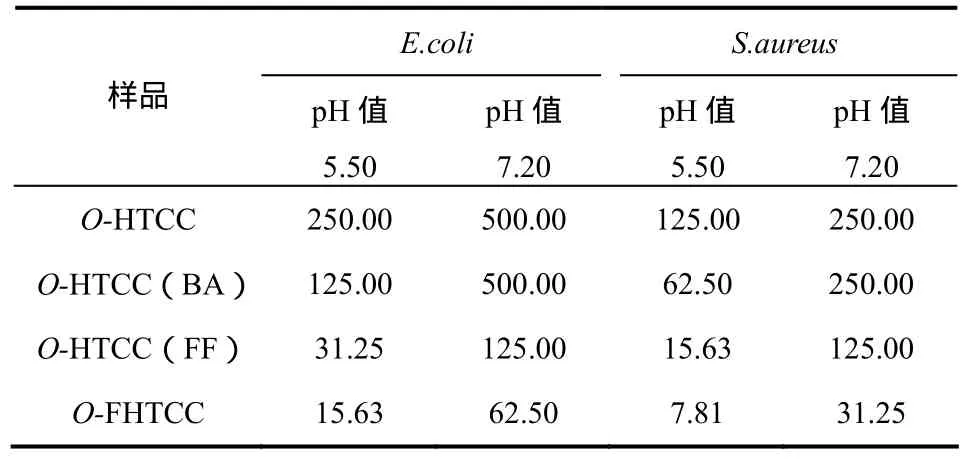
表3 产物对E. coli和S. auresus的MIC值 单位:μg/mL
2.6 产物的抗菌性能试验
2.6.1 最低抑菌浓度测定
按照实验部分1.5.1节的操作,测得各产物的最低抑菌浓度(MIC)见表3。
由表3可见,各合成产物均具有一定的抗菌效果,对革兰氏阳性菌S. aureus的抗菌活性比革兰氏阴性菌E. coil更强,并且在pH值 5.5的抗菌效果优于pH值 7.2,这与作者课题组前面的研究结果一致[11]。由表 3可以看出,抗菌活性顺序为 O-季铵化-N-呋喃亚甲基壳聚糖(O-FHTCC)>O-季铵化-N-呋喃亚甲基壳聚糖席夫碱[O-HTCC(FF)]> O-季铵化-N-苯亚甲基壳聚糖席夫碱[O-HTCC(BA)]>O-季铵化壳聚糖(O-HTCC)。O-FHTCC抗菌效果优于O-HTCC(FF),并明显优于其他二种壳聚糖衍生物O-HTCC(BA)和O-HTCC。此研究结果表明:含呋喃杂环的壳聚糖衍生物的抗菌活性明显优于不含杂环的壳聚糖衍生物。
O-FHTCC和 O-HTCC(FF)的抗菌效果明显优于O-HTCC和O-HTCC(BA),可能是由于呋喃环能够在微生物细胞膜和细胞壁附近以协同作用选择性的螯合对微生物(菌类)生长起关键作用的金属离子(铜、铁和锌等),从而降低细胞膜合成酶的活性,起到破坏细胞壁和细胞膜的作用,从而提高了抑菌效果[16-17]。O-FHTCC抗菌效果优于O-HTCC(FF),可能是由于O-HTCC(FF)的C=N键与呋喃环形成共轭体系,一定程度上影响了呋喃杂环的电子分布,从而影响呋喃环的螯合作用,故其抗菌效果不如O-FHTCC。
2.6.2 产物的抑菌率测定
按照实验部分1.5.2节的操作,用平板计数法测定0.1%样品溶液在pH值 7.0下对E. coli(作用时间1 h)和 S. Aureus(作用时间0.5 h)的抑菌率,结果如图6所示。由图6可见,各产物对E. coli和S. aureus都有较好的抑制作用,并且对革兰氏阳性菌S. aureus的抗菌效果优于革兰氏阴性菌E. coli。抗菌效果为O-FHTCC> O-HTCC(FF)> O-HTCC(BA)> O-HTCC。与最低抑菌浓度的实验结果一致。
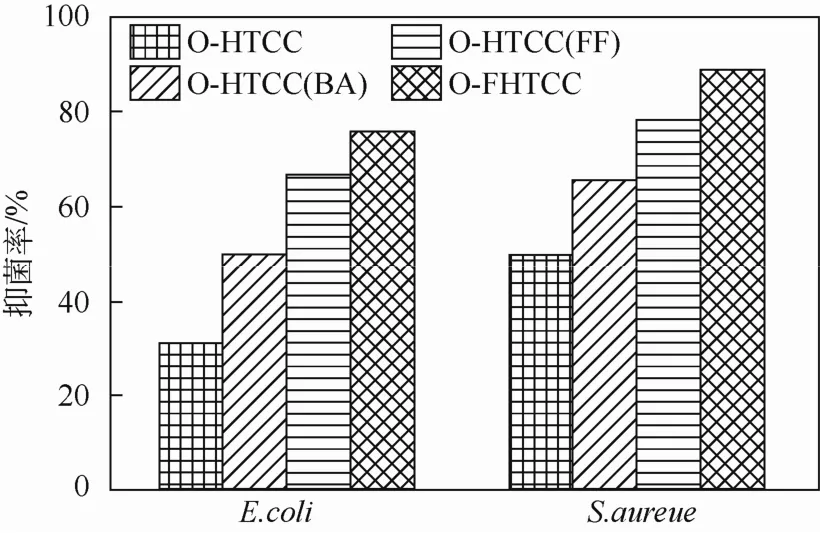
图6 产物对E. coli和S. aureus的抑菌率
3 结 论
制备了 O-季铵化-N-呋喃亚甲基壳聚糖席夫碱和 O-季铵化-N-呋喃亚甲基壳聚糖两种新型含呋喃杂环的水溶性壳聚糖衍生物。抗菌试验表明,产物对革兰氏阳性菌S.aureus的抗菌效果优于革兰氏阴性菌 E.coli,在 pH值 5.5的抗菌效果优于 pH值7.2。抗菌活性顺序为O-FHTCC> O-HTCC(FF)>O-HTCC(BA)> O-HTCC。研究表明:含呋喃杂环的壳聚糖衍生物的抗菌活性明显优于不含杂环的壳聚糖衍生物。为壳聚糖衍生物在生物医用抗菌领域的应用提供依据。
参考文献
[1]Mao Zhengwei,Ma Lie,Yan Jiang,et al. The gene transfection efficiency of thermoresponsive N,N,N-thimethyl chitosan chloride-g-poly(N-isopropylacrylamide)copolymer[J]. Biomaterials,2007,28:4488- 4500.
[2]蔡照胜,宋湛谦,杨春生,等. 壳聚糖季铵盐的制备与应用进展[J]. 生物质化学工程,2009,43(1):28-31.
[3]严琳,刘丰五,刘宏民. 新型呋喃基Shiff碱衍生物的合成、结构和生物活性[J]. 有机化学,2011,31(10):1639-1642.
[4]Santos Jose E dos,Dockal Edward R,Cavalheiro Eder T G. Synthesis and characterization of Shiff bases from chitosan and salicylaldehyde derivatives[J]. Carbohydrate Polymers,2005,60:277-282.
[5]金晓晓,王江涛,白洁. 壳聚糖与柠檬醛缩合反应产席夫碱及其抗菌活性[J]. 化工进展,2009,28(11):2014-2018.
[6]金晓晓,王江涛,白洁. 壳聚糖与肉桂醛的缩合反应制备席夫碱及其抑菌活性研究[J]. 高校化学工程学报,2010,24(4):645-650.
[7]Han Yangping,Lin Qiang. Synthesis,characterization,and antibacterial activity of quaternized of N-aromatic chitosan perivatives[J]. Applied Mechanics and Materials,2011,1202-1208.
[8]毛扬帆,李明春,辛梅华,等. O-季铵化改性壳聚糖固载环糊精的制备及载药性能[J].化工进展,2010,29(9):1705-1709.
[9]Xu Tao,Xin Meihua,Li Mingchun,et al.Synthesis,characterization,and antibacterial activity of N,O-quaternary ammonium chitosan[J].Carbohydrate Research,2011,346:2445-2450.
[10]Chakrabarty Souvik,King Allison,Kurt Pinar,et al.Highly effective,watersoluble, hemocompatible1,3-propyleneoxide-based antimicrobials: Poly[(3,3-quaternary/PEG)-copolyoxetane][J].Bromacromolecules,2011,12:757-769.
[11]Xu Tao,Xin Meihua,Li Mingchun.Synthesis,characteristic and antibacterial activity of N,N,N-trimethyl chitosan and its carboxymethyl derivatives[J].Carbohydrate Polymers,2010,81:931-936.
[12]Gandini Alessandro,Hariri Sahar,Le Nest Jean-Francois.Furanpolyether-modified chitosans as photosensitive polymer electrolytes[J].Polymer,2003,44:7565-7572.
[13]赵云,欧阳贵平,徐维明,等.4-(1,3,4-噻二唑-2-巯基)苯并[4,5]呋喃[3,2-d]嘧啶类衍生物合成、晶体结构及抗癌活性[J].有机化学,2010,30(7):1093-1097.
[14]Santos Z M dos,Caroni A L P F,Pereira M R,et al.Determination of deacetylationdegreeofchitosan: Acomparisonbetween conductometric titration and CHN elemental analysis[J].Carbohydrate Research,2009,344:2591-2595.
[15]邢其毅,裴伟伟,陈瑞秋,等.基础有机化学(下册)[M].第3版.北京:高等教育出版社,2005:875-883.
[16]夏金兰,王春,刘新星.抗菌剂及其抗菌机理[J].中南大学学报,2004,35(1):31-38.
[17]Sajomsang Warayuth,Tantayanon Supawan,Tangpasuthadol Varawut,et al.Quaternization of N-aryl chitosan derivatives:Synthesis, characterization, andantibacterialactivity[J].Carbohydrate Research,2009,344:2502-2511.
