吡啶络合法制备六氟磷酸锂
2014-06-11田明明刘晓红
田明明,刘晓红
(南昌大学环境与化学工程学院,江西南昌330031)
随着手机、数码相机、笔记本、电动车等产品的快速发展,对电池的要求越来越高。锂离子电池因具有工作电压高、能量密度大、无记忆效应、寿命长及安全无公害等特性,被称为“绿色环保能源”[1]得到广泛应用,作为锂离子电池重要组成物质之一的六氟磷酸锂的消耗量也得到快速增长。
目前,中国生产六氟磷酸锂的方法主要是氟化氢溶剂法[2],整个过程容易控制,工艺也较简单。但是,由于HF的强腐蚀性和使用毒性原料PF5,对生产设备要求过高,对操作人员危害大,且产品提纯过程复杂[3]。除此之外,六氟磷酸锂的制备方法还有气-固法、SO2溶剂法、络合法、溶液法等。1950年,美国著名氟科学家 J.H.Simmons[4]提出了制备 LiPF6的方法,即在镍制容器中使用气体PF5与固体LiF反应得到固体LiPF6,该方法优点是操作较简单,缺点是最终产品纯度较低,重结晶纯化产品使生产过程变得复杂,产品纯度降低,因此气-固法难以实现产业化。 Philippe Joubert[5-6]采用 SO2溶剂法制备六氟磷酸锂,即以不锈钢容器作为反应器,将LiF放入反应器中,然后注入液体SO2和PF5气体,在-10~10℃条件下反应数小时,让SO2与PF5挥发后得到六氟磷酸锂产品,该方法避免了使用HF,产品中HF含量很低,但是六氟磷酸锂产品中SO2含量较高。Smith William Novis[7]使用络合法制备六氟磷酸锂,络合法使用有机溶剂作为介质,其优点是可以避免对设备的腐蚀,价格便宜易得,缺点是所用原料PF5容易与有机溶剂发生反应生产其他杂质,同时LiPF6与有机溶剂形成的络合物难以分解,增加了后续的纯化难度和工艺步骤,影响最终产物纯度。Keiji Sato等[8]使用溶液法制备六氟磷酸锂,与络合法相似,避免了使用具有强腐蚀性的无水HF作溶剂,但是使用的PF5仍具有较强的腐蚀性,并且PF5易与溶剂发生反应生成其他杂质,影响产品纯度。中国采用吡啶络合法制备六氟磷酸锂的报道很少。为了避免使用腐蚀性原料,笔者采用溶剂化的方法制备六氟磷酸锂,避免了LiPF6溶于水的不稳定性。
1 实验
1.1 实验原理
1)HPF6与吡啶络合:

2)C5H5NHPF6与氢氧化锂在水或乙醇中进行锂交换反应:

3)将LiC5H5NPF6溶于四氢呋喃,加入适量H2SO4反应,将沉淀C5H5NH2SO4离心除去,挥发四氢呋喃得到 LiPF6:
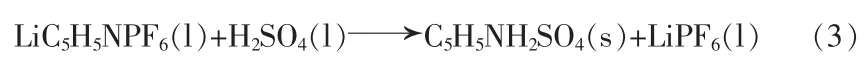
4)密闭样品六氟磷酸锂。
1.2 实验流程(见图1)
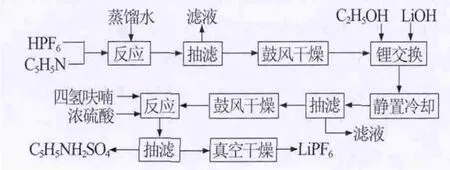
图1 吡啶络合法制备六氟磷酸锂工艺流程示意图
1.3 试剂和仪器设备
1.3.1 试剂
六氟磷酸,质量分数为60%,化学纯;吡啶、氢氧化锂、无水乙醇、浓硫酸、四氢呋喃等均为分析纯;蒸馏水,自制。
1.3.2 主要仪器设备
电热鼓风干燥箱(GZX-9140MBE);手套箱(BiLON-CX-101);恒温水浴装置(501 型);抽滤装置;电子分析天平(FA2104);红外光谱仪(Nicolet-380)。
1.4 实验方案
实验分3步进行:第一步用吡啶络合HPF6得到C5H5NHPF6,实验的影响因素有溶剂、反应温度、原料配比、反应时间等,采用单因素实验,目标函数是制备中间产物及得率,确定第一步反应的适宜工艺条件;第二步锂交换反应;第三步制备LiPF6。
1.5 样品测试
1.5.1 六氟磷酸吡啶
六氟磷酸吡啶表征采用红外光谱仪(Nicolet-380)。六氟磷酸吡啶产率等于实际制得产物质量与理论应得产物质量的比值。
1.5.2 六氟磷酸锂
六氟磷酸锂表征采用红外光谱仪(Nicolet-380)。
2 实验结果与讨论
2.1 中和反应溶剂的选择
中和反应现象:实验所用六氟磷酸其质量分数为60%,挥发性很强,是无机强酸,与呈碱性的高浓度吡啶反应速度很快,反应时放出热量,使温度升高反应速率进一步加快,反应非常剧烈。由于温度高,挥发剧烈,使得产物的产率下降。另外,从安全方面考虑,剧烈的放热反应不容易控制,易发生安全事故。所以,须找到合适的溶剂来降低反应速率。
以乙醇为溶剂:乙醇为溶剂可行,能够降低反应速率,且六氟磷酸的挥发量明显减少,产物的产率明显提高。
以蒸馏水为溶剂:水为溶剂可行,还可以降低生产成本。但是,实验发现产物六氟磷酸吡啶在水中的溶解度高于在乙醇中的溶解度,降低了产物的产率,然而可以通过减少溶剂水的用量来确保产率。在水中析出的产物六氟磷酸吡啶呈片状,比在乙醇中析出的沉淀颗粒大。
因为蒸馏水作为溶剂带入杂质少,无毒无害、廉价易得,能够有效降低反应速率,而且在产品干燥阶段易于去除,故选择水为中和反应的溶剂。
2.2 稀释及加料顺序
六氟磷酸和吡啶的中和反应属于液液反应。六氟磷酸挥发性较强,所以需要将六氟磷酸溶解在水中减少挥发,然后将吡啶加入低浓度的六氟磷酸水溶液中进行反应。如果将两者都稀释,则操作过程复杂且反应速率降低。
2.3 反应温度对中和反应产率的影响
将HPF6与吡啶的中和反应在不同温度下进行,用以探讨温度对C5H5NHPF6产率的影响,实验结果如图 2 所示。其他条件:原料配比 n(HPF6)/n(C5H5N)=1.0,反应时间为3 h。由图2可以看出:在低温下C5H5NHPF6的产率随着反应温度的升高有所增大,因为温度升高会加快分子之间的碰撞,加快了反应速率,提高了产物的产率;温度高于30℃以后,随着反应温度的增加C5H5NHPF6的产率逐渐下降,这是因为中和反应为放热反应。综合考虑能耗及产率,选择反应温度为25℃。
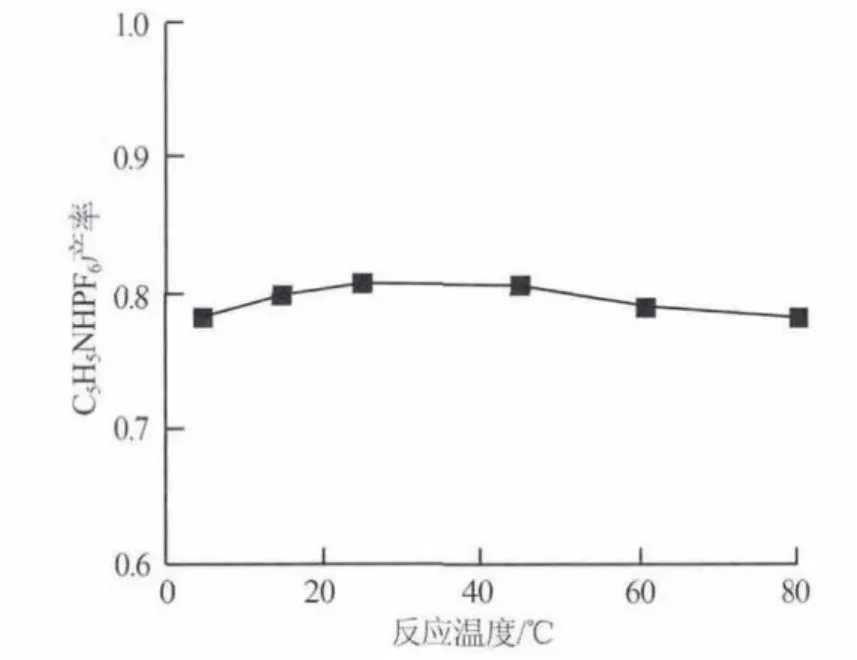
图2 反应温度对C5H5NHPF6产率的影响
2.4 反应时间对中和反应产率的影响
考察HPF6与吡啶的中和反应时间对C5H5NHPF6产率的影响,实验结果如图3所示。其他条件:原料配比 n(HPF6)/n(C5H5N)=1.0,反应温度为 25 ℃。 由图3可以看出:随着反应时间的延长C5H5NHPF6的产率增加。当反应时间达到3 h以后产物产率增加的幅度变缓,说明反应接近完全。所以选择反应时间为3 h。
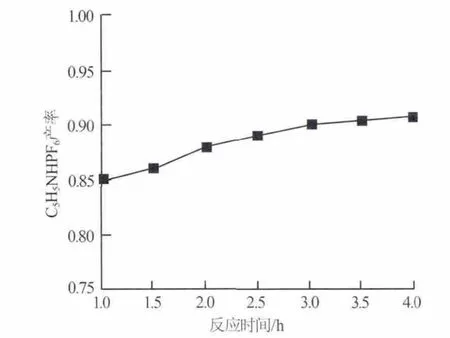
图3 反应时间对C5H5NHPF6产率的影响
2.5 原料配比对中和反应产率的影响
考察HPF6与吡啶中和反应原料配比n(HPF6)/n(C5H5N)对C5H5NHPF6产率的影响,实验结果如图4所示。其他条件:反应时间为3 h,反应温度为室温。 从图 4 可以看出,随着 n(HPF6)/n(C5H5N)的增大 C5H5NHPF6的产率下降。 当 n(HPF6)/n(C5H5N)为0.6时C5H5NHPF6的产率最高,但是此时吡啶大量剩余降低了原料的利用率。 当 n(HPF6)/n(C5H5N)为0.8时六氟磷酸反应完全,C5H5NHPF6的产率也较高,稍过量的吡啶可以通过挥发除去。所以选择n(HPF6)/n(C5H5N)为 0.8。
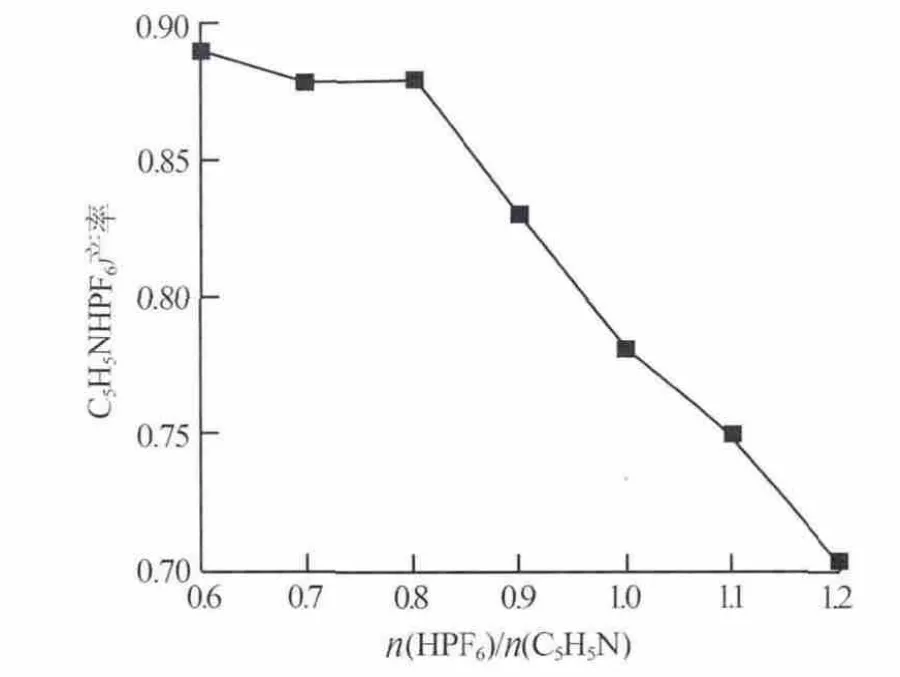
图4 n(HPF6)/n(C5H5N)对 C5H5NHPF6产率的影响
3 样品分析
3.1 六氟磷酸吡啶表征
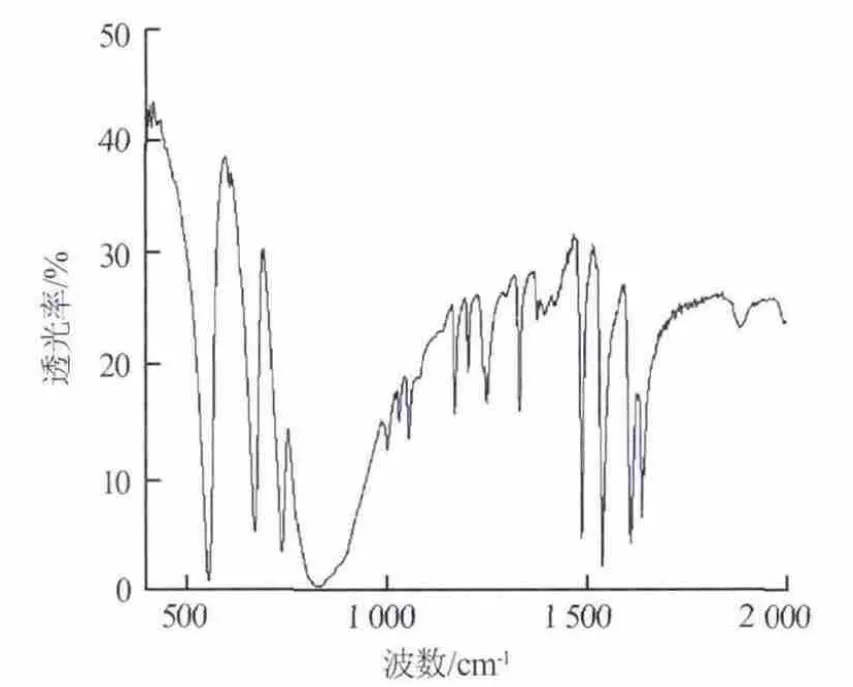
图5 制备的六氟磷酸吡啶红外光谱图
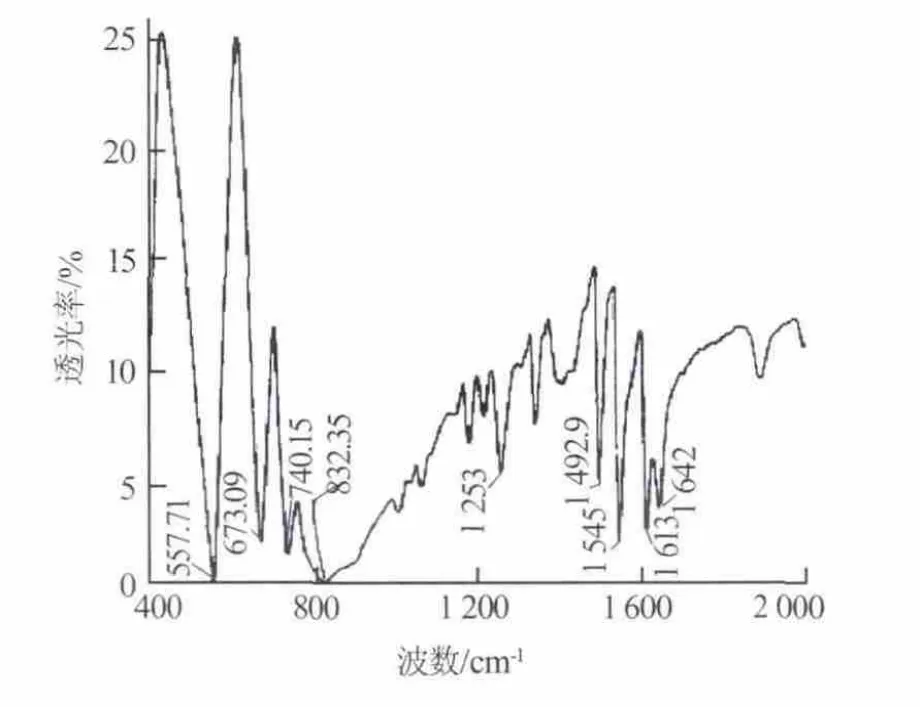
图6 标准六氟磷酸吡啶红外光谱图[9]
制备的六氟磷酸吡啶红外光谱图如图5所示,图6为标准六氟磷酸吡啶红外光谱图[9]。由图5可以看出,1 620 cm-1和1 640 cm-1为C=C伸缩振动形成的双峰,1 590~1 450 cm-1是C—H弯曲振动形成的峰,1 250 cm-1附近为—C—N伸缩振动形成的峰,以上符合吡啶基团的特征峰。890cm-1和558cm-1处的峰是PF6-伸缩振动和弯曲振动形成的特征峰,832 cm-1附近的宽峰是—N—H弯曲振动形成的特征峰。综上可以证明生成物为六氟磷酸吡啶。通过和标准六氟磷酸吡啶红外光谱图对照也可以看出,生成物是六氟磷酸吡啶。
3.2 样品六氟磷酸锂的表征
图7为制备的六氟磷酸锂样品的红外光谱图。由图7可以看出,在832、888、559 cm-l处有强吸收峰,对应F—P键伸缩振动和弯曲振动形成的峰。图8是商业奥德里奇六氟磷酸锂产品红外光谱图。图7与图8在832(890)cm-1和561 cm-1处显示了同样的谱线。证明样品是六氟磷酸锂。
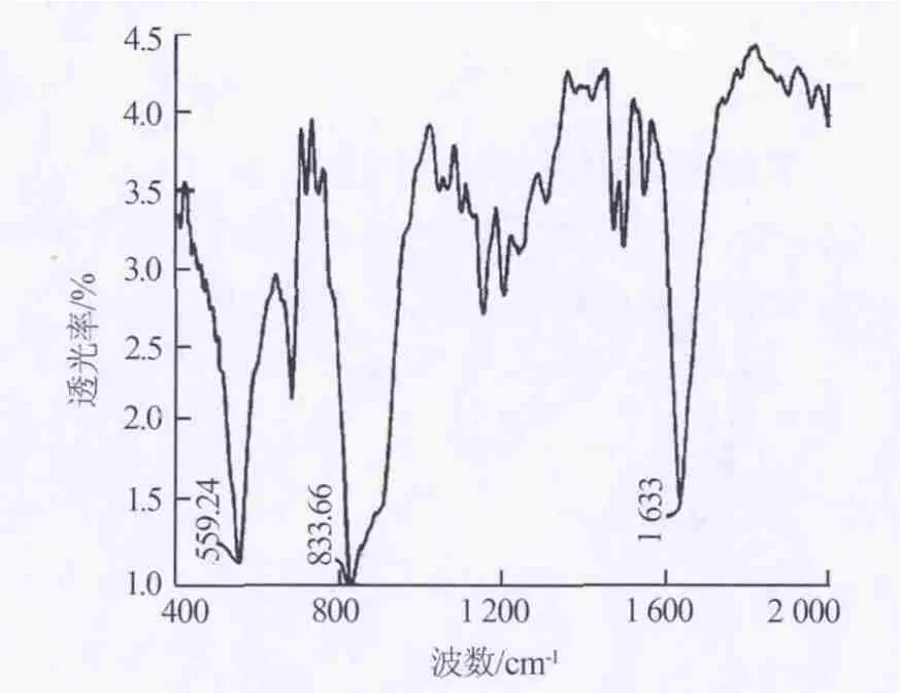
图7 制备的六氟磷酸锂样品红外光谱图
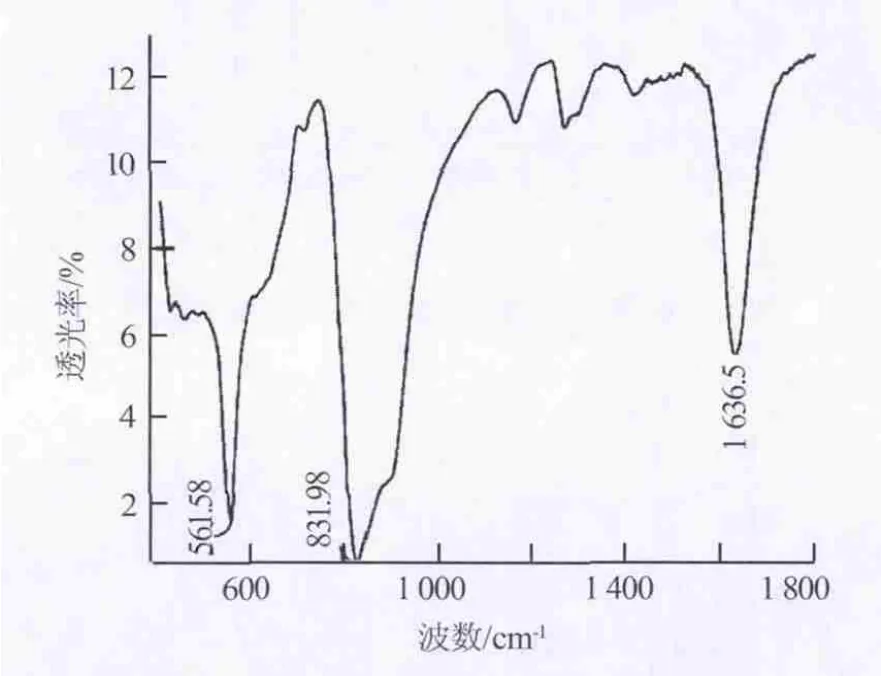
图8 工业六氟磷酸锂样品红外光谱图
4 结论
1)采用吡啶和六氟磷酸为原料制备吡啶六氟磷酸锂工艺可行,得到了六氟磷酸锂溶液。
2)中和反应用水作为溶剂可行,可以得到中间产物六氟磷酸吡啶。
3)制备六氟磷酸吡啶适宜工艺条件:反应温度为25 ℃,反应时间为 3 h,原料配比 n(HPF6)/n(C5H5N)=0.8。
4)从红外光谱图可以看到,制备的LiPF6样品杂质峰比较少,样品与标准卡片参数基本一致。
[1]宋作忠,蒋玉湘,马培华.锂离子二次电池及其电解质的研究[J].盐湖研究,1999,7(2):47-58.
[2]吴宇平,万春荣,李建军,等.锂电池非水电解质盐LiPF6的制备[J].电源技术,1999,23(增刊):99-101.
[3]王宗明,何欣翔,孙殿卿.实用红外光谱学[M].北京:石油化工出版社,1978:44-48.
[4]Simmons J H.Practice of fluorine science in lithium hexafluorophosphate[J].Fluorine Chemistry,1950,22(1):164-166.
[5]张建刚,王瑶.电解质六氟磷酸锂制备进展及难点分析[J].无机盐工业,2012,44(6):57-60.
[6]Philippe Joubert.Method for making lithium hexafluorophosphate:US,6500399B1[P].2002-12-31.
[7]Smith William Novis.Preparation of lithium hexafluorophosphate:US,3607020A[P].1971-09-21.
[8]Keiji Sato,Meguru Oe.Method for producing electrolyte solution for lithium ion battery and lithium ion battery using same:US,20090311610A1[P].2009-12-17.
[9]Robert Coudert,Daniel Lemordant,Regine Naejus,et al.Solvate of lithium hexafluorophosphate and pyridine,its preparation and preparation process for lithium hexafluorophosphate using said solvate:US,5993767A[P].1999-11-30.
