经皮射频消融术治疗椎体肿瘤术中温度变化的活体实验研究
2014-06-09陈珑倪才方王艳伟杨超王刚刚张帅肖剑
陈珑,倪才方,王艳伟,杨超,王刚刚,张帅,肖剑
·实验研究Experimental research·
经皮射频消融术治疗椎体肿瘤术中温度变化的活体实验研究
陈珑,倪才方,王艳伟,杨超,王刚刚,张帅,肖剑
目的研究经皮射频消融(RFA)治疗椎体肿瘤时椎管及椎体肿瘤内温度变化情况。方法采用CT引导经皮穿刺法将VX2瘤块接种入8只新西兰大白兔的腰椎内,建立兔椎体肿瘤模型。CT引导下对8只建模成功动物行RFA治疗。治疗开始后每间隔30 s分别记录治疗椎体肿瘤及同水平椎管内的温度,比较不同时间点椎管及椎体内温度之间有无差异。结果治疗过程中肿瘤内温度迅速上升至90℃并保持稳定,而消融时间持续3 min后,椎管内温度超过42℃。不同时间点的肿瘤与椎管内温度差异有统计学意义(P<0.05)。结论应用RFA治疗椎体肿瘤,可使病灶温度在短时间内升高至有效治疗温度,并保持相对稳定。延长消融时间将增加椎管内温度而可能造成神经损伤。
椎体肿瘤;经皮穿刺射频消融术;温度
射频消融术(radiofrequency ablation,RFA)是近年来开展的治疗实体肿瘤的微创方法,属肿瘤热疗的一种[1]。RFA最早用于肝、肾等实体脏器的肿瘤治疗,近年也有少量文献报道将其用于治疗椎体肿瘤,以起到局部杀伤肿瘤及缓解疼痛的目的[1-3]。但RFA治疗时产生的热量可能对椎管内神经产生不可逆的热损伤,从而引起包括瘫痪在内的严重并发症发生[3-6]。有关RFA治疗过程中随消融时间延长,椎管内温度变化情况的研究目前开展较少,本研究通过兔VX2椎体肿瘤模型探讨RFA治疗过程中椎体肿瘤及椎管内温度随消融时间延长的相应变化规律。
1 材料与方法
实验动物用体重3.0~3.5 kg的新西兰大白兔8只以及VX2荷瘤兔1只,由苏州大学动物实验中心提供。
1.1 椎体肿瘤模型建立
按文献报道建立兔椎体肿瘤模型[7]。椎体肿瘤接种30 min前,选择VX2荷瘤兔,全麻后无菌条件下,切取荷瘤兔大腿后外侧瘤体,取靠近肿瘤边缘的灰白色鱼肉样肿瘤组织,将其于无菌生理盐水中剪成大小约1 mm3的VX2瘤块备用。将实验兔麻醉,俯卧位四肢固定置于4排螺旋CT(Marconi Mx8000)检查床上,腰背部备皮。腰椎CT平扫后,选取L4或L5椎体最大层面作为穿刺平面,椎体与左侧椎弓根结合处为最佳目标穿刺点。穿刺区域局部消毒,用17 G穿刺套针(Angiotech)按拟定穿刺点、穿刺平面及角度穿刺腰椎椎体,当CT扫描显示针尖位于椎体中部区域后,停止穿刺。采用穿刺套针的内芯,将制备好的VX2瘤块经穿刺外套针送入椎体内,最后再将长约0.5 cm的明胶海绵条,沿外套针送入椎体内以栓塞封闭穿刺针道(图1)。接种后3周行CT扫描,见接种椎体明显椎体骨质破坏,确认椎体肿瘤模型建立成功(图2)。
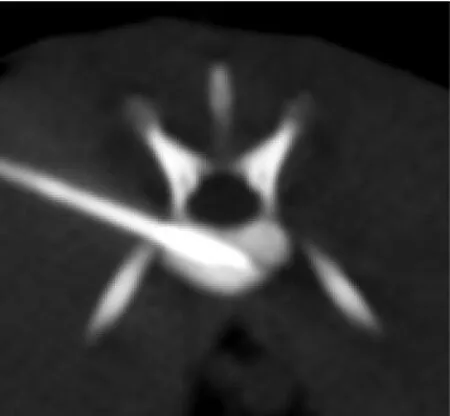
图1 CT定位下行穿刺接种,可见穿刺针于椎体内位置良好
1.2 经皮穿刺椎体肿瘤RFA治疗及测温过程
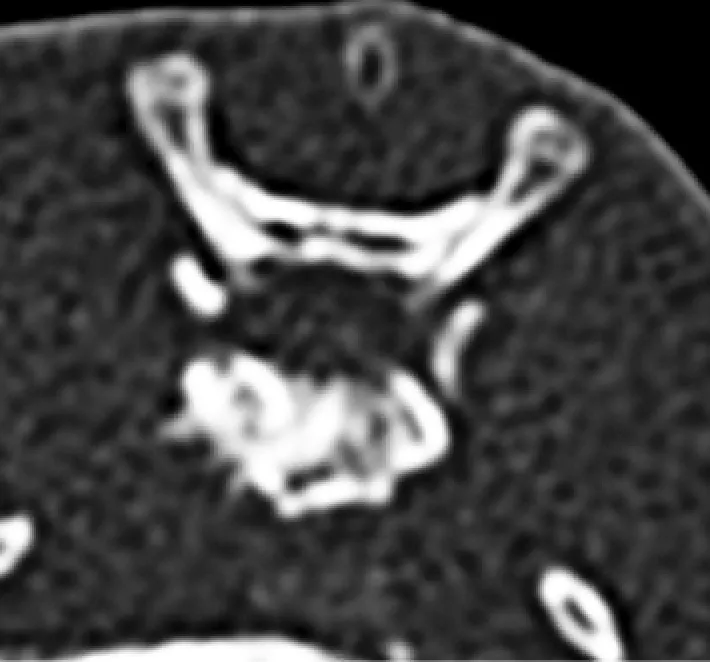
图2 建模成功后CT显示实验动物的接种椎体骨质破坏明显
实验动物在接受影像学检查及治疗时均采用地西泮1mg耳缘静脉推注和速眠新(0.2m l/kg)肌内注射镇静麻醉。实验动物麻醉后,俯卧位四肢固定于CT诊断床上。CT定位下以14 G穿刺套针(Angiotech)经皮穿刺到病变椎体内。再次CT扫描明确穿刺针尖位于病变椎体中央后,拔出套针内芯。将射频针(有效消融范围1 cm)经穿刺外套针引入到病变椎体内,再后退外套针于椎体外,即将射频针顶端1 cm有效工作范围暴露于椎体肿瘤内,再次行CT扫描,明确射频针尖位于病变椎体中。最后CT定位下将测温针(日本岛津)沿射频电极下方穿刺至病变椎体侧后方椎管旁(图3)。用100W的功率进行RFA治疗,共消融6 min,消融过程中每隔30 s记录测温针的温度值,及射频治疗仪(Cooltip)自带的测量消融中心温度的测试值。同时记录实验动物在接受RFA治疗中的反应。治疗结束后,预热针道30 s,退出射频针及测温针。

图3 对兔椎体肿瘤模型行RFA及测温CT扫描,见射频电极针位于椎体(粗箭),电子测温针(细箭)置于同一椎体水平侧椎管测温
1.3 统计学方法
2 结果
8只动物建模全部成功,建模3周后可见穿刺接种椎体内骨质破坏。消融持续时间超过210 s后,动物出现不同程度躁动。实验结束后,2只动物尚未完全从麻醉状态苏醒即死亡。剩余6只均出现不同程度后肢瘫痪。
RFA过程中,实验动物椎体内FRA治疗中心温度及侧椎管温度随时间变化情况见表1。RFA开始后椎体内温度迅速上升到90℃以上,而侧椎管温度随消融时间延续,缓慢上升,消融持续时间超过3 min时侧椎管温度上升至42℃。经配对t检验,各时间点椎体及椎管内温度变化间差异有统计学意义(P<0.05)。
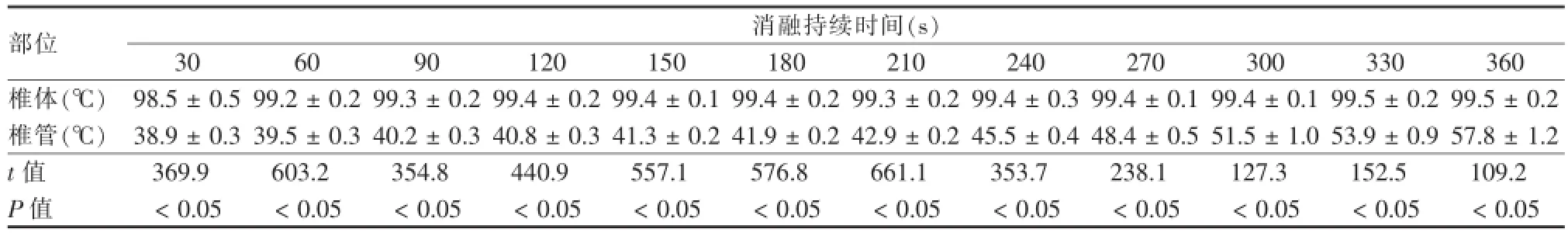
表1 椎体及侧椎管温度随RFA持续时间变化表
3 讨论
RFA是一种新兴的微创技术,治疗肿瘤的基本原理为热损毁方法。它在CT或DSA引导下,经皮将射频针穿刺至患者肿瘤部位,通过RFA仪测控元件和计算机控制,将频率为460~500 kHz电流通过射频电极传送到肿瘤组织内,利用肿瘤组织中的导电离子和极化分子按射频交变电流方向作快速变化,使肿瘤组织产生摩擦热;当温度达到60℃以上时,肿瘤组织产生不可逆的凝固坏死,坏死组织在患者体内将部分吸收,周围形成纤维包膜,包膜内聚集了中性DNA,它能增强患者的免疫功能,提高疗效。同时,肿瘤周围组织凝固坏死形成反应带,切断肿瘤血供并防止肿瘤转移[1-4]。
RFA治疗椎体病变时,最常见的并发症之一就是热损伤[3-4]。Nakatsuka等[3]报道一组17例接受RFA治疗的椎体肿瘤患者,其中4例发生神经损伤(24%),这4例在消融过程中都出现了下肢放射痛,虽然在患者感觉疼痛的时候,术者就立即停止了RFA治疗,但术后患者仍然发生了神经损伤。RFA在治疗椎体肿瘤时产生的持续高热是否会损伤脊髓及周围神经一直是广大学者关注的热点[3-6]。已有学者就正常动物及尸体标本进行了系列研究,以评估RFA时周围骨组织及椎管内温度变化情况[5-6]。但上述研究可能尚无法真正模拟临床实际应用情况。众所周知,温度的高低与局部组织血流与比热有直接的关系。无论是尸体标本还是正常活体组织,其局部血供和比热与椎体肿瘤截然不同。椎体肿瘤大多血供丰富,且椎体后缘存在流动的脑脊液,而流动的液体是热的良导体,这些都可以带走一定的热量。所以RFA时椎体肿瘤和椎管内的实际温度变化,可能与尸体标本或正常动物脊柱的温度变化截然不同。因此,只有建立真正的活体椎体肿瘤模型,才能较好地模拟RFA时椎体肿瘤及椎管内相应生理变化过程,从而更好地反应RFA时肿瘤内及椎管内的实际温度,进而为RFA治疗椎体肿瘤的治疗时间选择提供更多的理论支持。本研究以活体兔的椎体种植肿瘤为研究对象,能够较好地模拟临床利用RFA治疗椎体肿瘤的病理生理过程,因此得出的结论可能会更加符合临床实际应用情况。
既往实验研究证明,44℃作用于犬坐骨神经持续1 h,可造成严重损伤;小鼠脊髓的半数反应剂量为41.3℃持续1 h或45℃持续10.8 min;而犬脑组织的耐热限度为42℃持续45 min或43℃持续15min[8-10]。文献报道周围温度超过42℃,其热量可对脊神经或周围神经产生损害[8-10]。因此,临床进行热疗时应尽可能使涉及重要神经组织的温度控制在42℃以下,这为邻近和包裹神经组织肿瘤的RFA治疗,提供了相对安全的温度参数。本研究表明,当RFA时间超过3 min时,测椎管内温度已经超过了42℃,理论上,此时RFA产生的热量可能已对周围神经产生热损伤。而实验过程中,我们也观察到实验动物在RFA开始后3.5 min即出现了不同程度的躁动,可能也与周围神经热损伤引起的疼痛有关。而实验结束后,除2只未能完全苏醒即死亡外,其余6只皆发生了后肢瘫痪,也证实针对椎体肿瘤行RFA治疗时若超过一定治疗时间,是可能会引起周围神经损伤的,这一点与临床报道亦相符合。
尽管本研究采用活体椎体肿瘤模型研究RFA时椎体及椎管内的温度变化,模拟了椎体肿瘤丰富的血供,以及循环脑脊液可能对温度变化带来的影响。本研究存在一定的局限性,由于兔椎体相对较小,因此实验动物在同时接受射频电极和测温针置入的过程必然受到一定的创伤;同时由于需要观察一个相对较长的时间,才能全程记录消融过程中椎管及椎体肿瘤内温度变化的规律,因此对消融治疗的疗效及持续性,即消融多长时间能有效杀灭肿瘤细胞以及消融治疗后实验动物的临床表现如何,难以在本实验中予以观察。本研究旨在检测RFA治疗椎体肿瘤过程中,活体动物椎体肿瘤内及椎管内温度随消融时间变化的规律。在此基础上,可围绕此次研究得出的相对安全的消融时间及温度,进一步研究RFA治疗的有效性问题。
本研究结果表明,对于直径约1 cm的椎体肿瘤,RFA治疗时间超过3min,可能会对其周围的神经组织产生损伤。因此,在应用经皮穿刺RFA治疗椎体肿瘤时,应注意严格控制RFA治疗时间,或是适当降低RFA治疗时的最高温度设定,以避免产生神经热损伤等严重并发症。消融时间超过3 min即可能使椎管内温度超过安全值范围,这也提示在开展椎体肿瘤RFA时,是否可采取与其他实体肿瘤RFA治疗类似的、在接受消融组织周围注射生理盐水或气体的方法,以降低热损伤并发症[11],可能也是今后的研究方向之一。
[1]LencioniR,Crocetti L.Local-regional treatmentof hepatocellular carcinoma[J].Radiology,2012,262:43-58.
[2]王卫国,吴春根,程永德,等.射频消融术联合经皮椎体成形术治疗脊柱转移性肿瘤[J].介入放射学杂志,2009,18:362-366.
[3]Nakatsuka A,Yamakado K,Maeda M,et al.Radiofrequency ablation combined with bone cement injection for the treatment of bonemalignancies[J].JVasc Interv Radiol,2004,15:707-712.
[4]Munk PL,Murphy KJ,Gangi A,et al.Fire and ice:percutaneous ablative therapies and cement injection in management of metastatic disease of the spine[J].Semin Musculoskelet Radiol,2011,15:125-134.
[5]Nakatsuka A,Yamakado K,Takaki H,et al.Percutaneous radiofrequency ablation of painful spinal tumors adjacent to the spinal cord with real-time monitoring of spinal canal temperature:a prospective study[J].Cardiovasc Intervent Radiol,2009,32:70-75.
[6]Dupuy DE,Hong R,Oliver B,et al.Radiofrequency ablation of spinal tumors:temperature distribution in the spinal canal[J]. AJR,2000,175:1263-1266.
[7]Chen L,Ni R.An intravertebral tumormodel in rabbits created by transplantation of VX2carcinoma via percutaneous puncture technique under CT guidance[J].JVasc Interv Radiol,2010,21(suppl):S107-S108.
[8]Yamada T,Tateishi A,Cho S,etal.The effects of hyperthermia on the spinal cord[J].Spine(Phila Pa 1976),1992,17:1386-1391.
[9]Froese G,Das RM,Dunscombe PB.The sensitivity of the thoracolumbar spinal cord of the mouse to hyperthermia[J]. Radiat Res,1991,125:173-180.
[10]Letcher FS,Goldring S.The effectof radiofrequency current and heat on peripheral nerve action potential in the cat[J].J Neurosurg,1968,29:42-47.
[11]Toyoda H,Kumada T,Tada T,et al.Placement of a Sodium hyaluronate solution onto the liver surface as a supportive procedure for radiofrequency ablation of hepatocellular carcinomas located on the liver surface:a preliminary report[J]. JVasc Interv Radiol,2012,23:1639-1645.e1.
Temperature variation during percutaneous radiofrequency ab lation treatment for vertebral tumor: an in vivo study in experim ental rabbits
CHEN Long,NICai-fang,WANG Yan-wei,YANG Chao, WANG Gang-gang,ZHANG Shuai,XIAO Jian.Departmentof Interventional Radiology,the First Affiliated Hospital of Soochow University,Suzhou,Jiangsu Province 215006,China
XIAO Jian,E-mail:shhxiaoj@163.com
ObjectiveTo investigate the temperature variation within intra-spinal canal and intraspinal tumor during percutaneous radiofrequency ablation(RFA)procedure for vertebral tumor in experimental rabbits.M ethods Eight New Zealand white rabbits were transp lanted with VX2carcinoma in the lumbar vertebral body by percutaneous puncture inoculation technique under CT guidance in order to setup vertebral tumormodels.The eight vertebral tumormodels were treated with RFA under CT guidance.The temperature within the spinal canal and vertebral tumor of rabbitswasmeasured and recorded every 30 seconds during the RFA treatment.The results were statistically analyzed by paired sampled t text.Results The intra-tumor temperature rose to 90℃rapidly and remained stable during the whole RFA procedure,whereas the temperature in the spinal canal exceeded 42℃when treatment time was over three minutes during the procedure.Statistically significant difference in the temperature level during RFA existed between the spinal canal and the vertebral tumor(P<0.05).Conclusion The temperature in the vertebral tumor of rabbit can quickly reach to the therapeutic level during RFA.Prolonging operative time of RFA may hurt the nerve due to high temperature.(JIntervent Radiol,2014,23:427-430)
vertebral tumor;percutaneous radiofrequency ablation;temperature
R681.53
B
1008-794X(2014)-05-0427-04
2013-10-03)
(本文编辑:侯虹鲁)
国家自然科学基金资助项目(81101136);上海市自然科学基金基础研究项目(11ZR1448300);江苏省卫生厅国际交流支撑项目(2012020)
10.3969/j.issn.1008-794X.2014.05.015
215006苏州大学附属第一医院介入放射科(陈珑、倪才方、王艳伟、杨超、王刚刚、张帅);上海复旦大学附属中山医院骨科(肖剑)
肖剑E-mail:shhxiaoj@163.com
