猪圆环病毒1型阴性PK-15细胞的单细胞克隆与鉴定
2014-06-07宏王莉君
刘 宏王莉君
(1.新疆农业大学动物医学学院,新疆乌鲁木齐 830000;
2.新疆天康畜牧生物技术股份有限公司,新疆乌鲁木齐 830000)
猪圆环病毒1型阴性PK-15细胞的单细胞克隆与鉴定
刘 宏1王莉君2
(1.新疆农业大学动物医学学院,新疆乌鲁木齐 830000;
2.新疆天康畜牧生物技术股份有限公司,新疆乌鲁木齐 830000)
猪圆环病毒(porcine circovirus,PCV)属圆环病毒科圆环病毒属,是目前为止已知的最小的动物病毒之一。根据致病性、抗原性和核酸序列的差异,可将PCV分为PCV-1及PCV-2两个型。PCV1为非致病性的病毒,由德国学者Tischer于1974年从多株连续传代的PK-15细胞中最先发现。PCV2为致病性的病毒,来源于制备PK-15细胞的猪肾组织。猪圆环病毒对外界的抵抗力较强,对氯仿不敏感,不凝集猪、牛、羊、鸡等动物和人的红细胞。研究表明,该病毒可在RK-15细胞上生长,但不引起细胞病变,可在细胞浆内发现较多包涵体,少数感染的细胞还可能内含有核内包涵体。PCV不能在原代胎猪肾细胞、恒河猴肾细胞、BHK-21细胞上生长。
调查表明,PK-15细胞在被ATCC收藏后不久即检测出PCV1,然而确切的污染来源目前尚未查清,很有可能最初的猪肾细胞PK-2a就存在PCV1,或是其他的细胞培养物污染导致。所以,国内细胞供给实验室的PK-15细胞均有不同程度的PCV1污染。虽然PCV1无致病性,但由于其的存在会与PCV2发生相互污染,影响PCV2的传代增殖,而且不利于PCV2疫苗研发及抗体检测。综上,有必要筛选出一株无PCV1污染的PK-15细胞。
本研究拟采用有限稀释法筛选单细胞进行克隆,并经PCR检测,逐步筛选出一株猪圆环病毒1型阴性的PK-15细胞,用于PCV2的分离与传代培养研究。
1 材料与方法
1.1 材料
1.1.1 试剂 无支原体胎牛血清、DMEM培养基和胰蛋白酶均购自Hyclone公司公司产品;细胞培养板(nunce)、Taq DNA Polymerase、dNTP Mix、DL2000 DNA Marker、FITC-兔抗猪IgG(二抗)、氨苄青霉素、链霉素均购自宝信生物技术有限公司。PCV2阳性血清(一抗)购于武汉科前生物技术股份有限公司。
1.1.2 细胞株 PK-15细胞,购于武汉细胞培养中心。
1.1.3 引物 由于PK-15细胞起源于猪,因此细胞中存在多种猪源病毒污染。以下病毒的引物设计参见文献[16]。引物序列具体如下:
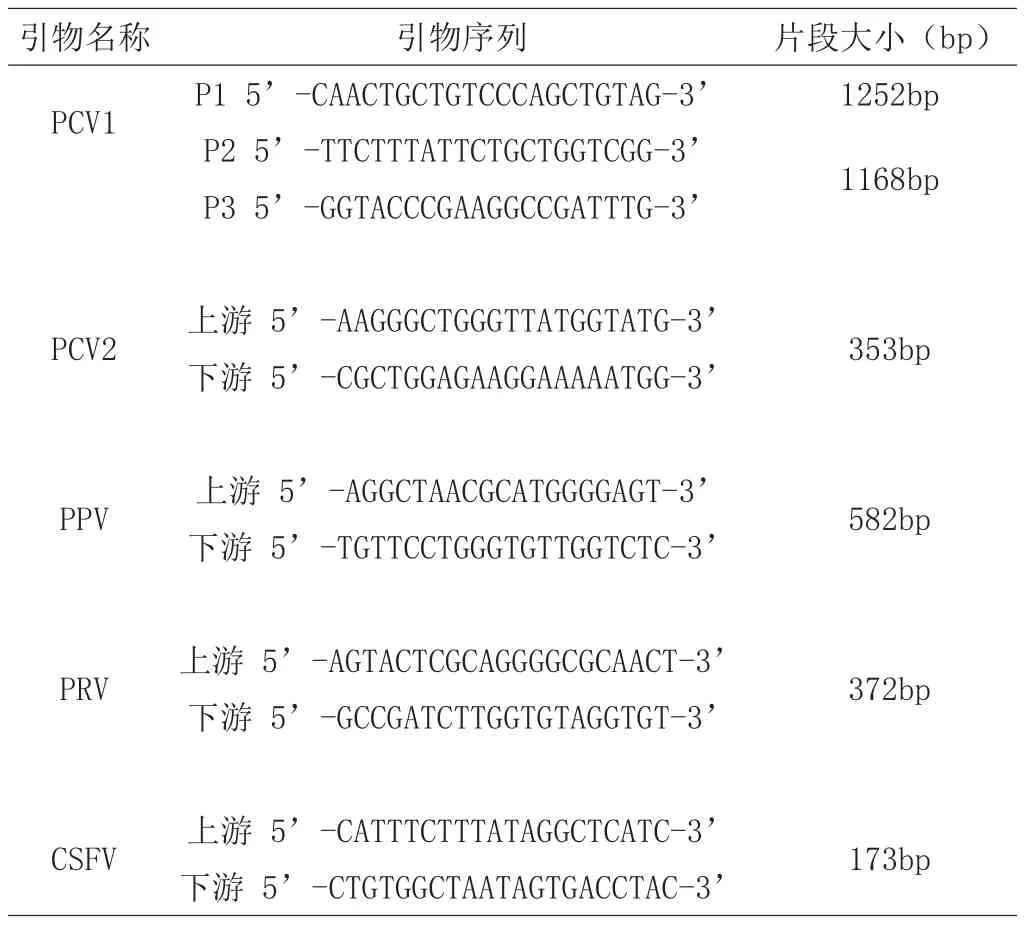
引物名称引物序列片段大小(bp) PCV1P1 5’-CAACTGCTGTCCCAGCTGTAG-3’1252bp P2 5’-TTCTTTATTCTGCTGGTCGG-3’1168bp P3 5’-GGTACCCGAAGGCCGATTTG-3’PCV2上游 5’-AAGGGCTGGGTTATGGTATG-3’353bp下游 5’-CGCTGGAGAAGGAAAAATGG-3’PPV上游 5’-AGGCTAACGCATGGGGAGT-3’582bp下游 5’-TGTTCCTGGGTGTTGGTCTC-3’PRV上游 5’-AGTACTCGCAGGGGCGCAACT-3’372bp下游 5’-GCCGATCTTGGTGTAGGTGT-3’CSFV上游 5’-CATTTCTTTATAGGCTCATC-3’173bp下游 5’-CTGTGGCTAATAGTGACCTAC-3’
以上引物由上海英骏生物技术有限公司合成。
1.2 方法
1.2.1 PK-15细胞单克隆
将PK-15细胞培养于细胞瓶形成细胞单层,用0.25%胰酶-EDTA消化,加入适量DMEM生长液(含2%犊牛血清和1%双抗)吹打,分散细胞成单个,加入DMEM生长液(含10%犊牛血清和1%双抗),做10倍梯度稀释至大约20个细胞/ml,取100μl铺于96孔板中,即2个细胞/孔。左右、上下摇晃后放置于37℃、5%CO2培养箱培养12h,次日镜下观察孔内细胞,单个细胞的孔做好标记。培养7~10d后,长成单细胞克隆时,用胰酶将其消化下来,再次稀释成单个细胞,做进一步的亚克隆,方法同上。经两次亚克隆后,挑选出单细胞克隆株进行扩大培养。细胞进行10次传代,每传代一次,进行一次PCV检测。最后,对PCR检测结果为阴性的细胞克隆株命名,并将其冻存备用。
1.2.2 PK-15中PCV1检测
应用半巢式PCR的方法检测PCV,采用25μl PCR反应体系。首先利用P1和P2引物进行第一步PCR扩增,反应条件为:94℃预变性4 min后,按94℃变性45s,64.5℃退火 60s,72℃延伸1 min,共30个循环,最后72℃延伸10 min。然后,利用P2和P3引物进行第二步PCR扩增,以第一次PCR产物作为模板,除退火温度为56℃之外,其他反应条件与第一步PCR相同。PCR产物进行琼脂糖凝胶电泳分析,观察结果。
1.2.3 PK-15中外源病毒检测
我们对克隆的PK-15细胞进行外源病毒检测。PCR反应体系和反应条件如下:PCR反应体系(25μl/管):10×PCR Buffer 2.5 μl、2.5mm/l dNTPs 2 μl、DNA模板、上下游引物各0.5 μl、Taq DNA polymerase 0.25 μl、ddH2O 17.25μl。各试剂加完后,吹打均匀,瞬时离心,进行如下反应条件:95℃预变性4 min;94℃变性45 s;(PPV 56.8℃、PRV 58℃、CFSV 55℃)退火45 s;72℃延伸2 min;共35个循环;最后72℃延伸10 min。PCR产物进行1%的琼脂糖凝胶电泳,观察PCR扩增结果。
2 结果
2.1 PK-15细胞单细胞克隆与PCV1检测
PK-15细胞(含PCV1)经第一次有限稀释法克隆,得到35个克隆。细胞形态良好,轮廓清晰,比克隆前的PK-15细胞在整体上要好(图1)。经半套式PCR检测,27个克隆为PCV1阳性,片段大小为1168 bp,8个克隆为PCV1阴性,没有任何条带(图2-2)。说明PK-15细胞确实受到PCV1的污染。将获得的8株细胞进行两次亚克隆后,最终PCR检测为PCV1阴性的单细胞克隆株命名为PK-15MC。
图1 PK15细胞克隆前与克隆后72 h
另外将第一次PCR检测为PCV1阴性的8个克隆株进行两次亚克隆,并进行扩大化培养10代、20代、30代。每代次的细胞均进行PCR检测,最终获得3个PCV1阴性细胞克隆株,分别命名为PK-15MC1、PK-15MC2、PK-15MC3。

图2 PK-15MC1克隆株的PCV1检测
2.2 PK-15中外源病毒检测
将最终获得的PCV阴性克隆株PK-15MC1、PK-15MC2、PK-15MC3进行外源病毒的检测。PCR鉴定结果如下:

图3 PK-15MC克隆株的PRV、PPV、CSFV检测
3 讨论
因为PCV不表现CPE,并可长期持续污染PK15细胞而不被发现。另外被PCV1污染的PK15细胞,在增殖培养PCV2时会出现病毒增殖速度变慢的现象。这给病毒的分离纯化工作带来极大不便。有研究证实,在快速生长的细胞中会有少数细胞未被PCV1感染,因此可以通过软琼脂法、显微操作法和有限稀释法等多种方法进行单细胞的筛选,获得无PCV存在的PK-15细胞。本研究选用相对简单的有限稀释法对PK-15细胞进行单克隆筛选。
半套式PCR是用第一次PCR扩增产物作为第二次PCR扩增的模板,并且因为第二次PCR反应中的一个引物缩进,会使靶DNA序列得到有效的选择性扩增,大大提高了扩增的特异性和灵敏性。本试验中在第一次克隆得到35个克隆孔中,PCR检测有8个克隆孔为阴性,第二次亚克隆后再进行PCR检测,仅有3个克隆孔为阴性。这种在阴性克隆中又出现PCV1阳性的原因,可能与病毒含量低半套式PCR检测不出来有关。因此,本人将细胞扩大培养后10代、20代、30代,在进行PCV1检测,此时病毒核酸数量远远超过检测PCR下限,有利于检测出病毒核酸来。这样才可以获得稳定的不存在PCV1的PK-15细胞。本研究将获得的3株PCV1阴性的PK-15细胞,传代30代次后进行PCV1、PPV、PRV、CSFV等外源病毒检测,检测结果均为阴性。PK-15阴性细胞的获得为临床分离和鉴定PCV和PCV相关疫苗研制等工作提供了良好的物质保障。
