黄海春季和秋季中华哲水蚤脂类含量及组成分析
2014-06-01王延清李超伦刘梦坛金鑫王晓东孙永坤
王延清,李超伦,刘梦坛,金鑫,王晓东,孙永坤
(1.中国科学院海洋研究所海洋生态与环境重点实验室,山东青岛 266071;2.中国科学院大学,北京 100049;3.中国科学院胶州湾海洋生态系统国家野外科学观测研究站,山东青岛 266071)
黄海春季和秋季中华哲水蚤脂类含量及组成分析
王延清1,2,李超伦1*,刘梦坛3,金鑫1,王晓东1,2,孙永坤1,2
(1.中国科学院海洋研究所海洋生态与环境重点实验室,山东青岛 266071;2.中国科学院大学,北京 100049;3.中国科学院胶州湾海洋生态系统国家野外科学观测研究站,山东青岛 266071)
脂类物质在哲水蚤的休眠、繁殖以及个体发育过程中发挥着重要作用,通过分析2010年11月(秋季)和2011年4月(春季)黄海中华哲水蚤Calanus sinicus的脂类组成,对脂类各组分的生理功能进行了初步探讨。结果表明,春季、秋季中华哲水蚤雌体脂类平均含量占干质量的10.6%和12%,C5期个体脂类含量偏高,占到干质量的17%。中华哲水蚤所含脂类主要由蜡脂和磷脂组成,两种脂类约占总脂的90%,三酰甘油含量约占总脂的6%。结合种群结构对脂类的生理作用进行了初步探讨,发现:(1)蜡脂作为主要的能量储存方式,其含量变化反映出不同发育期、不同季节中华哲水蚤的能量需求变化;(2)磷脂作为结构性脂类在中华哲水蚤个体生长与生殖过程中具有重要作用;(3)三脂酰甘油在中华哲水蚤中的含量不高,但是可能在脂类转化利用过程中发挥作用。
中华哲水蚤;黄海;脂类;蜡脂;磷脂;三脂酰甘油
1 引言
脂类作为构成生物有机体的大分子之一,具有十分重要的生理功能。在浮游动物生长代谢过程中,尤其是环境饵料缺乏、雌体繁殖、早期发育和休眠等关键时期,脂类物质都扮演着重要的角色[1-4]。
脂类在桡足类繁殖和休眠过程中的作用一直是研究的热点。有些桡足类在饵料缺乏的冬季完全依靠存储的脂类进行繁殖,使其幼体开口索饵期与早春浮游植物水华暴发同步,保证其种群迅速补充[2,5],而且饵料中含有的必需脂肪酸对其繁殖的影响也备受关注[4,6-8]。同时,脂类不仅是休眠过程中的能量来源,而且在使其悬浮在特定水层以及提供休眠起始和终止信号方面也起着关键的作用[9-12]。所以,研究浮游动物脂类物质,对于深入理解浮游动物生活史策略具有重要意义。
对自然海区浮游动物脂类物质的研究,主要集中在高纬度的极地海域[4,13],极区浮游动物(主要是桡足类和磷虾类)的显著特点是,利用夏季短时间的浮游植物水华合成脂类,将其作为饵料匮乏季节代谢的主要能量支持;低纬度热带海域的浮游动物代谢速率快、周转率高,体内脂类含量较低[14];中纬度各海区存在差异,在陆架区和上升流区等海域,桡足类和磷虾也会在春季浮游植物水华期间储存大量的脂类,作为饵料缺乏季节或者休眠期间的主要能量来源[15-16]。
中华哲水蚤是中国近海浮游动物优势种,在黄海春季浮游动物高峰期,中华哲水蚤可以占到浮游生物量的80%甚至更多[17],在黄海生态系统动态变化过程中起着重要的调控作用。但是迄今对中华哲水蚤脂类物质的组成及其生态功能的研究较少,其中,孙松等[18]通过测量油囊体积法对中华哲水蚤油脂储存进行了研究,认为中华哲水蚤油囊内储存的脂类是种群度夏过程中的主要能量来源;刘梦坛等[19-20]对中华哲水蚤脂肪酸标记进行了研究,通过对比中华哲水蚤与饵料环境间的脂肪酸组成差异,从脂肪酸角度研究了中华哲水蚤的食性。本文对春、秋季黄海中华哲水蚤的主要脂类物质进行分析,并且对主要组成脂类的生理功能进行了初步探讨,以期为从脂类角度研究中华哲水蚤的生活史策略提供基础资料。
2 材料方法
2.1 环境参数及生物样品采集
于2010年11月和2011年4月乘“科学三号”科研考察船,在南黄海进行中华哲水蚤样品采集工作,采样站位见图1。水文数据由SBE911型CTD同步测定,浮游动物样品采用标准浮游动物大网(网口直径0.8 m,网孔直径500μm)采集,从距海底4 m处垂直拖网至表层。用于种群鉴定的样品保存于含有5%甲醛的海水溶液,回实验室后用OLYMPUS SZ61型解剖镜,分期(C4、C5、雌体和雄体)计数。每个站位分发育期挑取50~100只中华哲水蚤个体用于脂类分析,挑取的个体过滤于GF/F膜(膜预先于450℃烧制4 h,以除去膜上的有机质),再用超纯水快速冲洗,之后装入冻存管液氮保存[21]。
2.2 脂类提取
首先,将液氮保存的样品用真空冷冻干燥机冷冻干燥48 h,然后,用分析天平(±100μg)称量虫体干质量。再参照Folch等[22]的方法对已称质量的虫体进行脂类提取,首先,用二氯甲烷∶甲醇(2∶1,V/V)提取3次,合并有机相,然后,用0.88%的KCl溶液洗涤萃取液,将萃取液进行低速离心(2 000 r/min,5 min)分层,分离得到下层有机相,最后,用氮气吹干分离得到的有机相,用分析天平(±100μg)称量,得到总脂质量。称量过的总脂用二氯甲烷重溶,充氮气保存于-20℃,备测。
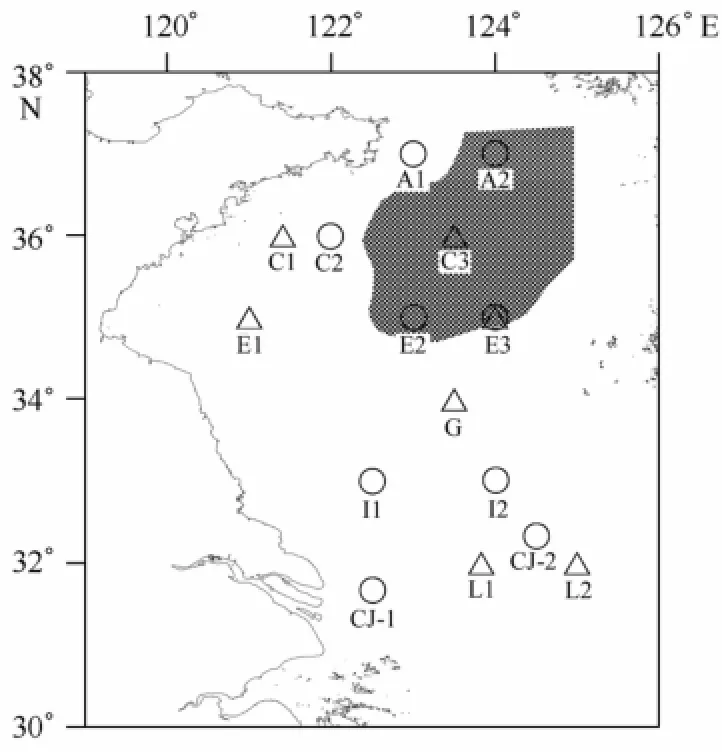
图1 采样站位
2.3 脂类分析
用IATROSCAN MK-6S型TLC/FID棒状薄层色谱仪进行脂类组成分析[23-24],每根薄层棒点样1 μL,首先用苯∶氯仿∶乙酸=50∶20∶0.7(V/V)展开7.5 cm,然后用正己烷∶苯=1∶1(V/V)二次展开至9.5 cm,于65℃烘干2 min,上机扫描。磷脂标样选取1,2-二油酰基卵磷脂(Sigma公司),蜡质选取山嵛酸亚油醇酯(Nu-Chek公司),三酰甘油选取混标(Supelco公司)。
3 结果与分析
3.1 水文环境
如图2所示,2010年11月(秋季)航次期间,表层水温变化范围为12~18℃,由北向南逐渐升高;根据翁学传和王从敏[25]的方法,将底层温度10℃等温线作为冷水团的分界线,可以看出冷水团在南黄海依然存在,并且主要分布在35°N,123°E以东的黄海海槽中(图1阴影区域),A2、E2、E3站位处于冷水团影响范围之内。2011年4月(春季)航次期间,表底水温较为一致,垂直混合较好,水温由北向南逐渐升高,变化范围为7~12℃。
3.2 中华哲水蚤水平分布
2010年秋季调查中,中华哲水蚤的分布受冷水团影响明显(见图3a)。冷水团内中华哲水蚤丰度显著高于冷水团之外,其中位于冷水团之内站位的平均丰度为121 ind/m3,位于冷水团之外的山东近岸和南黄海南部站位平均为17 ind/m3。另外,秋季各站位中华哲水蚤成体占有比例较高,平均占到63.2%,虽然各站位都有桡足幼体C4、C5期个体出现,但是所占比例较低,其中C4期个体平均占10.5%,C5期个体平均占26.3%。在2011年春季调查中,如图3b所示,除E1站位外,南黄海其余调查站位中华哲水蚤丰度差别不明显,各站位平均丰度为86 ind/m3,C4期个体和成体占有比例相比秋季变化明显,其中C4期个体占有比例相比秋季明显升高,平均占到24.8%,而成体占有比例则比秋季低,为51.4%,C5期个体占有比例为23.8%,与秋季差别不大。

图2 2010年11月表层温度(℃)(a),底层温度(℃)(b);2011年4月表层温度(℃)(c),底层温度(℃)(d)
3.3 干质量及总脂含量
南黄海春秋两季的中华哲水蚤干质量差别明显(见图4),雌体干重春季高于秋季(p<0.05)。其中,秋季雌体个体干质量范围为179.1~221.1μg,平均为193.6μg,春季雌体个体干质量范围为155.8~342.7μg,平均为247.0μg/ind。另外,未成体C5期中华哲水蚤个体干质量低于雌体干质量,C5期个体干质量范围为89.5~181.1μg,平均为134.8μg。
虽然中华哲水蚤雌体干质量在春季与秋季有明显差别,但是在总脂含量上,如图4所示,两者差异并不显著(p>0.05)。雌体春季和秋季总脂含量均值分别为103.7μg/mg和119.3μg/mg,总脂占干质量的百分比分别是10.6%和12.0%。然而,C5期个体总脂含量却高于雌体,其总脂含量均值为165.7μg/mg,总脂占干重的百分比为17.8%,但是由于C5期个体的干质量小,每个C5期个体含有的总脂量与雌体无显著性差异(p>0.05)。
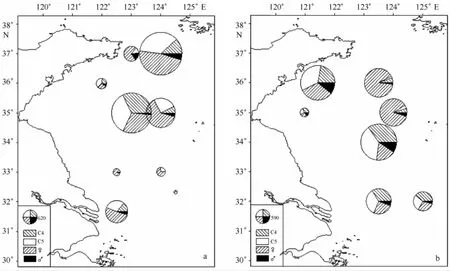
图3 中华哲水蚤丰度(ind/m3)和C4期桡足幼体至成体组成比例的水平分布
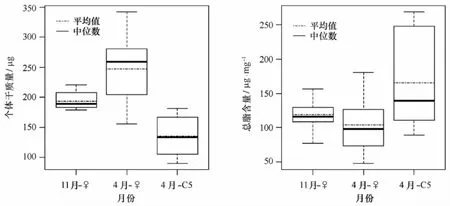
图4 中华哲水蚤个体干质量(μg)及总脂含量(μg/mg)
3.4 脂类组成
脂类含量如图5所示,通过计算各脂类成分在总脂中的百分比发现,中华哲水蚤体内脂类主要由磷脂和蜡脂构成,二者之和占总脂质量百分比可以达到90%;另外,三酰甘油也是主要的组成部分,约占6%。除此之外,中华哲水蚤体内还包括游离脂肪酸和固醇类脂类,但是由于它们含量较低,并且所用仪器不能准确检测,所以本文未作进一步分析。
中华哲水蚤体内蜡脂含量存在季节、地域以及发育期差异。首先,春季雌体蜡脂含量均值为17.0μg/mg显著低于秋季雌体的47.0μg/mg(p<0.05);其次,秋季调查中,冷水团内部A2、E2、E3站位蜡脂含量均值为64.5μg/mg,明显高于其余站位的均值38.2μg/mg(见图6)。春季调查中,大部分站位的雌体蜡脂含量都较低,平均为7.6μg/mg(除去C1站位),只在山东近岸C1站出现73.2μg/mg的高值,而C5期个体蜡脂含量在C1和G两个站位分别出现198.5和155.8μg/mg的高值;最后,从不同发育期来看,春季C5期个体蜡脂含量均值为75.1μg/mg,与秋季雌体的蜡脂含量没有明显差别(p>0.05),但是高于春季雌体(p<0.05)。另外,秋季雌体蜡脂占总脂质量的39.9%,春季雌体和C5期个体占总脂质量分别为15.5%和49.5%。
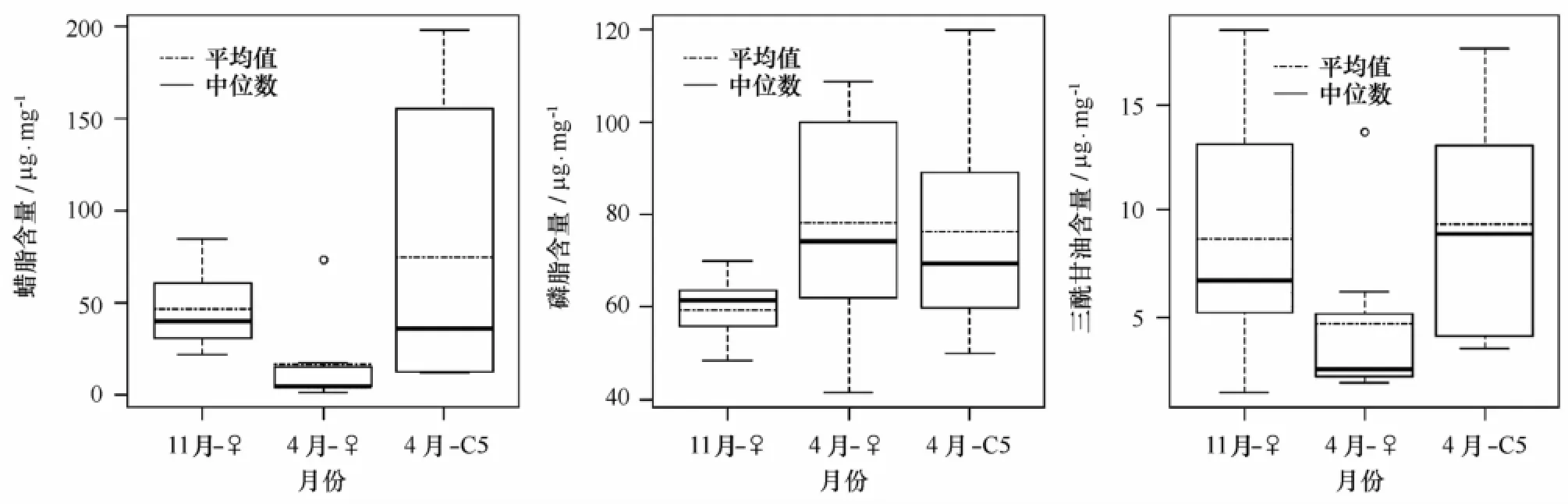
图5 中华哲水蚤秋季雌体(2010年11月)、春季雌体和C5期个体(2011年4月)的蜡脂、磷脂和三酰甘油含量
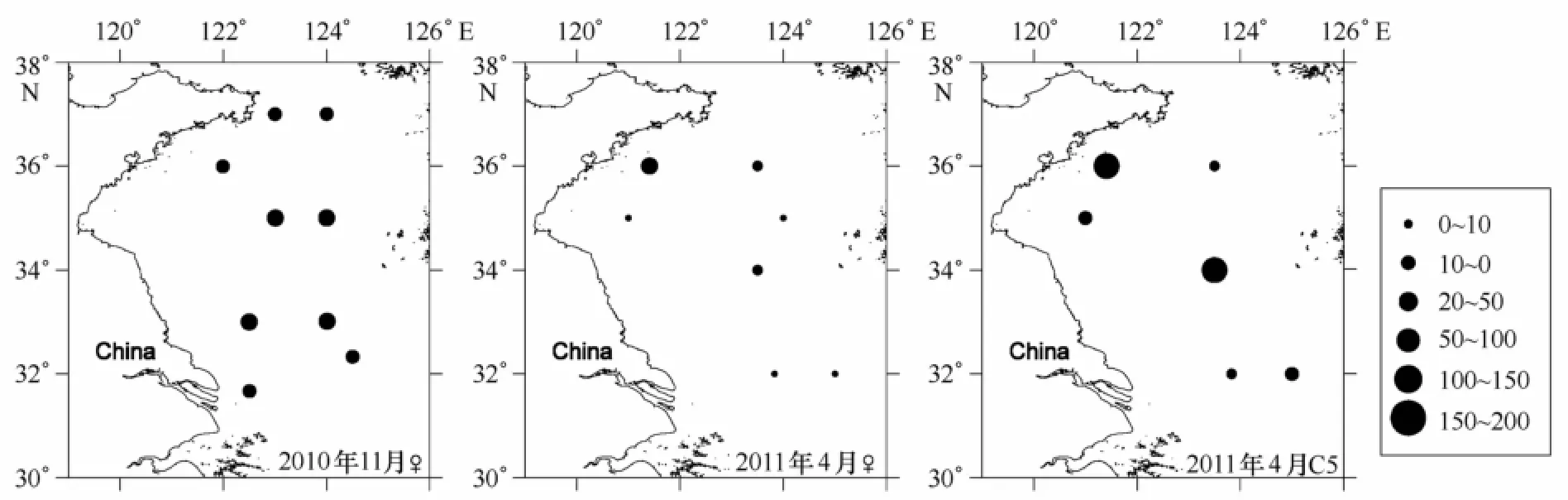
图6 黄海中华哲水蚤蜡脂含量(μg/mg)
春季雌体和C5期个体的磷脂含量较高,分别为74.1μg/mg和76.2μg/mg,秋季雌体磷脂含量偏低,平均为59.2μg/mg,春季雌体个体磷脂含量明显高于秋季雌体(p<0.05)。从磷脂占总脂含量来看,春季雌体为75.7%,明显高于秋季雌体和春季C5期个体的49.3%和41.97%,说明春季雌体含有大量的磷脂。另外,磷脂含量没有明显的地域差异。
三酰甘油在中华哲水蚤体内的含量较少,在各季节及发育期间无显著差异(p>0.05)。秋季雌体、春季雌体和C5期个体三酰甘油含量分别为:8.7、4.7和9.3μg/mg,占总脂比例分别为:7.1%、5.1%和5.6%。
4 讨论
4.1 中华哲水蚤生长状态
本研究中,秋季中华哲水蚤处于休眠末期。首先,从水文环境结果来看,秋季航次期间,黄海冷水团分布范围缩减,说明此时黄海冷水团处于消退期[26]。由于冷水团是中华哲水蚤种群的度夏场所[27-29],其衰退势必会对中华哲水蚤的度夏状态产生影响,导致其结束休眠。其次,从C5期个体在种群中占有比例来看,冷水团内站位(A2、E2、E3),C5期个体在种群中占有比例平均为36%(见图3a),明显低于夏季冷水团内度夏种群中C5期个体的比例69%[30],并且成体在种群中占有比例上升,说明调查期间中华哲水蚤种群已经开始结束休眠[18]。
中华哲水蚤春季通常处于繁殖活跃期。陈清潮[17]认为黄海中华哲水蚤4月份开始大规模产卵,Wang等[31]通过分析黄海春秋两季的产卵率和孵化率,认为春季是中华哲水蚤繁殖、补充的关键时期。在本研究的春季航次中,中华哲水蚤C4期所占比例相对较高(24.7%),说明种群处于种群补充的活跃期,与历史资料符合。
4.2 中华哲水蚤脂类含量
已有研究显示,中纬度海域哲水蚤C5期个体和雌体的总脂重量占干质量比例在8%~26%间[32-33],脂类含量明显低于高纬度海域的哲水蚤种类,如北冰洋的Calanus hyperboreus和Calanus glacialis总脂重量可以达到干质量比例的47%~70%[34—35]。本文数据显示,秋季中华哲水蚤雌体总脂质量占干质量百分比为12.0%,春季雌体和C5期个体分别为10.6%和17.8%,与已有的中纬度海区脂类研究结果范围相似,同时也明显低于高纬度海区哲水蚤的脂类含量。但是,春秋两个季节的中华哲水蚤脂类含量并没有达到全年最高值,6月份南黄海中华哲水蚤种群中的C5期个体的油脂含量可以达到84μg/ind,占干质量比例在45%左右(作者未发表数据)。同时,以往研究也表明,中华哲水蚤C5期个体在6月份油囊体积为全年最大,可以达到前体部的30%[18]。
4.3 脂类组成及其生理功能
海洋浮游动物的脂类物质主要以蜡脂、三酰甘油、磷脂和烷醚酰基甘油等4种形式储存[4]。其中,飞马哲水蚤的脂类物质主要由蜡脂和磷脂组成,两种脂类含量占总脂的96%[36],此外还含有少量的三酰甘油。中华哲水蚤的脂类组成与飞马哲水蚤类似,也主要由蜡脂和磷脂构成(见图5),两种脂类占到总脂质量的90%左右,另外,中华哲水蚤的三酰甘油含量也较少,约占总脂的6%。
蜡脂作为中华哲水蚤能量储存的主要形式,其存储量与中华哲水蚤所处的不同发育期、季节和地域有关。已有研究表明,哲水蚤在C5期蜡脂含量达到最高,雌体蜡脂含量降低[37-38],对比本研究春季中华哲水蚤C5期个体和雌体的蜡脂含量,同样证实C5期个体的蜡脂含量要明显高于雌体(见图5),与已有研究相符。首先,上述结果反映出不同中华哲水蚤发育期能量收支策略的差异,蜡脂的主要功能是作为桡足类生长发育所需的能量储存,因此幼体期的中华哲水蚤储存大量蜡脂用于满足进一步生长发育的能量需求;而雌体基本停止生长,其脂类物质将用于繁殖需求。所以,处于春季繁殖活跃期的中华哲水蚤雌体将更多的能量用于产卵而不是以蜡脂的形式存储,而春季C5期个体面临蜕皮发育以及生殖腺发育等需要大量能量的阶段,所以需要积累大量蜡脂作为进一步发育所需的能量储存。另外,虽然秋季中华哲水蚤雌体的蜡脂含量要明显高于春季,平均值接近于春季C5期个体的蜡脂含量,但是作者认为这并不意味着秋季雌体合成储存蜡脂。根据以往研究结果,秋季雌体与度夏C5期个体为同一世代[39],秋季航次期间采集的雌体主要是度夏C5期种群刚刚发育而来,由于度夏C5期种群积累大量脂类作为度夏期间的能量储存[18],因此本研究中秋季雌体其体内蜡脂是刚刚完成度夏的C5期个体所含蜡脂的残余。从秋季雌体蜡脂含量的水平分布差异也可以看出,冷水团内部雌体的蜡脂高于周边海域(见图6)。
本次调查中,中华哲水蚤雌体的磷脂含量在春季较高,体现出磷脂作为结构性脂类在浮游动物个体发育、生长及生殖过程中具有重要作用[40-41]。Lee等[4]认为哲水蚤雌体会把储存的蜡脂或三酰甘油中的一部分转换为磷脂,进而再利用磷脂合成卵黄磷蛋白,存储于卵细胞中。如上所述,春季为黄海中华哲水蚤繁殖活跃期,那么处在活跃繁殖期的雌体对磷脂的需求势必会增加,这与春季雌体磷脂较高含量相一致。秋季雌体虽然开始恢复繁殖,但是其繁殖活动并没有春季活跃[31],所以此时雌体的磷脂含量低于春季。另外,从不同发育期中华哲水蚤个体磷脂含量的变化也可以看出,磷脂在个体发育中也发挥着重要作用,磷脂含量在由C5期个体到雌体的发育过程中不断增加,C5期个体磷脂净含量及其在总脂中的百分含量均低于雌体,这可能是由于雌体的性腺发育成熟开始积累磷脂准备繁殖所致。
三酰甘油在哲水蚤中的含量一般较低。本研究中,中华哲水蚤三酰甘油占总脂重量的百分比处于33°~88°N的9种哲水蚤2%~17%的含量范围内[4],说明中华哲水蚤也不大量积累三酰甘油。首先,Lee等[4]认为三酰甘油在蜡脂的合成中发挥作用,他们认为蜡质合成经过两个步骤,首先是合成三酰甘油,然后再将三酰甘油转化为存储于油囊的蜡脂,在大部分的桡足类中,三酰甘油本身不作为长期存储形式,也不大量积累。另外,已有的饥饿培养实验表明,三酰甘油还发挥着短期能源储备的功能,由于三酰甘油的利用过程比蜡脂简单,在饥饿胁迫下作为一种机动能源最先被利用[14,42-43]。然而,本文研究中的各月份三酰甘油含量并无明显差异(p>0.05),对于三酰甘油在中华哲水蚤种群中的功能作用,还需要进一步的研究。
5 结论
本研究结果表明:脂类在中华哲水蚤中有较高的含量,主要由蜡脂、磷脂和三酰甘油构成,其中蜡脂和磷脂含量可占总脂含量的90%,三酰甘油含量较少,约占6%。中华哲水蚤体内蜡脂在不同的发育期、季节和地域表现出不同的含量,以应对不同的能量储存和代谢需求,而磷脂主要与中华哲水蚤的繁殖有关。对中华哲水蚤脂类含量及组成的研究,为深入了解中华哲水蚤生活史策略提供基础资料。
致谢:感谢中国科学院海洋研究所中国近海开放共享航次对本研究海上调查与取样工作的支持,感谢中国科学院海洋研究所于非研究员提供CTD资料!
[1]Hagen W,Auel H.Seasonal adaptations and the role of lipids in oceanic zooplankton[J].Zoology,2001,104(3/4):313-326.
[2]Michael T A,Michael T B,Martin J K.Lipids in aquatic ecosystem[M]//Kattner G,Hagen W.Lipids in marine copepods:latitudinal characteristics and perspective to global warming.New York:Springer,2009:257-280.
[3]Kattner G,Hagen W,Lee R F,et al.Perspectives on marine zooplankton lipids[J].Canadian Journal of Fisheries and Aquatic Sciences,2007,64(11):1628-1639.
[4]Lee R F,Hagen W,Kattner G.Lipid storage in marine zooplankton[J].Marine Ecology Progress Series,2006,307:273-306.
[5]Falk-Petersen S,Hagen W,Kattner G,et al.Lipids,trophic relationships,and biodiversity in Arctic and Antarctic krill[J].Canadian Journal of Fisheries and Aquatic Sciences,2000,57(1):178-191.
[6]Chen M R,Liu H B,Chen B Z.Effects of dietary essential fatty acids on reproduction rates of a subtropical calanoid copepod,Acartia erythraea[J].Marine Ecology Progress Series,2012,455:95-110.
[7]Koski M,Yebra L,Dutz J,et al.The effect of egg versus seston quality on hatching success,naupliar metabolism and survival of Calanus finmarchicus in mesocosms dominated by Phaeocystis and diatoms[J].Marine Biology,2012,159(3):1-18.
[8]Pond D,Harris R,Head R,et al.Environmental and nutritional factors determining seasonal variability in the fecundity and egg viability of Calanus helgolandicus in coastal waters off Plymouth,UK[J].Marine Ecology Progress Series,1996,143(1):45-63.
[9]Campbell R,Dower J.Role of lipids in the maintenance of neutral buoyancy by zooplankton[J].Marine Ecology Progress Series,2003,263:93-99.
[10]Clark K A J,Brierley A S,Pond D W.Composition of wax esters is linked to diapause behavior of Calanus finmarchicus in a sea loch environment[J].Limnology and Oceanography,2012,57(1):65-75.
[11]Pond D W.The physical properties of lipids and their role in controlling the distribution of zooplankton in the oceans[J].Journal of Plankton Research,2012,34(6):443-453.
[12]Pond D W,Tarling G A.Phase transitions of wax esters adjust buoyancy in diapausing Calanoides acutus[J].Limnology and Oceanography,2011,56(4):1310-1318.
[13]Falk-Petersen S,Mayzaud P,Kattner G,et al.Lipids and life strategy of Arctic Calanus[J].Marine Biology Research,2009,5(1):18-39.
[14]Lee R F,Hirota J,Barnett A M.Distribution and importance of wax esters in marine copepods and other zooplankton[J].Deep-Sea Research,1971,18(12):1147-1165.
[15]Miller C B,Crain J A,Morgan C A.Oil storage variability in Calanus finmarchicus[J].ICES Journal of Marine Science:Journal du Conseil,2000,57(6):1786-1799.
[16]Thorisson K.How are the vertical migrations of copepods controlled?[J].Journal of Experimental Marine Biology and Ecology,2006,329(1):86-100.
[17]陈清潮.中华哲水蚤的繁殖、性比率和个体大小的研究[J].海洋与湖沼,1964,6(3):272-288.
[18]孙松,王世伟,李超伦.黄海中华哲水蚤C5发育期油脂积累初步研究[J].海洋与湖沼,2011,42(2):165-169.
[19]Liu M T,Li C L,Sun S.Seasonal variation in fatty acid composition of seston and the copepod Calanussinicus(Brodsky,1962)in Jiaozhou Bay and its trophic implications[J].Oceanology and Limnology Sinica,2011,29(6):1164-1173.
[20]刘梦坛,李超伦,孙松.脂肪酸对中华哲水蚤摄食两种海洋微藻的指示作用[J].生态学报,2011,31(4):933-942.
[21]Ohman M D.Freezing and storage of copepod samples for the analysis of lipids[J].Marine Ecology Progress Series,1996,130:295-298.
[22]Folch J,Lees M,Sloane-Stanley G.A simple method for the isolation and purification of total lipids from animal tissues[J].Journal of Biological Chemistry,1957,226(1):497-509.
[23]Hopkins C,Seiring J,Nyholmen O.Ecological energetics from total lipid and total protein:fact and artifact using a gravimetric method for lipidand a biuret method for protein[J].Oceanography and Marine Biology,1984,22:211-261.
[24]Ohman M D.On the determination of zooplankton lipid content and the occurrence of gelatinous copepods[J].Journal of Plankton Research,1997,19(9):1235-1250.
[25]翁学传,王从敏.黄海冷水团边界及温盐范围的确定[C]//中国湖沼学会水文气象学术会议(1980)论文集.北京:科学出版社,1982:61-70.
[26]于非,张志欣,刁新源,等.黄海冷水团演变过程及其与邻近水团关系的分析[J].海洋学报,2006,28(5):26-34.
[27]Sun S.Over-summering strategy of Calanus sinicus[R/OL].GLOBEC Int Newsl,2005,11:34.[2012-10-26]http://www.igbp-cnc.org.cn/UserFiles/IGBP-Sun%20Song.pdf
[28]Wang R,Zuo T.The Yellow Sea Warm Current and the Yellow Sea Cold Bottom Water,their impact on the distribution of zooplankton in the southern Yellow Sea[J].Journal korean society of oceamography,2004,39(1):1-13.
[29]Zhang G T,Sun S,Yang B.Summer reproduction of the planktonic copepod Calanussinicus in the Yellow Sea:influences of high surface temperature and cold bottom water[J].Journal of Plankton Research,2007,29(2):179-186.
[30]Pu X M,Sun S,Yang B,et al.Life history strategies of Calanussinicus in the southern Yellow Sea in summer[J].Journal of Plankton Research,2004,26(9):1059-1068.
[31]Wang S W,Li C L,Sun S,et al.Spring and autumn reproduction of Calanus sinicus in the Yellow Sea[J].Marine Ecology Progress Series,2009,379:123-133.
[32]Hakanson J L.The long and short term feeding condition in field-caught Calanus pacificus,as determined from the lipid content[J].Limnology and Oceanography,1984,29(4):794-804.
[33]Lee R F,Hirota J.Wax esters in tropical zooplankton and nekton and the geographical distribution of wax esters in marine copepods[J].Limnology and Oceanography,1973,18(2):227-239.
[34]Auel H,Klages M,Werner I.Respiration and lipid content of the Arctic copepod Calanus hyperboreus overwintering 1 m above the seafloor at 2 300 m water depth in the Fram Strait[J].Marine Biology,2003,143(2):275-282.
[35]Scott C L,Kwasniewski S,Falk-Petersen S,et al.Lipids and life strategies of Calanus finmarchicus,Calanus glacialis and Calanus hyperboreus in late autumn,Kongsfjorden,Svalbard[J].Polar Biology,2000,23(7):510-516.
[36]Diel S,Tande K.Does the spawning of Calanus finmarchicus in high latitudes follow a reproducible pattern?[J].Marine Biology,1992,113(1):21-31.
[37]Kattner G,Graeve M,Hagen W.Ontogenetic and seasonal changes in lipid and fatty acid alcohol compositions of the dominant Antarctic copepods Calanus propinquus,Calanoides acutus and Rhincalanus gigas[J].Marine Biology,1994,118(4):637-644.
[38]Tande K,Henderson R.Lipid composition of copepodite stages and adult females of Calanusglacialis in Arctic waters of the Barents Sea[J].Polar Biology,1988,8(5):333-339.
[39]王世伟.黄海中华哲水蚤繁殖、种群补充与生活史研究[D].青岛:中国科学院海洋研究所,2009.
[40]Lee R F,Nevenzel J C,Lewis A.Lipid changes during life cycle of marine copepod,Euchaeta japonica marukawa[J].Lipids,1974,9(11):891-898.
[41]Saito H,Tsuda A.Egg production and early development of the subarctic copepods Neocalanuscristatus,N.plumchrus and N.flemingeri[J].Deep-Sea Research Part I:Oceanographic Research Papers,2000,47(11):2141-2158.
[42]Lee R F,Barnes A T.Lipidsin the mesopelagic copepod,Gaussia princeps.Wax ester utilization during starvation[J].Comparative Biochemistry and Physiology Part B:Comparative Biochemistry,1975,52(2):265-268.
[43]Sargent J,Gatten R,Corner E,et al.On the nutrition and metabolism of zooplankton.XI.Lipids in Calanus helgolandicus grazing Riddulphia sinensis[J].Journal of the Marine Biological Association of the United Kingdom,1977,57(2):525-533.
Lipid content and composition of Calanus sinicus in the Yellow Sea in spring and autumn
Wang Yanqing1,2,Li Chaolun1,Liu Mengtan3,Jin Xin1,Wang Xiaodong1,2,Sun Yongkun1,2
(1.Key Laboratory of Marine Ecology and Environmental Sciences,Institute of Oceanology,Chinese Academy of Sciences,Qingdao 266071,China;2.University of Chinese Academy of Sciences,Beijing 100049,China;3.Jiaozhou Bay Ecosystem Research Station,Chinese Academy of Sciences,Qingdao 266071,China)
Lipid plays an important rolein reproduction,food scarcity and diapause of zooplankton.The present re-search studied the role of lipids in Calanussinicus,and samples were collected from the Southern Yellow Sea in autumn(November,2010)and spring(April,2011).The results show that the total lipid content of female C.sinicus was about 10.6%-12%of dry body mass,while C5 stage in spring had a higher percentage,about 17%of dry mass.The major components in lipid classes were wax ester(WE)and phospholipid(PL),and they together contributed about 90%to total lipid,while triglyceride(TAG)accounted for only 6%.The role of different lipid classes was discussed as follows:(1)Wax ester served as an important energy deposit.The fluctuated WE content of C.sinicus suggested the different strategies in energy needs and utilization of different development stages and seasons.(2)The coincidence of active reproduction and high content of PLin femaleindicated that PL playsan important role in the egg production of C.sinicus.(3)The composition of TAG was relatively lower than that of WE and PL in C.sinicus,but it might work in the transformation of different lipid classes.
Calanus sinicus;southern Yellow Sea;lipids;wax ester;phospholipid;triglyceride
S922.9+2;Q95
A
0253-4193(2014)02-0099-09
2012-10-27;
2013-03-21。
国家自然科学面上基金(41076099;41121064);国家重点基础研究发展规划(973)项目(2011CB403604)。作者简介:王延清(1985—),男,山东省泰安市人,博士生,主要研究方向是海洋生态学。E-mail:wang-yq@live.com *通信作者:李超伦(1969—),男,山东省青岛市人,研究员,博士生导师,主要从事海洋生态学研究。E-mail:lcl@qdio.ac.cn
王延清,李超伦,刘梦坛,等.黄海春季和秋季中华哲水蚤脂类含量及组成分析[J].海洋学报,2013,36(2):99-107,
10.3969/j.issn.0253-4193.2014.02.011
Wang Yanqing,Li Chaolun,Liu Mengtan,et al.Lipid content and composition of Calanus sinicus in the Yellow Sea in spring and autumn[J].Acta Oceanologica Sinica(in Chinese),2013,36(2):99-107,doi:10.3969/j.issn.0253-4193.2014.02.011
