大河影响下的陆架边缘海沉积有机碳的再矿化作用
2014-10-27姚鹏郭志刚于志刚
姚鹏,郭志刚,于志刚
(1.中国海洋大学 海洋化学理论与工程技术教育部重点实验室,山东 青岛266100;2.中国海洋大学 海洋有机地球化学研究所,山东 青岛266100;3.复旦大学 环境科学与工程系,上海200433)
1 引言
大河影响下的陆架边缘海(River-dominated Ocean Margins,Ri OMars)是陆海相互作用最重要的区域,在全球碳循环过程中发挥着重要作用[1—2]。陆源输入的大量生源要素和有机质(以有机碳为主)维持了这一区域高的初级生产力和高的碳输出通量[1,3],使得 Ri OMars系统成为有机碳,特别是陆源有机碳的主要沉积中心[4—7]。河流流量的季节变化、不同尺度的物理过程(潮汐、风暴、波流等)和底栖生物的扰动等因素的存在造就了Ri OMars系统活跃的沉积动力环境,系统内沉积物和有机碳的输入和沉降、有机碳的循环等因此具有高度的时空变化性[1,8—9],从而使这一区域碳的源汇格局存在很大的不确定性[10—11]。物理和/或生物改造作用使得沉积物频繁地再悬浮和移动,改变了本应随时间和深度有序发生的有机碳早期成岩过程,将已经沉积下来并被新的沉积物覆盖的有机碳再次暴露在氧化或次氧化环境而发生再矿化分解。在微生物作用下,Ri OMars系统中难降解的陆源有机碳可能受新形成的海源有机碳的引入所产生的激发效应(pri ming effects)影响而被更有效地分解[12]。这些作用使得Ri OMars系统虽然是有机碳的沉积中心,但并不一定是有机碳的保存中心[4,13]。本文对大河影响下陆架边缘海沉积有机碳再矿化作用的速率测定方法、发生再矿化作用时的主要过程和特征进行了分析总结,以期对边缘海再矿化作用及其对边缘海碳汇的影响有一个更深入的认识。
2 基于O2消耗速率的沉积有机碳再矿化速率测定方法
沉积有机碳的再矿化作用是早期成岩过程中最重要的一个过程,有机碳经由再矿化实现了由有机向无机形式的转化,构成生物地球化学循环中的重要一环。再矿化作用与包含重要生源要素碳、氮和磷的有机或无机分子相关,可用下式表示:
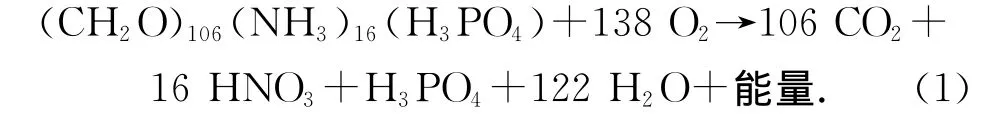
对于沉积有机碳再矿化速率的测定和计算正是基于式(1)。目前常用的主要是分别基于O2消耗速率和CO2产生速率的两类方法。基于O2消耗速率的方法是通过测定沉积物-水界面溶解氧含量,计算O2从上覆水向沉积物的扩散通量,将其作为有机碳氧化所消耗的O2速率,然后按照C106∶O138的比例将其转化成CO2的产生速率,并以此来代表有机碳的再矿化速率[14-15]。

图1 典型的沉积物-水界面O2垂直分布示意图(重绘自文献[14])
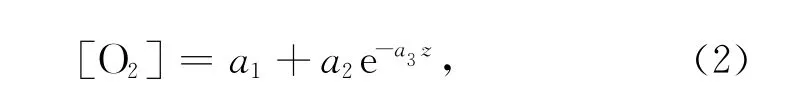
式中,z为沉积物深度,a1、a2和a3分别为指数函数的常数。根据菲克扩散定律,O2在沉积物-水界面的扩散通量FO2可描述为[15]:
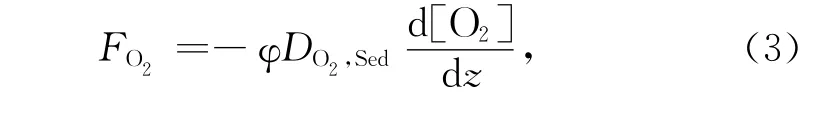
式中,φ为沉积物的孔隙度,一般在0.7~1.0之间,常取0.8[14]。DO2,Sed为O2在沉积物中的扩散系数,可由O2在水中的分子扩散系数估算[14]:

式中,DO2,water是温度的线性函数,一般介于1×10-5~4×10-5cm2/s,温度越低,扩散系数越小,24℃时约为2.3×10-5cm2/s[16]。
将式(2)、(4)分别代入式(3),并求导就得到:
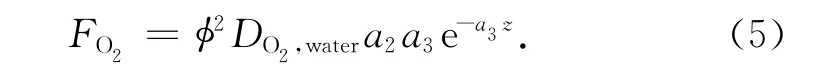
将各参数代入上式即可得到不同深度O2的扩散通量。当z=0 mm时,得到的即为O2穿越沉积物-水界面的扩散通量[mmol/(m2·d)],它实际上代表了沉积物中O2的消耗速率。据此,即可利用下式估算有机碳的再矿化速率(用CO2的产生速率来表示):

借助于氧微电极的发展[17],研究者现在可以获得非常精细的沉积物-水界面溶解O2剖面。例如,Epping等[18]根据伊比利亚边缘海沉积物中的溶解O2剖面,计算出的有机碳的氧化速率(以碳计)从陆架上的11 g/(m2·a),即2.51 mmol/(m2·d),减小到5 000 m水深处的2 g/(m2·a),即0.46 mmol/(m2·d)。在地中海西北的罗纳河(Rhône River)河口及邻近海域,Lansard等[19]通过氧微电极观测到的总的O2吸收速率(扩散通量)变化范围是5.2~29.3 mmol/(m2·d),据此计算出的有机碳再矿化速率为4.0~22.5 mmol/(m2·d),最大的再矿化速率发生于河口附近,这里的总有机碳含量也是最高的,且85%来自于陆源输入。Neibauer[14]在赤道太平洋加拉帕戈斯群岛(Galápagos Islands)附近开展的研究表明,由溶解氧剖面计算出的沉积有机碳再矿化速率在群岛中最大的伊萨贝拉岛西侧水深1 080 m的站位约为1.21 mmol/(m2·d),而在伊萨贝拉岛东侧2 257 m和640 m水深的站位则分别为0.67 mmol/(m2·d)和0.54 mmol/(m2·d),上述站位对应的 O2穿透深度分别为7.2 mm、10.4 mm和12.1 mm。这些研究表明,在大洋区域或很少受河流影响的陆架边缘海中,沉积有机碳的再矿化速率往往很低,但在受大河影响的陆架边缘海(尤其是河口附近),情况完全不同,其沉积有机碳的再矿化速率可能高出几倍到几十倍,显示大河影响下的陆架边缘海对有机碳循环具有十分重要的影响。
基于沉积物-水界面溶解氧扩散通量的测定来估算沉积有机碳的再矿化速率,具有测量速度较快的优点,而且由于使用精密的步进马达控制氧微电极,测量剖面通常只有几或十几毫米,测定比较精细和准确。但这种方法存在两个问题:第一,仪器本身价格昂贵,也容易损毁,这主要是因为氧微电极的玻璃头部极细,很容易在步进过程中折断,尤其当沉积物是粗砂或有较多贝壳等硬质异物存在时;第二,这种方法考虑的只是沉积物-水界面很小的范围内对溶解氧的吸收和消耗,虽然可以对O2能够穿透的深度以内发生的再矿化速率进行较为精确的估算,但却无法反映更多发生于沉积物次表层的复杂的有机碳分解和再矿化过程,这是因为在O2穿透深度以下的沉积物中,依然有更多的有机碳发生再矿化作用,如NO-3、Fe3+、Mn2+和SO2-4等都可以作为氧化还原反应的电子受体像O2一样氧化有机碳,因此,这种基于沉积物-水界面溶解氧扩散通量的方法实际上并不能完全反映这一区域有机碳的分解和再矿化过程。
4.1.1 效果评价方法 将绩效考核前2009年9月—2010年9月的质控成绩与实行绩效考核后2010年10月—2011年10月的质控成绩对比,从护理管理质量考核(包括护士长工作质量、病区管理质量、分级护理质量、护理文件书写)、患者与家属满意度、操作技能得分(包括“三基”与专科技术操作)3个方面进行比较。统计数据来自护理部月质控成绩以及月满意度问卷调查结果。其中每个月通过对10例患者和或家属发放调查问卷,全年共计120份,调查其对护士工作的满意度,回收有效率均98%。每个月对医师、护士发放调查问卷各10份,全年共计240份,回收有效率均100%。
3 基于CO2产生速率的沉积有机碳再矿化速率测定方法
除了基于O2消耗速率的方法测定沉积有机碳再矿化速率,还可以通过测定沉积物间隙水中∑CO2(即溶解无机碳DIC)含量,计算∑CO2从沉积物向上覆水的扩散通量,以此求得有机碳氧化所产生的CO2速率,即有机碳的再矿化速率[20-21]。不过,通过沉积物间隙水中∑CO2的剖面变化计算的CO2通量,往往并不能用来直接代表有机碳的再矿化速率,因为间隙水中∑CO2不仅来自于有机碳的氧化分解,还可能来自于碳酸盐的溶解和底层向上的扩散,特别是在以碳酸盐沉积为主的深海环境。在这种情况下,可以通过测定间隙水中∑CO2的δ13C,建立基于质量平衡的端元模型来计算有机碳氧化、碳酸盐溶解等对CO2产生的贡献,即下式[20]:

式中,Fs是∑CO2从沉积物向上覆水的扩散通量,可通过沉积物水界面的∑CO2的变化计算得到,Fd、Fo和Fc分别为深层沉积物中∑CO2的向上扩散、有机碳氧化和碳酸盐溶解所贡献的∑CO2通量,Fd可通过一定深度的∑CO2的变化计算得到;fd、fo和fc分别为3种∑CO2通量占∑CO2从沉积物向上覆水的扩散通量的比例;δ13Cadd为一定深度的沉积物中所增加的∑CO2的δ13C,可直接通过测定得到,同样地,δ13Cd为从深层沉积物中向上扩散的∑CO2的δ13C,也可通过测定一定深度的∑CO2的δ13C得到;δ13Co和δ13Cc分别为有机碳氧化和碳酸盐溶解所产生的∑CO2的δ13C,分别使用沉积有机碳和固体碳酸盐的δ13C。这样,在式(8)和(9)组成的联立方程中,只有fo和fc是未知数,求解后得到有机碳氧化和碳酸盐溶解所贡献的∑CO2通量,即得到有机碳的再矿化速率。利用这种方法,Martin等[20]研究了西赤道大西洋Ceara Rise(水深超过3 000 m)的沉积物间隙水∑CO2扩散通量,结果表明在水深3 279 m的站位0~6.2 cm 深度的沉积物中fo和fc相当(0.43~0.46),对应的Fo和Fc均在0.25 mmol/(m2·d)左右,而在水深4 675 m的站位0~1.8 cm深度的沉积物中fo(0.05)要远小于fd(0.50)和fc(0.45),相应的Fo只有0.03 mmol/(m2·d)左右,而1.8~7.5 cm深度的沉积物中有机碳分解所贡献的∑CO2通量明显增加(fo=0.44,Fo=0.08 mmol/(m2·d))。
这种方法基于多种假设,如体系处于稳态平衡状态、有机碳氧化和碳酸盐溶解过程中不存在同位素分馏等,适用于存在静态沉积的深海环境,更多地应用于研究碳酸盐沉积环境中碳酸盐的溶解[20,22],而在专注于沉积有机碳再矿化作用的研究中,在大河影响下的陆架边缘海这种高度动态的沉积环境的应用等都很少[21,23]。在大河影响下的陆架边缘海,沉积有机碳再矿化速率的测定主要是通过培养实验,直接测定沉积物样品在一个时间序列中∑CO2的产生速率,并以此来表示有机碳的再矿化速率。在封闭培养体系中,来自深层沉积物∑CO2的向上扩散可以忽略,而在大河影响下的陆架边缘海,由于受到陆源输入的颗粒物的影响,碳酸盐也不是主要的沉积形式,因此通过培养所产生的∑CO2可以认为主要来自于有机碳的再矿化分解。用来培养的沉积物样品可以是表层样品、整根柱状样品或分层后的柱状样品,常用的是整根柱状样品,在培养后再对样品进行分层,然后取每层样品中的间隙水,测定DIC含量,即∑CO2,再进行相应的计算[24]。该方法假定在培养过程中∑CO2的垂直剖面受非稳态扩散和零级反应控制,即:

其中,
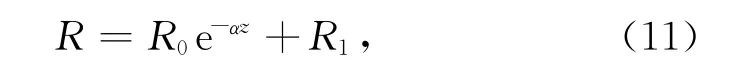
在初始条件下,
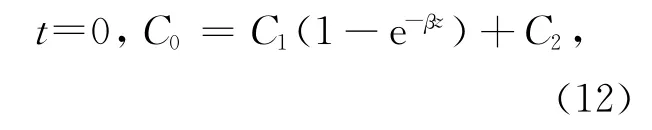
边界条件:
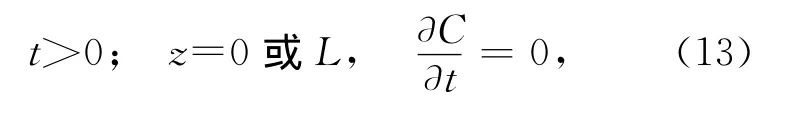
式中,C是∑CO2含量(μmol/L),是沉积物深度z和培养时间t的函数;φ为沉积物的孔隙度;DCO2,water是一定温度下CO2在水中的分子扩散系数,在24℃时约为1.9×10-5cm2/s[16];R代表反应速率,即∑CO2的产生速率,R0、R1和α是R函数的常数(单位分别为μmol/(L·s)和cm-1);C1、C2和β是初始条件下∑CO2垂直分布曲线函数的常数,可通过曲线拟合得到。
对式(7)进行偏微分求解,可得到C(z,t)的解。因为培养时间和沉积物深度是已知的,实际上的未知数就是反应速率R函数的常数R0、R1和α[25]。在实际应用中,对不同培养时间得到的∑CO2垂直分布曲线进行函数拟合,即可求解R0、R1和α,因此除了起始时间外,至少还应有两个时间点的培养样品数据,理论上时间点越多,结果越优。在得到R0、R1和α后,结合沉积物柱长L,可求得整个沉积物柱累积反应速率或通量[mmol/(m2·d)]:

或使用下式简单估算:
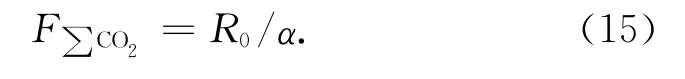
应用这一方法,Aller等人在亚马孙河口、巴布亚湾等地开展了底边界层中浮泥、移动泥中的有机碳再矿化作用的开创性研究,深化了人们对大河河口的泥质沉积、三角洲顶积层等在有机碳埋藏、保存和再矿化等方面独特和重要作用的认识[4,24-29]。例如,作为输沙量世界第一的亚马孙河,其所输送的泥沙受潮汐、上升流和波等的影响在南美东北海岸线形成了一条绵延1 600余千米,厚度0.5~2.0 m不等的“移动泥带”[4],在该移动泥带内净的∑CO2累积产生速率超过43.2 mmol/(m2·d)[25]。在巴布亚湾飞河三角洲的顶积层[24],表层沉积物(0~20 cm)中∑CO2的产生速率最高达43.1 mmol/(m2·d),且主要发生在季风季节,表明物理扰动对再矿化作用有重要影响(图2)[24]。通过对培养实验中获得的CO2进行δ13C分析,Aller等[24]还应用双端元模型计算了不同来源有机碳再矿化对CO2产生的贡献,发现超过50%的自河流入海的陆源有机碳在巴布亚湾表层沉积物中被氧化而分解,保存下来的部分只占输入量的13%~27%,显示了移动泥在有机碳再矿化方面的重要作用。与巴布亚湾同处新几内亚岛南部的阿鲁海(Aru Sea)每年接收约30条河流输送的427×106t的泥沙,接近亚马孙年输沙量的一半[30-31]。在阿鲁海,沉积物培养实验的深度积分DIC累积生产速率范围是12.3~47.8 mmol/(m2·d),最高值处靠近此区域3条主要的河流,也是最长的河流Pulau River的河口[31]。
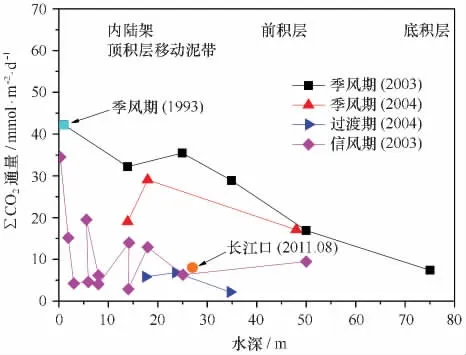
图2 巴布亚湾沉积物中∑CO2产生速率随深度和季节的变化(重绘自文献[24],原数据为长江口再矿化培养结果)
总的来说,通过培养方法获得的∑CO2产生速率,即有机碳再矿化速率,需要的时间周期较长,操作步骤多,计算过程相对也较复杂一些,但是这种方法测定的是有机碳再矿化的产物CO2,不但考虑了好氧条件下的有机碳分解过程,同时也包括了厌氧条件下的过程,如甲烷的厌氧氧化(AOM)[32],是一个综合的结果,因而也是一个更为全面客观的结果。
从上述结果还可以看出,目前通过测定培养过程中∑CO2产生速率的方法来研究沉积有机碳再矿化作用主要集中在热带海域。3个不同区域以及其他一些研究的结果[33]在数值上接近,而且明显比用测定沉积物-水界面溶解氧扩散通量的方法获得的其他海域的结果要高,说明热带海域确实是沉积有机碳的“焚化炉”,大部分进入这一区域的有机碳,特别是难降解的陆源有机碳会被“燃烧”而分解掉[27,31]。在温带海域,类似的研究还未见报道。我们的初步研究表明,在长江口泥质沉积区中心位置,表层沉积物中也发生着明显的有机碳再矿化作用,简单的估算表明表层15 cm以上的沉积有机碳再矿化速率平均为8.4 mmol/(m2·d)(深度平均结果),与热带海域在动力条件较弱的信风期间的结果相当(见图2)[34]。在培养过程中,表层15 cm以上的间隙水∑CO2含量是逐渐升高的,但是15 cm以下却是逐渐降低的,说明15 cm以下发生了明显消耗CO2的反应,其消耗速率远高于此处甲烷的沉积物水界面扩散通量,说明产甲烷菌将CO2还原成CH4并不是一个主要的过程,实际上其消耗速率与间隙水中常量阳离子,如Ca2+、Mg2+和K+等的消耗速率是接近的,表明自生碳酸盐矿物的形成可能是再矿化作用中消耗CO2的主要过程[34]。实际上,在亚马孙河口、巴布亚湾的沉积物培养实验中也均发现了这一点[26-27]。更进一步的分析表明,沉积物中总有机碳(TOC)含量在培养过程中是逐渐降低的,但是其消耗速率远高于间隙水中∑CO2的产生速率,表明大部分沉积有机碳的再矿化分解并不是直接形成DIC,而是可能先形成溶解有机碳(DOC),然后DOC再逐步分解形成DIC,图3给出了边缘海沉积有机碳再矿化作用中不同形式的碳之间的转化过程[35]。与TOC向DOC的转化相比,DOC向DIC的转化速率要慢得多,因为DOC的活性范围更大,很多都耐微生物降解[36-37]。最近几年提出来的微生物碳泵(microbial carbon pu mp,MCP)理论强化了微生物在将脆弱的DOC转化成难降解的DOC(Recalcitrant DOC),从而促进碳的埋藏方面的重要作用[38]。因此,在边缘海沉积环境中应能观察到DOC在系统中的积累,正如在法国吉伦特(Gironde)河口最大浑浊带附近的浮泥层中所观察到的[39]。
这些复杂生物地球化学过程的同时存在,无疑使得沉积有机碳再矿化作用的分析和解释更加复杂,也说明仅仅分析沉积物间隙水中CO2的剖面变化不足以全面了解其中发生的有机碳再矿化分解、CO2与CH4的产生和消耗等过程。多种技术手段的同时运用,如间隙水中CO2和CH4的13C和14C分析,甚至生物标志物的分析等,可能有助于揭示培养过程中不同来源、不同年龄有机碳再矿化速率的差异及对∑CO2产生和消耗的贡献,这应当是进一步完善基于CO2产生速率的沉积有机碳再矿化速率测定方法的一个重要方面。

图3 海洋沉积物中有机碳再矿化过程概念模型(重绘自文献[35])
4 沉积有机碳再矿化作用的特征
除了对沉积有机碳再矿化速率进行直接或间接地测定之外,一些特征或参数还可以用来辅助判断沉积有机碳是否可能或已经发生了明显的再矿化分解。根据已有研究成果,概括起来讲,沉积有机碳再矿化作用的特征主要体现在5个方面:
第一,表层沉积物呈现比较明显的混合均匀特点。在物理和/或生物改造作用下(以物理改造作用为主),表层沉积物会发生比较明显的周期性混合,混合层深度从几厘米到几米不等,但主要是表层几十厘米。混合层是一个非稳态的沉积,与底层存在明显的分界线,该层不但可以通过再悬浮发生纵向的混合,还可以在潮汐、流、重力的作用下发生横向移动,故名“移动泥(mobile muds)”[4,28]。混合层的存在可以通过210Pb、137Cs等放射性同位素的垂向分布是否均匀来判断。一般来说,沉积物中的放射性同位素是随着时间逐渐衰变的(137Cs的相反),其活度应随深度增加而逐渐减小,如果沉积物发生了混合,在混合层内就观察不到明显的衰变曲线。这种现象在亚马孙河口[27]、巴布亚湾[24]、密西西比河口[1]以及长江口[40-41]等都有发现。
第二,有序发生的早期成岩过程被改变,形成了次氧化的氧化还原条件。由于混合层沉积物频繁地发生再悬浮和再沉积,改变了本应有序发生的早期成岩过程,铁和锰不断地经历再暴露和再氧化,发生反复的氧化还原循环,并与硫的氧化还原耦合在一起,从而形成次氧化的氧化还原条件,增强随后的沉积有机碳缺氧降解过程。发生混合的沉积物中具有高含量的活性铁(以Fe3+为主,300~400μmol/g),而间隙水中具有高含量的Fe2+,表明有很大一部分活性铁被还原了;但是在混合层内被还原的活性铁大部分并没有形成硫化铁矿物(FeS2),即黄铁矿化程度低,主要是因为这些区域相对于一般的陆架沉积物缺少硫,C/S比值较高(约4~6)[26]。在沉积物混合层(次氧化带)中由于SO的还原和硫的氧化同时存在,不发生净的硫还原,S的δ34S垂向变化均匀,但是在混合层与底层(甲烷带)的分界处,会发生净的硫还原,间隙水中S会明显降低,形成HS-,造成δ34S升高。总的来说,与一般的陆架沉积物相比,在这些区域沉积物中的间隙水富集34S,δ34S一般在10~30左右[42]。
第三,沉积物中有机碳的再矿化分解速率高,沉积物单位比表面积有机碳含量(TOC/SSA)低,有机碳的保存效率低。通常,具有较高沉积速率的区域,只要动力环境比较稳定,有机碳就会被有效地保存下来[43]。但这些区域由于处于河口三角洲附近,虽然因为受陆源输入的影响而具有较高的沉积速率,却由于动荡的动力环境,有机碳保存率较低,一般只有20%左右(图4)[4,24,43]。实际上,衡量不同河流和海域有机碳保存率的一个较好的指标是沉积物单位比表面积有机碳含量(TOC/SSA)。按照TOC/SSA比值的大小,以0.4 mg/m2和1.0 mg/m2作为分界线,可以将沉积物划分为3类:一类是TOC/SSA大于1.0 mg/m2的,主要是高生产力上升流区域的沉积物,有机碳被很好地保存了下来;第二类是TOC/SSA在0.4~1.0 mg/m2之间的,主要是一般陆架海域沉积物(受大河影响较小)和河流中的悬浮颗粒物;第三类则是TOC/SSA小于0.4 mg/m2的,常见于深海沉积物,因为有机碳在漫长的沉降过程中已经发生了充分地降解,有机碳保存率自然很低[43](见图5)。动力环境强的河口三角洲区域,如亚马孙河口、飞河三角洲、密西西比三角洲等,其TOC/SSA通常也低于0.4 mg/m2,这是由于组成沉积物的颗粒虽然是较细的黏土和粉砂为主,本身具有较高的比表面积,应吸附或结合较多的有机碳,但因为发生了强烈的有机物再矿化分解作用,其TOC/SSA比值反而明显低于陆地土壤或陆架边缘海沉积物,而与深海沉积物相当[43]。我们在长江口和浙闽沿岸泥质区的初步研究表明,泥质区沉积物TOC/SSA比值小于0.4 mg/m2,而泥质区外的沉积物则在0.6 mg/m2左右,表明长江三角洲区域与亚马孙、密西西比河三角洲一样,都属于沉积速率很高但有机碳保存率相对较低的区域。
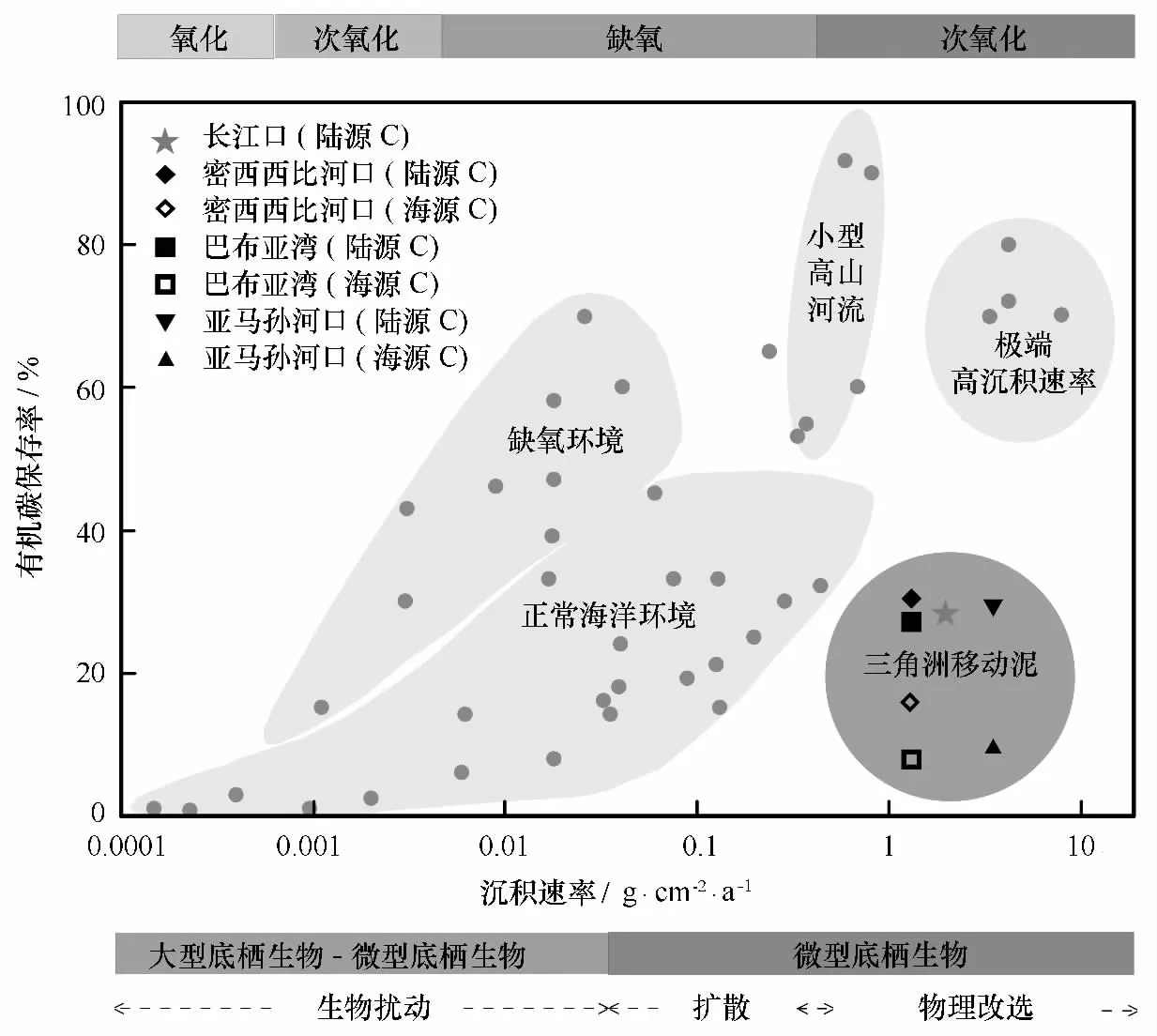
图4 不同海洋环境中沉积有机碳的保存率随沉积速率的变化(重绘自文献[43])

图5 海洋沉积物中有机碳含量(TOC)与沉积物比表面积(SSA)之间的关系(重绘自文献[43])
第四,可能形成富含铁和锰的自生碳酸盐矿物,发生“反风化作用”。反风化作用是指海洋沉积物中的元素通过化学反应结合在一起形成新的自生黏土矿物的过程[44-45],可用下式表示[46]:

式中“离子”表示碱金属或碱土金属离子、Fe2+、F-等。由上式可以看出,反风化作用发生将使得离子被重新结合到固体化合物中,在这一过程中,有机质是作为活性铁氧化的底物。因此,当一个区域具有丰富的活性铁铝氧化物、活性有机质、生物硅、碱金属和碱土金属等离子的持续供给时,在次氧化的成岩条件下,就有可能发生反风化作用。显然,有机碳再矿化作用越强的沉积环境,越有可能发生反风化作用。如前所述,我们在长江口泥质区沉积物不但观察到了间隙水中∑CO2的产生(0~15 cm),还观察到了∑CO2的消耗,而其消耗速率与常量阳离子的消耗速率是接近的,显示了自生碳酸盐矿物的可能形成,即反风化作用的发生[34]。在亚马孙河口也已经观察到了反风化作用存在,其沉积物间隙水中的Li+、K+、F-等明显从上覆水向沉积物中扩散,Li+的扩散通量高达当地河流输送通量的60%[45,47-49]。通常,自生黏土矿物主要是在低沉积速率的外陆架或深海才能形成,一般需要几百年甚至上千年[45];但在河口三角洲特殊条件下,自生黏土矿物可以在较短的时间(如几年内)形成,这无疑对C、Si、Li+、K+等元素的生物地球化学循环有重要意义。长久以来,对形成海洋自生矿物的反风化作用的重视远不如对陆生矿物的风化作用[50],对沉积有机碳的再矿化作用和反风化作用的耦合了解就更少,在今后的工作中应当加强这方面的研究。
第五,微生物在沉积有机碳再矿化过程中发挥着重要作用。沉积有机碳的再矿化过程涉及一系列好氧或厌氧的古菌、细菌等微生物的作用,涉及发酵作用、甲烷产生和氧化、硝化反硝化、厌氧铵氧化、硫酸盐还原等过程[28]。这些不同的微生物功能类群以有机碳为底物,以高价态的氧化物(如硫酸盐、硝酸盐等)作为电子受体,在其自身被还原成低价态形式的同时,将底物氧化生成CO[28]2。在一般的海洋环境中,表层沉积物中的生物量主要由大型底栖生物贡献,但是在动力条件强、表层沉积物混合明显的河口三角洲,如亚马孙河口、巴布亚湾三角洲,微生物和大型底栖生物的相对量截然不同,沉积物中微生物的生物量几十倍于底栖动物[4]。在巴布亚湾海床上部,微生物群落具有丰富的多样性,高的细菌生物量和周转率与高的底沉积物再矿化速率相一致,反映了细菌对物理扰动、新鲜有机碳的输入等的快速响应[51]。在沉积有机碳再矿化过程中,新鲜的海洋自生有机碳作为易降解的有机碳被优先分解,但是通常认为难降解的陆源有机碳(如木质素)在这一过程中也能发生显著的降解,这种现象被称为“激发效应(pri ming effects)”。这是一个从土壤研究中借用的概念,表示外源有机物的加入显著改变土壤有机碳的矿化速率[52]。在河口边缘海沉积有机碳的再矿化过程中,“激发效应”如何促进或抑制难降解的陆源有机碳的分解,微生物在其中究竟起了什么样的作用目前还了解很少。
应当指出的是,对大河影响下陆架边缘海沉积有机碳再矿化作用的研究,目前主要集中在热带河口,已有一些针对温带河口(如密西西比河口、长江口等)沉积物的类似研究,初步结果表明也具有上述某些特点,但并不如热带河口三角洲那样明显。温带河口陆架边缘海的情况具体是怎样的,两者的差异以及控制机制是什么?这些都需要更深入的研究。
5 结语
总的来说,目前对于大河影响下的边缘海系统沉积有机碳的再矿化作用的研究和认识是不足的。不同区域、不同流量和输沙量、不同河口沉积类型的大河影响下的陆架边缘海沉积有机碳再矿化速率差异有多大?河流、潮汐、波浪、风暴和生物扰动如何影响沉积有机碳的再矿化分解?不同来源、不同年龄的颗粒和溶解有机碳在再矿化过程中的关系是怎样的,是互相促进还是抑制?热带和温带河口再矿化作用是否有差异,其机制是什么?微生物究竟是如何在其中发挥作用的?这些都是需要今后深入研究的十分重要的问题,只有这些问题研究清楚了,才能对大河影响下的陆架边缘海有机碳的源汇格局有更清楚的认识。
亚马孙河口、巴布亚湾三角洲等处的相关工作已经为这一类研究提供了一个很好的范例和参考,但仍然有需要突破之处,比如之前的研究均是针对某一特定区域采用一种测定方法的研究,既缺少使用同一种方法在不同区域之间的比较研究,也没有在同一个地点对两种再矿化速率的测定方法进行比较,前者可以用于了解影响再矿化作用的因素,而后者有助于在使用不同方法的研究之间进行比较。另外,之前的研究多仅限于再矿化过程中沉积物间隙水O2和CO2的变化,对于被再矿化的沉积有机碳本身的变化缺少认识,作为解析有机碳来源和归宿的有力工具的化学生物标志物在再矿化过程中又是如何变化的也不清楚。是否可以将沉积有机碳、生物标志物的变化也作为再矿化速率测定的指标或参数?这些问题和思路当是今后研究的关键切入点。
作为我国著名的世界级河流,长江、黄河和珠江河口及其邻近海域,特别是长江口-东海内陆架泥质区沉积有机碳的埋藏、保存和再矿化作用无疑更应引起我国研究者的关注,对于其认识的逐步加深将为深入理解这些大河影响下的陆架边缘海生源要素的生物地球化学循环、陆海相互作用过程等奠定更为坚实的科学基础。
[1]Mckee B A,Aller R C,Allison M A,et al.Transport and transformation of dissolved and particulate materials on continental margins Influenced by major rivers:benthic boundary layer and seabed processes[J].Continental Shelf Research,2004,24:899-926.
[2]Bianchi T S,Allison M A.Large-river delta-front estuaries as natural“recorders”of global environ mental change[J].Proceedings of the National Academy of Sciences,2009,106:8085-8092.
[3]Dagg M,Benner R,Lohrenz S E,et al.Transformation of dissolved and particulate materials on continental shelves influenced by large rivers:plume processes[J].Continental Shelf Research,2004,24:833-858.
[4]Aller R C.Mobile deltaic and continental shelf muds as suboxic,fluidized bed reactors[J].Marine Chemistry,1998,61:143-155.
[5]Hedges J I,Keil R G.Sedimentary organicmatter preservation:an assessment and speculative synthesis[J].Marine Chemistry,1995,49:81-115.
[6]Meade R H.River-sediment inputs to major deltas[M]//Milli man J D,Haq B U.Sea-level Rise and Coastal Subsidence.London:Kluwer,1996:63-85.
[7]Burdige D J.Preservation oforganicmatter inmarine sediments:controls,mechanisms,and an imbalance in sediment organic carbon budgets?[J].Chem Rev,2007,107:467-85.
[8]Hedges J I,Keil R G,Benner R.What happens to terrestrial organicmatter in the ocean?[J].Org Geochem,1997,27:195-212.
[9]Gordon E S,Goñi M A.Sources and distribution of terrigenous organicmatter delivered by the Atchafalaya River to sediments in the northern gulf of Mexico[J].Geochim Cosmochi m Acta,2003,67:2359-2375.
[10]Borges A V.Do we have enough pieces of the jigsaw to integrate CO2 fluxes in the Coastal Ocean?[J].Estuaries,2005,28:3-27.
[11]Cai W J,Dai M H,Wang Y C.Air-sea exchange of carbon dioxide in ocean margins:A province-based synthesis[J].Geophysical Research Letters,2006,33,L12603.
[12]Bianchi T S.The role of terrestrially derived organic carbon in the coastal ocean:A changing paradigm and the pri ming effect[J].PNAS,2011,108(49):19473-19481.
[13]Zonneveld K A F,Versteegh G J M,Kasten S.Selective preservation oforganicmatter in marine environments-processes and impact on the fossil record[J].Biogeosciences Discussions,2009,6:6371-6440.
[14]Neibauer J.Carbon remineralization rates in marine sediments beneath areas of high and low pri mary productivity in the Galapagos Archipelago[D].Washington:University of Washington,2006.
[15]Sauter E J,Schlüterm,Suess E.Organic carbon flux and remineralization in surface sediments from the northern North Atlantic derived from pore-water oxygen microprofiles[J].Deep-Sea Research I,2001,48:529-553.
[16]Libes S M.Introduction to marine biogeochemistry[M].2nd ed.Amsterdam:Academic Press,2009:161.
[17]许昆明,胡融刚.微电极技术在沉积物化学原位测量中的应用[J].地球科学进展,2006,21(8):863-869.
[18]Epping E,van der Zee C,Soetaert K,et al.On the oxidation and burial oforganic carbon in sediments of the Iberian margin and Nazare canyon(NE Atlantic)[J].Progress in Oceanography,2002,52:399-431.
[19]Lansard B,Rabouille C,Denis L,et al.Benthic remineralization at the land-ocean interface:Case study of the Rhône River(NW Mediterranean Sea)[J].Estuarine,Coastal and Shelf Science,2009,81:544-555.
[20]Martin W R,Mc Nichol A P,Mc Corkle D C.The radiocarbon age of calcite dissolving at the sea floor:esti mates from pore water data[J].Geochimica et Cosmochi mica Acta,2000,64:1391-1404.
[21]Papadimitriou S,Kennedy H,Thomas D N.Rates oforganic carbon oxidation in deep sea sediments in the eastern North Atlantic from pore water profiles of O2and theδ13C of dissolved inorganic carbon[J].Marine Geology,2004,212:97-111.
[22]Martin W R,Sayles F L.CaCO3dissolution in sediments of the Ceara Rise,western equatorial Atlantic[J].Geochimica et Cosmochi mica Acta,1996,60(2):243-263.
[23]Ogrinc N,Faganeli J,Pezdic J.Determination oforganic carbon remineralization in near-shore marine sediments(Gulf of Trieste,Norther n Adriatic)using stable carbon isotopes[J].Organic Geochemistry,2003,34:681-692.
[24]Aller R C,Blair N E,Brunskill G J.Early diagenetic cycling,incineration,and burial of sedimentary organic carbon in the central Gulf of Papua(Papua New Guinea)[J].Journal of Geophysical Research,2008,113,F01S09.
[25]Aller R C,Blair N E,Xia Q,et al.Remineralization rates,recycling and storage of carbon in Amazon shelf sediments[J].Continental Shelf Research,1996,16:753-786.
[26]Aller R C,Blair N E.Early diagenetic remineralization of sedimentary organic C in the Gulf of Papua deltaic complex(Papua New Guinea):Net loss of terrestrial C and diagenetic fractionation of C isotopes[J].Geochi mica et Cosmochimica Acta,2004,68:1815-1825.
[27]Aller R C,Blair N E.Carbon remineralization in the Amazon-Guianas mobile mudbelt:a sedimentary incinerator[J].Continental Shelf Research,2006,26:2241-2259.
[28]于志刚,姚鹏,甄毓,等.河口底边界层生物地球化学过程研究进展[J].海洋学报,2011,33(5):1-8.
[29]姚鹏,于志刚,郭志刚.大河影响下的边缘海沉积有机碳输运与埋藏及再矿化研究进展[J].海洋地质与第四纪地质,2013,33(1):154-160.
[30]Milliman J D,Farnsworth K L.River discharge to the coastal ocean:a global synthesis[M].Cambridge University Press,2011:392.
[31]Alongi D M,Wirasantosa S,Wagey T,et al.Early diagenetic processes in relation to river discharge and coastal up welling in the Ar u Sea,Indonesia[J].Marine Chemistry,2012,140/141:10-23.
[32]Regnier P,Dale A W,Arndt S,et al.Quantitative analysis of anaerobic oxidation of methane(AOM)in marine sediments:A modeling perspective[J].Earth-Science Reviews,2011,106:105-130.
[33]Suykens K,Sch midt S,Delille B,et al.Benthic remineralization in the northwest European continental margin(northern Bay of Biscay)[J].Continental Shelf Research,2011,31:644-658.
[34]Yao P,Zhao B,Yu Z G,et al.Burial,preservation,and remineralization of sedimentary organic carbon in mud deposits of a temperate large-river delta-front estuary[J].Marine Chemistry,2013.Submitted.
[35]Alperin M J,Albert D B,Martens C S.Seasonal variations in production and consumption rates of dissolved organic carbon in an organic rich coastal sediment[J].Geochi mica et Cosmochimica Acta,1994,58:4909-4930.
[36]Hansell D A.Recalcitrant Dissolved Organic Carbon Fractions[J].Annual Review of Marine Science,2013,5:421-445.
[37]Jiao N Z,Zheng Q.The microbial carbon pump:from genes to ecosystems[J].Applied and Environmental Microbiology,2011,77:7439-7444.
[38]Jiao N,Herndl G J,Hansell D A,et al.Microbial production of recalcitrant dissolved organicmatter:Long-term carbon storage in the global ocean[J].Nature Reviews Microbiology,2010,8:593-599.
[39]Abril G,Etcheber H,Le Hir P,et al.Oxic/anoxic oscillations and organic carbon mineralization in an estuarine maxi mu m turbidity zone(The Gironde,France)[J].Li mnology and Oceanography,1999,44:1304-1315.
[40]Su C C,Huh C A.210Pb,137Cs and239;240Pu in East China Sea sediments:sources,pathways and budgets of sediments and radio nuclides[J].Marine Geology,2002,183:163-178.
[41]Hao Y C,Guo Z G,Yang Z S,et al.Tracking historical lead pollution in the coastal area adjacent to the Yangtze River Estuary using lead isotopic compositions[J].Environ mental Pollution,2008,156:1325-1331.
[42]Aller R C,Madrid V,Chistoserdov A,et al.Unsteady diagenetic processes and sulfur biogeochemistry in tropical deltaicmuds:Implications for oceanic isotope cycles and the sedimentary record[J].Geochimica et Cosmochi mica Acta,2010,74:4671-4692.
[43]Blair N E,Aller R C.The fate of terrestrial organic carbon in the marine environ ment[J].Annu Rev Mar Sci,2012,4:17.1-17.23.
[44]Mackenzie F T,Kump L R.Reverse weathering,clay mineral formation,and oceanic element cycles(Perspective)[J].Science,1995,270:586-587.
[45]Michalopoulos P,Aller R C.Rapid clay mineral formation in Amazon delta sediments:Reverse weathering and oceanic elemental cycles[J].Science,1995,270:614-617.
[46]Mackenzie F T,Garrels R M.Chemical mass balance bet ween rivers and oceans[J].Am J Sci,1966,264:507-525.
[47]Rude P D,Aller R C.Fluorine uptake by Amazon continental shelf sediments and its impact on the global fluorine cycle[J].Cont Shelf Res,1994,14:883-907.
[48]Michalopoulos P,Aller R C,Reeder R J.Conversion of diatoms to clays during early diagenesis in tropical,continental shelf muds[J].Geology,2000,28,1095-1098.
[49]Michalopoulos P,Aller R C.Early diagenesis of biogenic silica in the Amazon delta:Alteration,authigenic clay formation,and storage[J].Geochimica et Cosmochi mica Acta,2004,68(5):1061-1085.
[50]France-Lanord C,Derry L A.Organic carbon burial forcing of the carbon cycle from Hi malayan erosion[J].Nature,1997,390:65-67.
[51]Aller J Y,Aller R C,Kemp P F,et al.Fluidized muds:a novel setting for the generation of biosphere diversity through geologic time[J].Geobiology,2010,8:169-178.
[52]Kuzyakov Y,Friedel J K,Stahr K.Review of mechanisms and quantification of pri ming effects[J].Soil Biology &Biochemistry,2000,32:1485-1498.
