初榨橄榄油挥发性风味成分的鉴定
2014-05-31薛雅琳王兴国张东生
钟 诚 薛雅琳 王兴国 张 东 张东生 徐 冉
(江南大学食品学院1,无锡 214122)
(国家粮食局科学研究院2,北京 100037)
中国从1964年开始引种油橄榄,经过30年的引种试验,目前初步确定了我国油橄榄的三大适生区为白龙江低山河谷区、金沙江干热河谷区和长江三峡低山河谷区[1]。其中甘肃省陇南市武都区目前是全国最大的油橄榄生产基地,截止2012年底,陇南市油橄榄基地面积已达1.95万hm2,挂果面积6 700公顷,年产鲜果7 600 t,年产油1 140 t。国内油橄榄种植产业的飞速发展带动了国产初榨橄榄油生产加工和消费需求,也使得初榨橄榄油丰富的营养价值和独特的感官风味备受青睐。初榨橄榄油是从新鲜油橄榄果实中冷榨提取的一种高档食用植物油,其富含不饱和脂肪酸(油酸占55%~83%)、角鲨烯、多酚以及维生素,具有抗氧化、调节胆固醇、预防癌症、美容的功效和调整人体生理机能的作用[2]。另一方面,初榨橄榄油青草般的“绿色”风味在消费者偏爱程度以及橄榄油质量评价上具有重要的地位,这种“绿色”风味源于油中的多酚和复杂的挥发性化合物。Angerosa[3]等对初榨橄榄油风味起源和成分的研究表明,这些挥发性化合物主要是脂氧合酶途径(Lipoxygenase pathway)合成的 C5、C6的醛和醇,以及它们相应的酯类化合物,脂氧合酶途径的具体反应过程如图1所示。
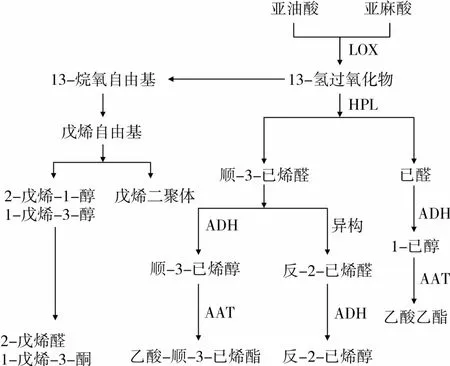
图1 脂肪合酶途径
与欧洲国家相比,目前中国境内的油橄榄种植面积和橄榄油产量还非常有限,中国市场上橄榄油的供应95%还依赖国外进口。此外,我国油橄榄种植和橄榄油加工环节均缺少科学规划,管理粗放。个别加工厂过度追求出油量,农户采摘油橄榄后企业加工厂一次性大规模收购,长时间露天堆放,微生物发酵现象严重;在油橄榄加工技术参数方面至今没有具体的行业标准,加工条件具有很大的随意性和不确定性。这些诸多问题都会影响到橄榄油的质量指标和风味品质,甚至带来令消费者难以接受的感官风味。另一方面,我国引进的油橄榄品种繁多,各品种不易区分鉴定,品种资源特征信息数据匮乏。针对以上现实问题,本文采用顶空固相微萃取-气质联用(HS-SPME-GC/MS)技术,结合保留指数(Retention index,RI)方法分离鉴定了武都境内大规模种植的油橄榄的初榨橄榄油,以及西班牙原装进口特级初榨橄榄油的风味成分,以期为国内初榨橄榄油生产加工过程中的品质评价与控制提供参考,为建立本土油橄榄和橄榄油特征信息数据库和油橄榄品种溯源等方面提供数据支持。
1 材料与方法
1.1 试验材料
1.1.1 主要原料、试剂
油橄榄原料采自甘肃省陇南市武都区大堡油橄榄试验园,试验共采摘6个品种:鄂植8号、皮削利、佛奥、阿斯、莱星、城固32号,均为陇南市大规模种植的优良品种,每个品种取500 g油橄榄,要求新鲜,无虫斑和缺陷,也不要与土壤接触;国产混合品种的初榨橄榄油(成品油)由陇南市田园油橄榄科技开发有限公司提供;已确认合格的西班牙原装进口初榨橄榄油由国家粮食局科学研究院粮油检验测试中心提供;C5~C20正构烷烃标准品购自美国Sigma公司。其他试剂为分析纯。
1.1.2 主要仪器、设备
Waring实验室均质机;Allegra 64R台式高速冷冻离心机;HH-4数显恒温水浴锅:国华电器有限公司;Lambda 45紫外-可见分光光度计:Derkin Elmer公司;Agilent 7890A-5975C气质联用仪:美国安捷伦公司;固相微萃取器手柄,30/50μm DVB/CAR/PDMS萃取头:美国Supelco公司。
1.2 试验方法
1.2.1 初榨橄榄油提取工艺
油橄榄→去枝叶→清洗→破碎→搅拌融合→离心分离→初榨橄榄油[4]。搅拌融合 30 min,温度30℃,搅拌程序能促进油滴融合,显著提高出油率;离心机转速5 000 r/min,离心温度25℃;初榨橄榄油提取之后置于-4℃的冰箱中冷藏。
1.2.2 酸值、过氧化值和紫外吸光度的测定
酸值、过氧化值和紫外吸光度的测定按照国家标准[5-7]。
1.2.3 顶空固相微萃取条件
为了减少分析中的杂质峰,20 mL顶空瓶和聚四氟乙烯隔垫使用前应清洗干净,然后在100℃的烘箱中干燥3 h。称取2.00 g油样置于顶空瓶中,用隔垫密封。将顶空瓶置于40℃恒温水浴平衡20 min后,通过隔垫插入已活化好的SPME萃取头(270℃,1 h),在70℃下顶空吸附40 min,之后再插入GC进样口,在250℃下解析3 min。注意在萃取头插入进样口的同时启动仪器采集数据,在2次样品分析之间都要再次处理萃取头,防止空气中的气体吸附。
1.2.4 GC-MS条件
气相色谱条件:DB-5MS弹性毛细管柱(30 m×0.25 mm,0.25μm),柱温升温程序:40℃,保持2 min,然后以5℃/min升到220℃,保持10 min;进样口温度:250℃;载气为高纯He,流速1 mL/min;进样方式:不分流。质谱条件:电子轰击离子源(EI),电子能量70 ev,灯丝发射电流200μA;离子源温度:150℃;接口温度:280℃;全扫描模式,扫描质量范围 m/z35~350 amu。
1.2.5 挥发性风味成分的定性与定量
未知化合物经计算机检索与NIST 2008和Wiley 7标准谱库相匹配,对于正反匹配度都大于800(最大值1 000)的匹配结果,计算RI,然后分别检索其相应文献 RI(http://webbook.nist.gov/chemistry/)。以RI匹配最好的化学结构作为最佳鉴定结果,若无RI文献值可以参考,只报道质谱匹配度最高的化合物;对于正反匹配度小于800的匹配结果视为未知物质,暂不报道。RI的测定:用同样的GC/MS条件进样分析C5~C20正构烷烃混标,记录各正构烷烃的保留时间,用线性升温公式[8]RI=100n+100(tx-tn)/(tn+1-tn)计算各成分的 RI,其中tx,tn和tn+1分别为被分析组分和相邻碳数正烷烃 (tn<tx<tn+1)流出峰的保留时间。各组分峰的相对含量采用总离子流图峰面积归一化法确定。
2 结果与讨论
2.1 初榨橄榄油样品主要品质指标
本试验所用油样的酸值、过氧化值和紫外吸光度如表1所示。从各指标数值可知所有初榨橄榄油均符合特级初榨橄榄油的等级要求(酸度≤0.8%,过氧化值≤10 mmol/kg,K232≤2.50,K270≤0.22)。
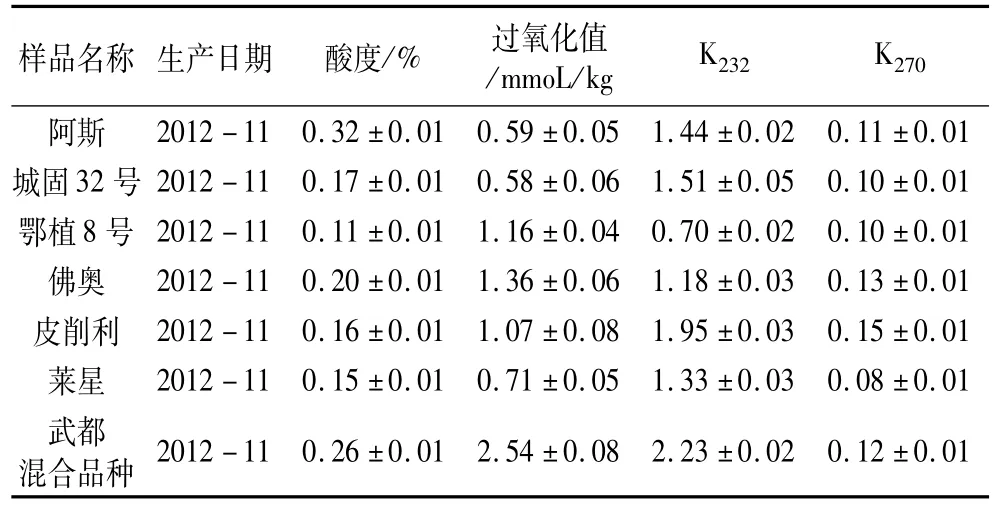
表1 油样的主要品质指标
2.2 顶空固相微萃取条件优化
温度影响待测组分在样品基质、气体顶空和纤维涂层三者之间的化学平衡,从而对SPME萃取效果影响较大。过高的温度有利于挥发性化合物从基质中释放出来,增加顶空中目标物的浓度,但同时也会使待测成分在纤维涂层与顶空间的分配系数降低,减小涂层对待测成分的吸附量[9]。本试验研究了不同萃取条件下挥发性化合物总峰面积、C5和C6化合物峰面积的变化规律,结果如图2、图3所示。总峰面积随吸附温度的升高逐渐增大,70℃之后达到稳定。C6化合物的吸附在50℃达到饱和,超过70℃吸附量下降。与C6化合物相比,C5化合物吸附量较小,且随吸附温度上升峰面积逐渐下降。综合考虑,将70℃定为最佳的吸附温度。根据图3的结果,C5、C6化合物峰面积、总峰面积均在40 min后达到稳定,故吸附时间确定为40 min。
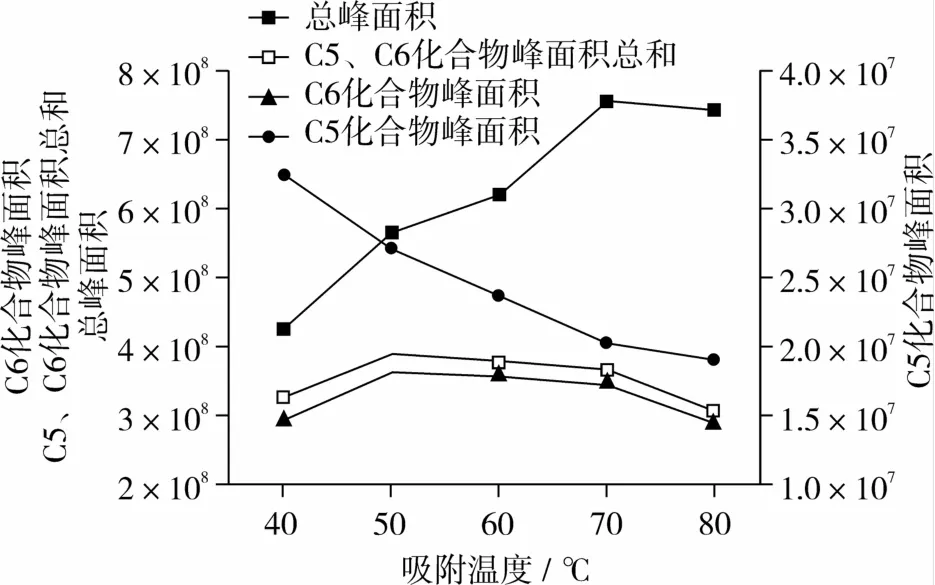
图2 吸附温度对SPME的影响

图3 吸附时间对SPME的影响
2.3 不同品种油橄榄的初榨橄榄油中挥发性风味成分的鉴定
按照优化后的SPME条件对初榨橄榄油挥发性成分进行GC-MS分离鉴定,得到初榨橄榄油香气成分的总离子流图(见图4)。除去少量分析时萃取头涂层和柱流失带来的硅氧烷类(典型碎片 m/z 208)和邻苯二甲酸酯类(典型碎片m/z 149)的杂质峰[10],在6个品种初榨橄榄油的香气中共分离鉴定出86种化合物,经鉴定并采用面积归一化法计算各成分的相对含量,结果列于表2。
图4 初榨橄榄油挥发性风味成分总离子流图

表2 国产初榨橄榄油挥发性风味成分鉴定及相对含量
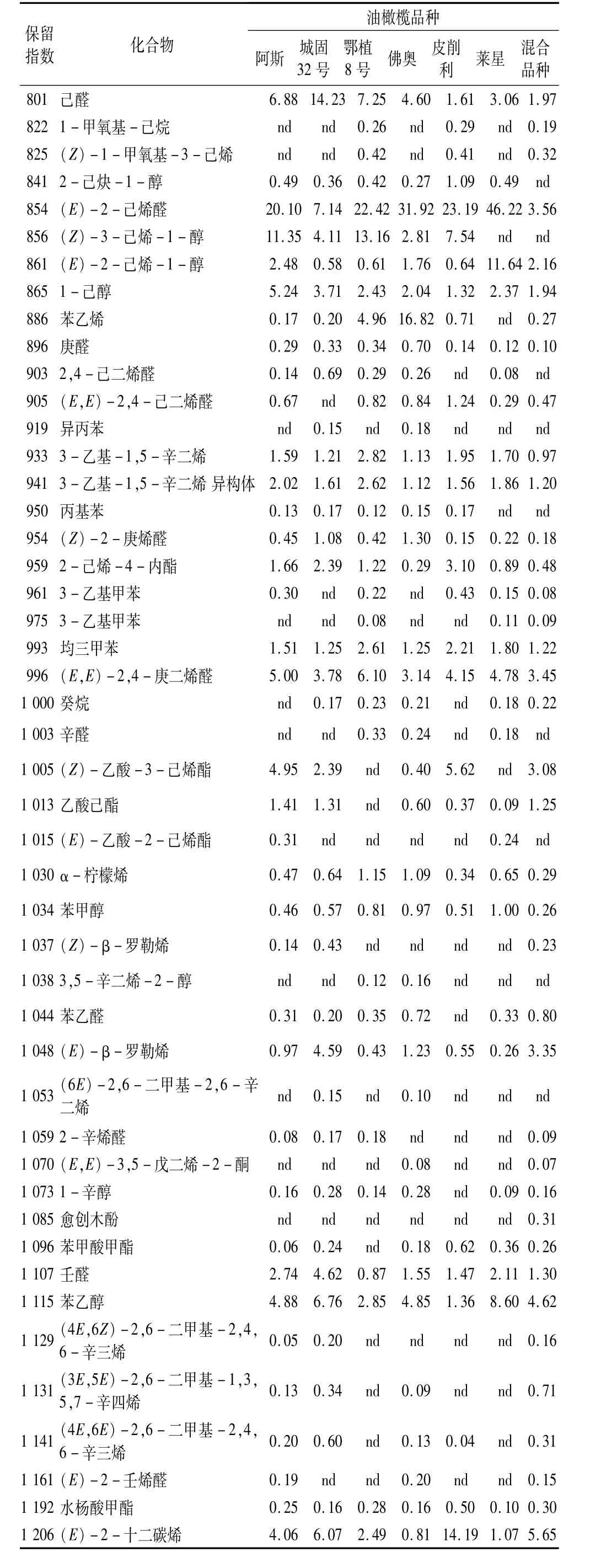
表2 (续)
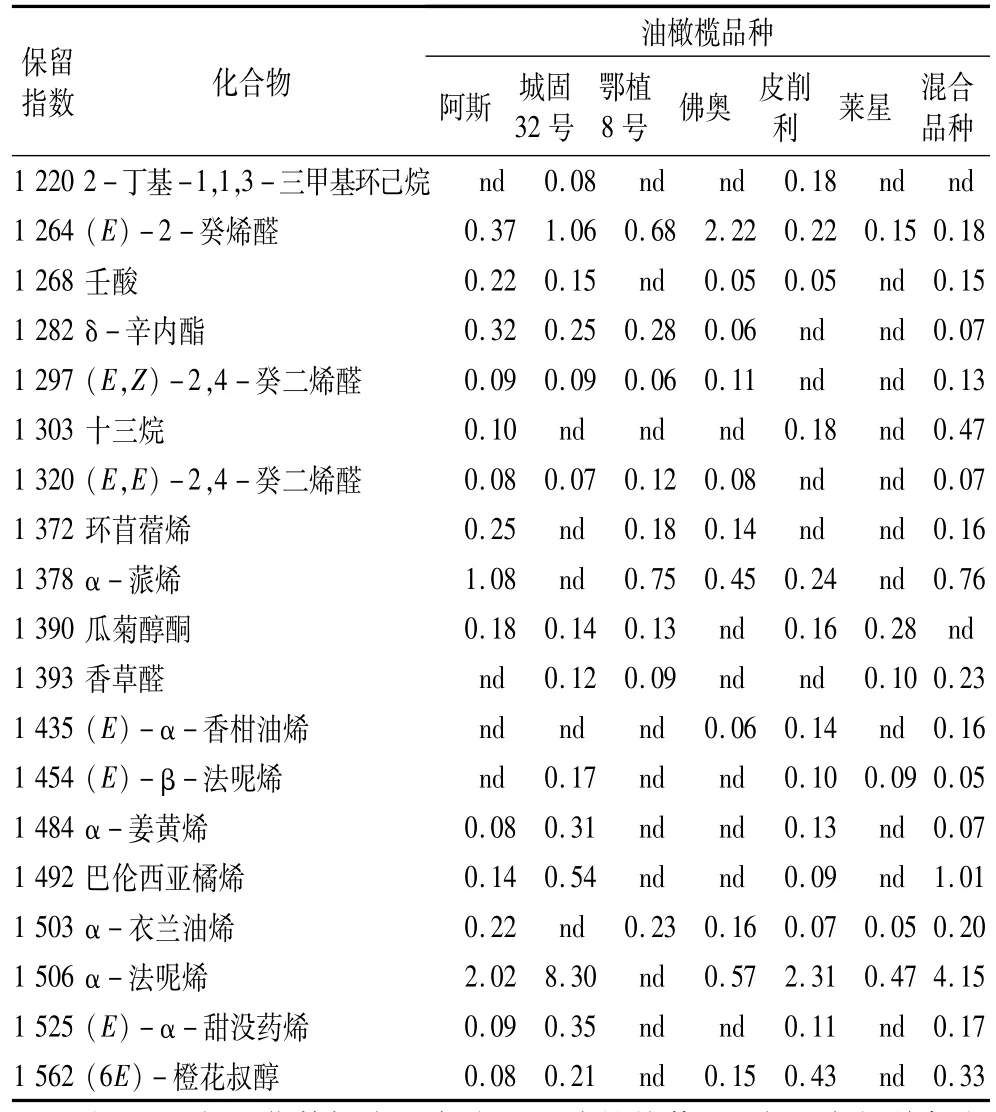
表2 (续)
从各品种香气的主要构成看(见图5),醛类是初榨橄榄油香气中最主要的化合物,占总香气成分的34.74%~58.22%。其中(E)-2-己烯醛(7.14%~46.22%)、己醛(1.61%~14.23%)、(E,E)-2,4-庚二烯醛(3.14%~6.10%)和壬醛(0.87%~4.62%)在各品种中含量相对较高,(Z)-3-己烯醛(3.89%)仅存在于皮削利的香气中。(Z)-3-己烯醛、己醛和(E)-2-己烯醛来源于脂氧合酶途径,是初榨橄榄油青草味、果香以及苦味的主要贡献者[11-12],其含量在各品种间差异很大,这是由于每个品种中合成这些C6醛类的酶活性或含量存在差别,而这种差别又是由其基因决定的[3,13-14]。除了城固32号,其他品种中(E)-2-己烯醛含量均高于己醛,这反映出在脂氧合酶途径中(E)-2-己烯醛/(E)-2-己烯醇支链相对于己醛/1-己醇支链的主导地位[15]。主要的醇类化合物有(Z)-3-己烯-1-醇(nd~13.16%)、(E)-2-己烯 -1-醇(0.58%~11.64%)和1-己醇(1.32%~5.24%),这些C6醇类是乙醇脱氢酶(ADH)催化相应醛的产物,具有新切的青草味和香蕉味[11-12]。值得注意的是,混合品种和莱星的香气中并未出现(Z)-3-己烯-1-醇,这与Angerosa等[15]对意大利境内该品种的研究结论相同。除了C6醇类,苯乙醇也以较高的含量(1.36%~8.60%)出现在所有品种中,这在以前研究欧洲橄榄油香气的文献中并未发现。酯类化合物如(Z)-乙酸-3己烯酯(nd~5.62%)、乙酸己酯(nd~1.41%)和(E)-乙酸 -2-己烯酯(nd~0.31%),这些酯都是乙醇酰基转移酶(AAT)催化相应底物酯化的结果,普遍较低的产物含量也说明了在所有品种中AAT的活性并不高。除了大部分来自脂氧合酶途径的化合物外,还有一些含量较高的烯烃和萜烯化合物被分离鉴定出。高水平的苯乙烯(佛奥16.82%)和(E)-2-十二碳烯(皮削利14.19%)在国外相关文献中鲜见报道过,其来源有待于进一步研究。此外还有一些萜烯类如(E)-β-罗勒烯(0.26%~4.59%)、α-柠檬烯(0.29%~1.15%)、α-蒎烯(nd~1.08%)和α-法呢烯(nd~8.30%)也被鉴定出,这些化合物的含量很大程度上取决于品种效应,可以作为橄榄油品种和产地的标记物[16-17]。
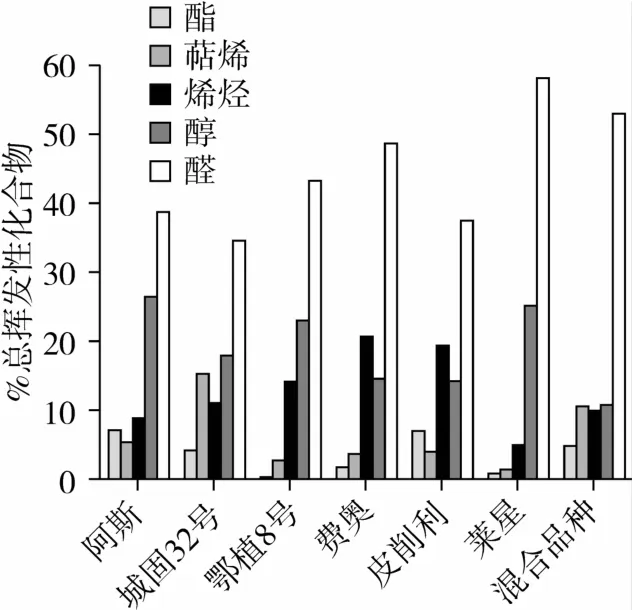
图5 不同品种香气的主要构成
2.4 西班牙初榨橄榄油中挥发性风味成分的鉴定
目前原装进口到中国的西班牙特级初榨橄榄油大多数来自混合品种油橄榄的果实,这些油橄榄有可能收购自不同的国家,提取得到油被称为商业特级初榨橄榄油,这种油在中国市场上形成了垄断。为了与国产初榨橄榄油区分,本试验在研究的6个油样中共鉴定出101种化合物,其中含量较高的化合物列于表3中。在这些油中乙酸(1.30%~6.50%)、乙酸乙酯(0.48%~2.79%)的质量分数高于国产初榨橄榄油(0.27%~1.47%、nd~0.25%),它们可能是酵母菌大量繁殖而产生的的代谢产物[3]。己醛(1.19%~2.46%)、(E)-2-己烯醛(1.76%~5.25%)的质量分数明显低于国产初榨橄榄油,尤其是(E)-2-己烯醛。除了单一品种皮库多外,混合品种的(Z)-乙酸-3-己烯酯的质量分数(7.53%~13.76%)都超过了国产初榨橄榄油,这种化合物具有绿色香蕉和绿叶的香气[11-12]。此外,值得注意的是,(E)-2-十二碳烯的质量分数(5.47%~34.75%)显著高于大多数国产初榨橄榄油。
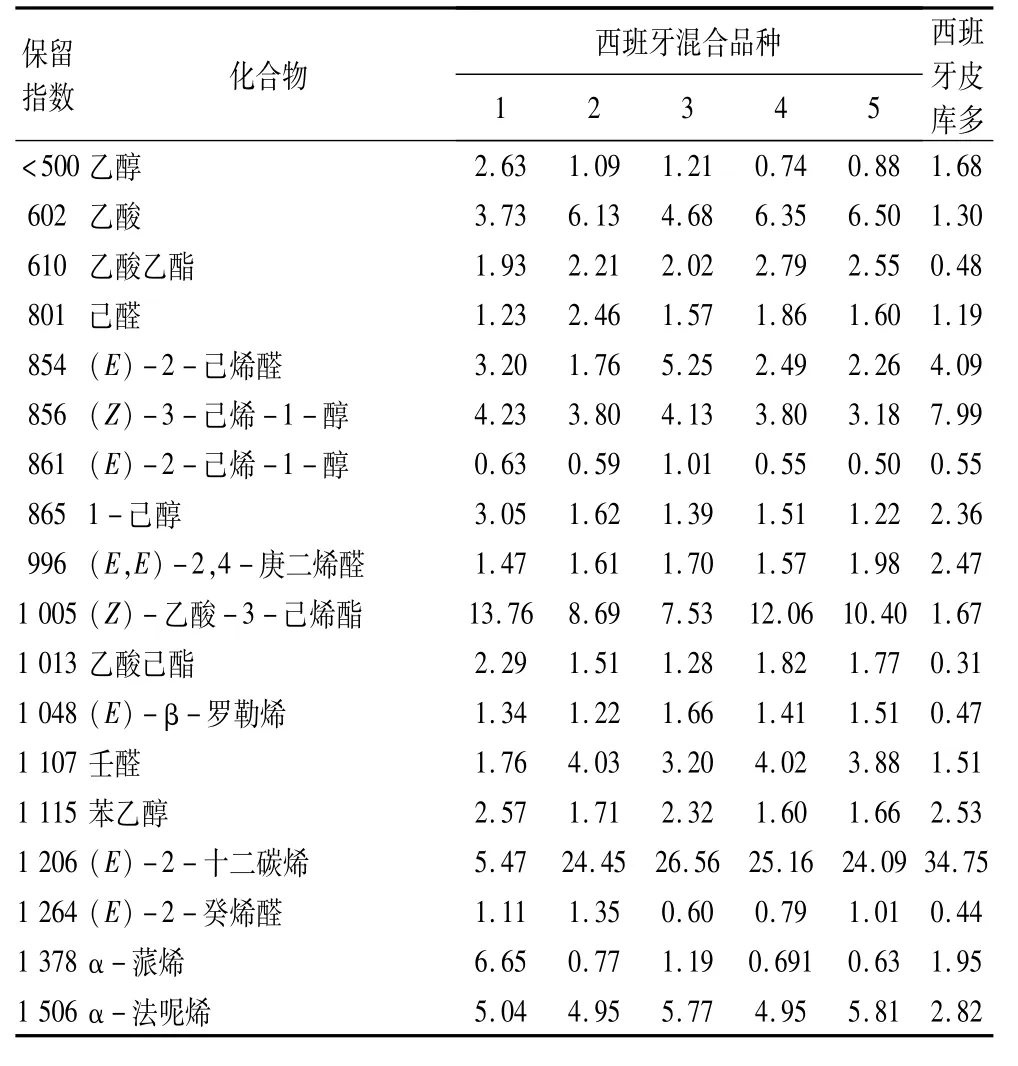
表3 西班牙特级初榨橄榄油主要挥发性风味成分鉴定及相对含量
3 结论
采用HS-SPME-GC/MS分离鉴定了武都初榨橄榄油、西班牙特级初榨橄榄油的挥发性风味成分。在7个不同品种的武都初榨橄榄油中共鉴定出86种化合物,主要是C6的醛和醇,以及它们相应的酯,还有一些烯烃和萜烯类化合物;在6个西班牙特级初榨橄榄油中共鉴定出101种化合物,其中的(E)-2-己烯醛的相对含量(1.76%~5.25%)低于国产初榨橄榄油(7.14%~46.22%),而(Z)-乙酸 -3-己烯酯(7.53%~13.76%)和(E)-2-十二碳烯(5.47%~34.75%)相对含量较高。试验结果还表明,初榨橄榄油挥发性成分很大程度上取决于油橄榄品种和产地。
[1]王贵禧,俞宁,邓明全,等.中国油橄榄发展概况[J].林业科技通讯,2000,1:32-34
[2]钟昌勇.橄榄油化学组成及应用综述[J].林产化工通讯,2005,39(6):34-38
[3]Angerosa F,ServiliM,Selvaggini R,et al.Volatile compounds in virgin olive oil:occurrence and their relationship with the quality[J].JChromatogr A,2004,1054(1):17-31
[4]邓丛静,于小飞,陈军,等.橄榄油加工工艺及品质评价[J].林产工业,2011,38(1):62-63
[5]GB/T 5530—2005/ISO 660—1996,动植物油脂 酸值和酸度测定[S]
[6]GB/T 5538—2005/ISO3960—2001,动植物油脂 过氧化值测定[S]
[7]GB/T 22500—2008/ISO3656—2002,动植物油脂 紫外吸光度的测定[S]
[8]Van Den Doolh,Dec Kratzp.A generalization of the retention index system including linear temperature programmed gasliquid partition chromatography[J].J Chromatogr,1963(11):463-471
[9]Zhang Z,Yang M J,Pawliszyn J.Solid-phase microextraction.A solvent-free alternative for sample preparation[J].Anal Chem,1994,66:844-853
[10]田怀香,王璋,许时婴.顶空固相微萃取-气相色谱-质谱法分离鉴定金华火腿的挥发性风味物质[J].色谱,2006,24(2):177-180
[11]Morales M T,Alonso M V,Rios J J,et al.Virgin olive oil aroma:relationship between volatile compounds and sensory attributes by chemometrics[J].JAgric Food Chem,1995,43(11):2925-2931
[12]Garcia-Gonzalez D L,Tena N,Aparicio R.Characterization of olive paste volatiles to predict the sensory quality of virgin olive oil[J].Eur JLipid Sci Technol,2007,109(7):663-672
[13]Kiritsakis A K.Flavor components of olive oil-A review[J].JAm Oil Chem Soc,1998,75(6):673-681
[14]Kalua CM,Allen M S,Bedgood Jr D R,etal.Olive oil volatile compounds,flavour development and quality:a critical review[J].Food Chem,2007,100(1):273-286
[15]Angerosa F,Basti C,Vito R.Virgin olive oil volatile compounds from lipoxygenase pathway and characterization of some Italian cultivars[J].J Agric Food Chem,1999,47(3):836-839
[16]Luna G.Characterisation of monovarietal virgin olive oils[J].Eur JLipid Sci Technol,2002,104:614-627
[17]Temime S B,Campeol E,Cioni P L,et al.Volatile compounds from Chétoui olive oil and variations induced by growing area[J].Food Chem.2006,99(2):315-325.
