两种PCV2抗体ELISA检测试剂盒检测效果比较
2014-05-30邱小伙阮系真金玉兰
邢 刚,邱小伙,阮系真,金玉兰
(浙江大学农业部动物病毒学重点实验室,浙江杭州310058)
2000年,郎洪武等(2000)[1]曾对北京、河北、山东、天津、江西等省市不同阶段猪群血清学调查发现PCV2(猪圆环病毒2 型)抗体阳性率高达42%,表明PCV2 在国内猪群中流行已很普遍;周继勇等(2004)[2]利用IFA 方法对浙江省内2000-2002年间的2039 份血清样本进行检测,发现浙江省内猪群中普遍存在PCV2 感染;随后的PCV2 流行病学调查表明:国内猪群的PCV2 感染已较普遍;不同地区不同生长阶段猪群的PCV2 抗体阳性率变化较大(10%~90%);公猪、母猪及育肥猪的抗体阳性率明显高于仔猪,血清学调查及临床症状表明在过去10年中,PCV2 已给中国的养猪业带来了严重影响[3]。
ELISA 检测技术由于其独特的优点已被广泛应用于猪群病原微生物抗体监测。本研究比较了国内市售两种PCV2 抗体ELISA 检测试剂盒的检测效果,以期为猪群PCV2 抗体水平监测选择合适的试剂盒提供参考。
1 材料与方法
1.1 试验材料 PCV2 ZJ/C 株由本实验室分离并保存,IFA 测定其TCID50为10-7.0/0.1 mL,PK-15 细胞Dulac 株由本实验室保存,MEM 培养基购自Invitrogen 公司(California,USA),脱脂奶粉购自上海某乳业股份有限公司,新生牛血清购自杭州某生物工程材料研究所,FITC 标记的羊抗猪IgG 购自KPL 公司(Maryland,USA)。
ELISA 检测试剂盒分别购自国内两家不同研发公司。分别命名为ZJ-ELISA、HB-ELISA。两种试剂盒均在有效期内。
1.2 试验方法
1.2.1 IFA 检测 对44 份临床血清进行间接免疫荧光方法(IFA)检测。
具体步骤:PCV2 ZJ/C 株按1%比例接入传代后的PK15 细胞悬液中,在37℃,含5%CO2的培养箱中培养至细胞长成单层;弃培养液,细胞用预冷的丙酮:甲醇(1∶1)混合液在-20℃下渗透和固定30 min,移去固定液并自然干燥后,每孔加入100 μL 5%脱脂奶,37℃下封闭45 min;弃封闭液,并用PBS洗涤3 次后,加入100 μL 分别用PBS 稀释100 倍和20 倍的待检猪血清,37℃下,孵育60 min,用PBS 清洗5 次后加入1 ∶400 倍稀释的FITC 标记羊抗猪IgG,37℃下避光温育30 min;PBS 洗涤5 次后,吸水纸上拍干,加入100 μL PBS,在倒置荧光显微镜下观察结果。
结果判定,样品作100 倍稀释时有特异性荧光者为阳性;样品在20 倍稀释时无特异荧光者为阴性;样品在100 倍稀释时无特异荧光者,而在20 倍稀释时有特异荧光者为弱阳性[4]。
1.2.2 ELISA 检测血清 利用两种试剂盒分别检测44 份临床血清,并判定其结果。
检测方法按试剂盒使用说明进行,具体步骤如下。
ZJ-ELISA 试剂盒检测方法:血清利用试剂盒自带稀释液稀释400 倍后,加样(100 μL/孔),37℃孵育30 min,洗涤5 次后,加酶标二抗,37℃孵育30 min 后再洗涤,加底物液,室温避光显色10 min,加终止液终止反应,用酶标仪于450 nm 波长测定OD值并计算S/P 值,反应设阳性,弱阳性,阴性对照。当S/P 值大于等于0.25 时,样品为阳性;小于等于0.16 时,则判定为阴性。
HB-ELISA 试剂盒检测方法:血清利用试剂盒自带稀释液稀释40 倍后,加样(100 μL /孔),37℃孵育30 min 后,洗涤5 次,加酶标二抗,37℃孵育30 min,再洗涤,加底物液,室温避光显色10 min,加终止液终止反应,用酶标仪于630 nm 波长测定OD值,反应设阳性,阴性对照。当OD 值大于0.42 时判为阳性;小于0.38 时,则判为阴性。
1.2.3 检测数据处理
S/P 值计算公式如下。
S/P 值= (样本平均值- 阴性对照平均值)/(阳性对照平均值-阴性对照平均值)。
临界值=阳性对照孔平均OD 值×0.25。
ELISA 检测方法与IFA 检测方法的阳性符合率、阴性符合率和总符合率计算公式如下。
阳性符合率=两种方法同时定性为阳性的血清份数/IFA 总阳性数。
阴性符合率=两种方法同时定性为阴性的血清份数/IFA 总阴性数。
总符合率=两种方法同时定性为为阳性或阴性样本数之和/检测总数。
配对卡方检验及Kappa 检验(一致性检验)利用SPSS 软件进行[5]。
2 结果与分析
2.1 符合率比较 详见表1~表3。
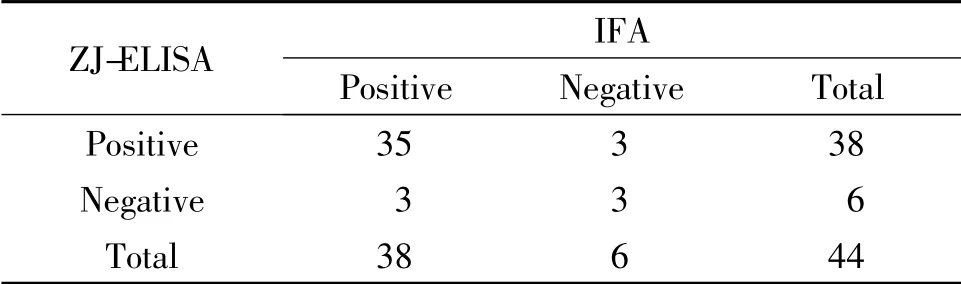
表1 ZJ-ELISA 与IFA 对44 份临床血清结果的比较
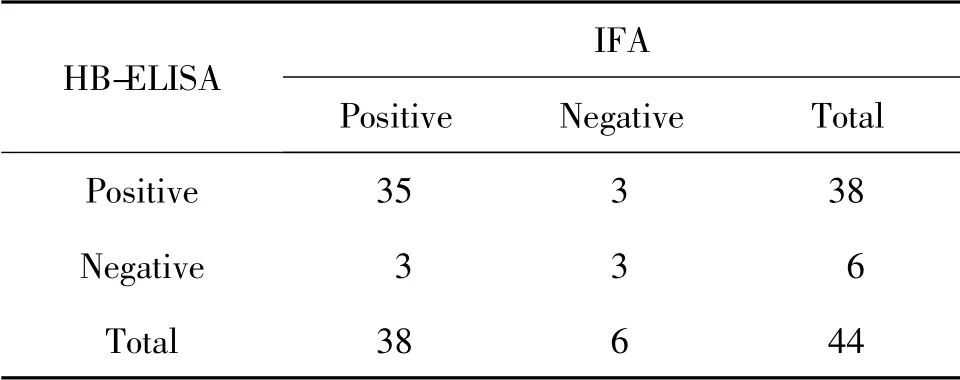
表2 HB-ELISA 与IFA 对44 份临床血清结果的比较
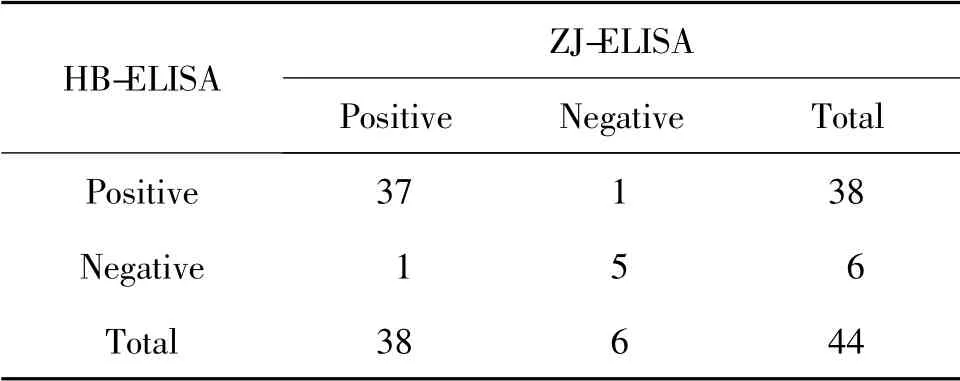
表3 HB-ELISA 与ZJ-ELISA 对44 份临床血清结果的比较
由表可见,对44 份血清检测后发现,IFA 阳性检出率为86.37%(38/44),阴性检出率为13.63%(6/44);ZJ-ELISA 检测试剂盒阳性检出率为86.37%(38/44),阴性检出率为13.63% (6/44);HB-ELISA 检测试剂盒阳性检出率为86.37%(38/44),阴性检出率为13.63%(6/44)。
ZJ-ELISA 检测试剂盒和HB-ELISA 检测试剂盒与IFA 检测方法的阳性符合率均为92.11%(35/38),阴性符合率均为50%(3/6),总符合率均为86.36%(38/44)(表1,表2)。
ZJ-ELISA 检测试剂盒和HB-ELISA 检测试剂盒间的阳性符合率为97.37%(37/38),阴性符合率为83.33%(5/6),总符合率均为95.45% (42/44)(表3)。
2.2 配对卡方检验及Kappa 检验 两种PCV2 抗体检测试剂盒与IFA 检测结果间的差异及两种试剂盒检测结果间的差异利用配对卡方检验方法(McNemar test)进行检验。其结果如下。
ZJ-ELISA 检测试剂盒和HB-ELISA 检测试剂盒与IFA 检测结果McNemar test 的P 值均为1,大于0.05,表明这几种方法的检测结果间差异不显著。ZJ-ELISA 检测试剂盒和HB-ELISA 检测试剂盒检测结果McNemar test 的P 值同样为1,大于0.05,表明这两种试剂盒的检测结果差异不显著。
两种PCV2 抗体检测试剂盒与IFA 检测结果的一致性及两种试剂盒检测结果间的一致性利用Kappa 检验方法进行检验。其结果如下。
ZJ-ELISA 检测试剂盒和HB-ELISA 检测试剂盒与IFA 检测方法的检测结果Kappa 值均为0.421,大于0.4,表明ELISA 检测方法与IFA 检测方法所得检测结果一致性一般。
上述两种ELISA 检测试剂盒的检测结果,Kappa 值均为0.807,大于0.75,表明这两种试剂盒检测结果一致性较好。
3 小结与讨论
PCV2 为目前猪群中广泛流行的一种病原微生物,给全世界养猪业带来了巨大的经济损失[6]。由PCV2 ORF2 编码的病毒衣壳蛋白(Cap 蛋白)是PCV2 的主要抗原,该蛋白大小为27.8 kDa,具有PCV2 特异性的抗原表位[7]。
有研究认为Cap 蛋白与断奶仔猪多系统衰竭综合征(PMWS)的发生有关,流行病学调查表明PCV2的致病性与Cap 蛋白存在有关[8]。
目前防治PCV2 感染主要通过接种疫苗。目前市场所售猪圆环病毒疫苗主要有勃林格殷格翰公司和先灵葆雅公司基于杆状病毒真核表达系统研制的PCV2 Cap 蛋白亚单位疫苗、法国梅里亚公司研制的PCV2 全病毒灭活苗、美国富道公司开发的PCV1/2嵌合病毒灭活疫苗等。
国产猪圆环病毒疫苗则有猪圆环病毒灭活疫苗LG 株,SH 株和ZJ/C 株,这些疫苗接种猪群后能诱导猪体产生针对PCV2 的中和抗体,且主要针对Cap蛋白。
临床检测该抗体水平的主要途径是通过相关ELISA 检测试剂盒。
本研究比较了国内不同生产厂家生产的两种PCV2 抗体ELISA 检测试剂盒。试剂盒均以PCV2 Cap 蛋白作为包被抗原,ELISA 检测试剂盒均为间接法。
研究以IFA 检测方法首先检测了44 份临床猪血清,并判定其阴阳性,然后利用这两种试剂盒,按照试剂盒说明书操作,分别检测了上述44 份血清样品。
检测结果表明,这两种试剂盒与IFA 检测方法相比,阳性检出率均为86.37%(38/44),阴性检出率均为13.63%(6/44),具有较高的符合率。
配对卡方检验及Kappa 检验表明PCV2 抗体检测试剂盒与IFA 检测结果差异不显著,一致性较好;两个试剂盒间的检测结果差异不显著且一致性非常好,阳性符合率为97.37%(37/38),阴性符合率为83.33%(5/6),总符合率为95.45%。
综上所述,国内市售试剂盒能很好用于对猪群进行PCV2 抗体监测。
[1]郎洪武,张广川,吴发权,等.断奶猪多系统衰弱综合征血清抗体检测[J].中国兽医科技,2000,30:3-5.
[2]周继勇,陈庆新,叶菊秀,等.猪圆环病毒2 型感染的血清学分析[J].中国兽医学报,2004,24:1-3.
[3]GE X N,WANG F,GUO X,et al.Porcine circovirus type 2 and its associated diseases in China [J].Virus Res,2012,164:100-6.
[4]陈庆新,商绍彬,叶菊秀,等.杭州地区猪II 型圆环病毒抗体的血清学调查[J].中国兽医科技,2003,33:26-28.
[5]唐洁,唐启义,程家安.病虫发生程度预报质量评估方法[J].昆虫知识,2006,43:410-413.
[6]MADSON D M,OPRIESSNIG T.Effect of porcine circovirus type 2 (PCV2) infection on reproduction:disease,vertical transmission,diagnostics and vaccination[J].Anim Health Res Rev,2011,12:47-65.
[7]MAHE D P,BLANCHARD C,TRUONG C,et al.Differential recognition of ORF2 protein from type 1 and type 2 porcine circoviruses and identification of immunorelevant epitopes[J].J Gen Virol,2000,81:1815-24.
[8]CHO H.S,KIM T J,LEE J I,et al.Park:Serodiagnostic comparison of enzyme-linked immunosorbent assay and surface plasmon resonance for the detection of antibody to porcine circovirus type 2 [J].Can J Vet Res,2006,70:263-8.
