维拉帕米对缺氧复氧心肌细胞自噬的影响
2014-05-28侯贞秀
侯贞秀,李 哲
心肌细胞在缺氧/复氧过程中有不同程度的自噬参与。在缺氧/复氧的不同阶段,自噬所起的作用不同。在缺氧期,自噬主要起保护作用,而复氧期则主要起损伤作用[1,2]。如何通过抑制自噬降低缺氧/复氧心肌细胞的死亡,提高其存活率,是目前研究的热点[3]。本文采用体外培养心肌细胞,建立缺氧/复氧模型,模拟在体缺血/再灌注损伤过程,从基因水平上观察心肌细胞在缺氧/复氧过程中给予维拉帕米后对心肌细胞的保护作用。为缺血/再灌注心肌细胞的进一步治疗提供帮助。
1 材料与方法
1.1 实验动物 购自博研(上海)生物科技有限公司。
1.2 主要药品与试剂 盐酸维拉帕米注射液购自上海禾丰制药有限公司;胎牛血清购自四季青,浙江天杭生物科技有限公司;DMEM 购自赛默飞世尔生物化学制品有限公司;Trizonal购自北京康为世纪生物科技有限公司;PCR 反转录试剂盒购自TaKaRa宝生物工程(大连)有限公司;PCR 引物由生物工程(上海)股份有限公司设计;3-MA 购自selleckchem 公司;连二亚硫酸钠购自sigma公司;DMSO 购自sigma公司;MTT(四氮唑蓝)Amresco公司;SYBR 染料购自北京全式金生物技术有限公司。主要仪器,LS-B50L型立式压力蒸气灭菌器:江阴滨江医疗设备厂L-550型台式低速大容量离心机:湖南湘仪离心机仪器有限公司;倒置显微镜:上海电子仪器厂二氧化碳培养箱:Heraeus公司;德国AB104-N 型电子天平:上海电子仪器厂;SW-CJ-2F超净工作台:苏州安泰空气技术有限公司Q-PCR仪:美国BIO-RAD公司。
1.3 乳鼠心肌细胞的培养 H9c2心肌细胞复苏后置于37℃,5%二氧化碳培养箱中培养,倒置相差显微镜下观察心肌细胞的形态,隔天用D-Hanks液为心肌细胞换液,生长至约80%时,传代培养,采用第3代~4代心肌细胞进行实验。
1.4 建立缺氧/复氧模型及实验分组 缺氧/复氧模型的建立[4]:采用连二亚硫酸钠化学法,用D-Hanks液将其配成浓度为18g/L,分装,置-20℃冰箱中保存,临用时稀释成终浓度为5mmol/L,加入DMEM 培养液中,制成缺氧液。用缺氧液换用正常培养基培养1h,模拟缺氧过程,再换用正常DMEM 培养液(复氧液)培养4h,模拟复氧过程。将培养第3代~4代传代心肌细胞随机分为5组,空白对照组:正常DMEM 培养基+胎牛血清培养;缺氧/复氧组[4]:将DMEM 培养液换成缺氧液培养1h,再换用复氧液培养4h,即为缺氧/复氧处理。缺氧/复氧+3-MA 组:在缺氧液中加入终浓度为5mmol/L[5]的3-MA 培养1h[6],再换用终浓度为5mmol/L的3-MA 复氧液培养4h。缺氧/复氧+维拉帕米组:在缺氧液中加入终浓度为1mg/L 的维拉帕米培养1h,再换用终浓度为1mg/L的维拉帕米复氧液培养4h。缺氧/复氧+3-MA+维拉帕米组:在缺氧液中加入终浓度为1mg/L的维拉帕米与终浓度为5mmol/L 的3-MA 共同培养1h,再换用含终浓度为1mg/L 的维拉帕米与终浓度为5 mmol/L的3-MA 复氧液共同培养4h。
1.5 MTT 法检测心肌细胞的存活率[7]采用对数生长期的心肌细胞(第3~4代心肌细胞),按上述分组方法进行分组,然后0.25%胰酶消化后用DMEM 培养液调成浓度为约5×104/mL的单细胞悬液,分配至96板孔中,每孔约100μL,每组设10个复孔,置于37℃,5%二氧化碳培养箱中培养24h后,吸弃上清液,加入MTT 工作液(5g/L),每孔约10μL;37℃,5%二氧化碳培养箱中继续培养4h,吸弃培养基,加入每孔200μLDMSO 终止反应,置于摇床上轻微震荡10min。在酶标仪570nm 波长下测定吸光度A 值。细胞存活率(survival rate SR):SR/%=(A 实验组/A 对照组)1)100%。
1.6 RT-PCR法检测Beclin-1、LC-3mRNA及Bcl-2mRNA的表达 采用Trizonal试剂法按照Trizonal试剂说明提取总RNA。MJ PCR 仪进行PCR 反转录,反转录液:总RNA2μL,RNAase Free dH2O 6μL,总量10μL,共配5 份;反转录程序:37℃15 min 85℃5s4℃1h,cDNA 置于1 mL EP 管中。RT-PCR 反应液体系:Template 2μL,上游引物0.4μL,下游引物0.4μL,21)mix 10μL,ddH2O 7.2μL,总体积20μL,共配体系20份。总体系配好后,用枪吸打均匀,54μL 每份中加入6μL 模板,分装至8连管中,每组设3个复孔。实验采用β-actin作为内参,置于qPCR 仪中,程序:94℃30s,94℃5s,60℃30s,95℃1h,55℃1h,55℃20s,共扩增45个循环。
1.7 统计学处理 采用SPSS 16.0统计软件处理,定量资料采用均数±标准差描述,多组间均数比较采用单因素方差分析,两两比较采用LSD-t检验。检验水准α=0.05。
2 结 果
2.1 对心肌细胞存活率的影响 与正常对照组相比,缺氧/复氧组心肌细胞存活率降低(P<0.05),与缺氧/复氧组相比,维拉帕米组,3-MA 组,维拉帕米组+3-MA 组心肌细胞存活率均增高(P<0.05)。详见表1。
表1 5组心肌细胞存活率的比较
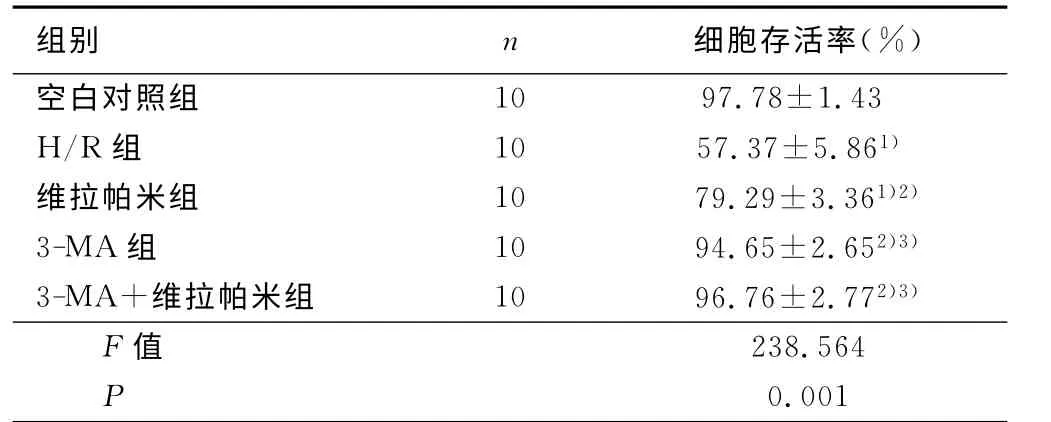
表1 5组心肌细胞存活率的比较
与空白对照比较,1)P<0.05;与H/R 组比较,2)P<0.05;与维拉帕米组比较,3)P<0.05
?
2.2 Beclin-1、LC-3 及Bcl-2mRNA 的 表 达 RT-PCR 结 果 显示:与 空 白 对 照 组 相 比,缺 氧/复 氧 组Beclin-1、LC-3 mRNA表达量均上调(P<0.0 5),Bcl-2mRNA的表达下降(P<0.05);3-MA 组,维拉帕米组及3-MA 组+维拉帕米组Beclin-1、LC-3mRNA 表 达 量 均 下 降(P <0.05),3-MA 组,维 拉 帕米组及3-MA组+维拉帕米组Bcl-2mRNA的表达增加(P<0.05)。与缺氧/复氧组相比,3-MA 组,维拉帕 米组,3-MA组+维拉帕米组Beclin-1、LC-3mRNA表达量均下降(P<0.05),维拉帕米组及3-MA 组+维拉帕米组Bcl-2mRNA表达均上调(P<0.05),3-MA 组Bcl-2mRNA 无明显变化。详见表2。
表2 3种基因的值比较
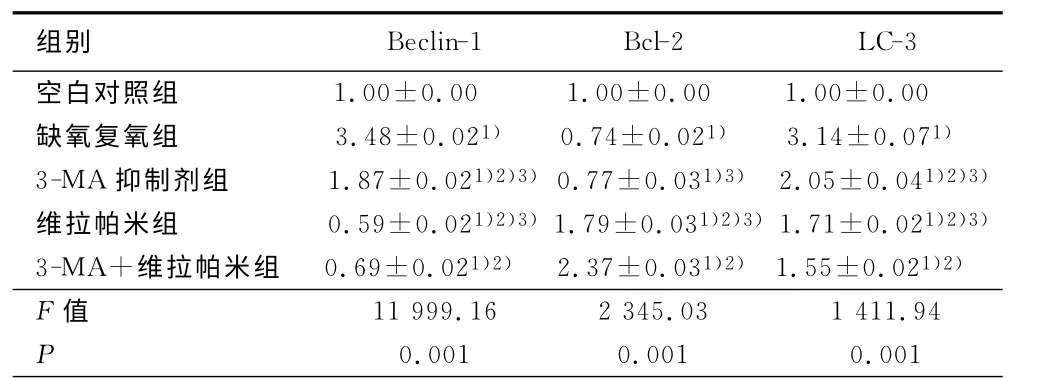
表2 3种基因的值比较
与空白对照比较,1)P<0.05;与缺氧复氧组比较,2)P<0.05;与3-MA+维拉帕米组比较,3)P<0.05
组别Beclin-1 Bcl-2 LC-3空白对照组 1.00±0.00 1.00±0.00 1.00±0.00缺氧复氧组 3.48±0.021) 0.74±0.021) 3.14±0.071)3-MA 抑制剂组 1.87±0.021)2)3)0.77±0.031)3) 2.05±0.041)2)3)维拉帕米组 0.59±0.021)2)3)1.79±0.031)2)3)1.71±0.021)2)3)3-MA+维拉帕米组 0.69±0.021)2) 2.37±0.031)2)1.55±0.021)2)F 值 11 999.16 2 345.03 1 411.94 P 0.001 0.001 0.001
3 讨 论
近年来,与传统死亡方式凋亡相比,人们更加关注Ⅱ型程序性死亡方式自噬[8]。自噬的发生是首先形成自噬体,然后自噬体与溶酶体融合形成自噬溶酶体,最后降解其所包裹的内容物。其中,自噬发生的重要环节在于自噬体的形成[9]。自噬体的形成需要多种自噬相关基因(Atg)的参与[9],如:Beclin-1(酵母Atg6的同源),Atg5,Atg16,Atg,12,Atg8(LC-3的同源)等。雷帕霉素通路(mTOR 通路)及Bcl-2/Beclin-1通路是两条熟知的自噬信号调节通路。在自噬体调节过程中,Atg12-Atg5-Atg16可与LC-3及Atg9一起被转运至自噬泡,参与自噬泡的扩展。同时,磷脂酰激酶3(PI3K)可与Beclin1结合,形成复合体负责调控自噬体膜的凝集,并包裹蛋白质,蛋白质复合体及细胞器。Bcl-2/Beclin-1 通 路 中,Bcl-2 可 通 过 结 合 并 抑 制PI3K复合体的重要组成成分Beclin-1来抑制这一过程。而3-MA 作为一种非特异性的PI3K 抑制剂,参与抑制自噬体形成的过程[10]。
在细胞自噬的诱导和调节过程中,许多刺激因子均可以诱导细胞产生自噬,如营养缺乏、缺血、缺氧、细胞内钙超载、氧化应激及内质网应激等。缺氧/复氧损伤可以导致心肌细胞钙超载,而钙离子拮抗剂维拉帕米可通过拮抗钙超载从而保护心肌细胞[11]。
自噬在缺氧/复氧过程中的调节起“双刃剑”作用。在缺氧过程中,通过Beclin-1、Atg5,LC-3等的上调激活自噬,起保护作用,而在再灌注过程中,自噬测过度表达则影响细胞的存活率。
本实验成功建立体外缺氧/复氧模型,模拟在体缺血再灌注损伤过程。通过预实验发现不同浓度维拉帕米对缺氧/复氧心肌细胞存活率影响不同,表明浓度为1mg/L 的维拉帕米较其他浓度对缺氧/复氧心肌细胞存活率高。提示适宜浓度维拉帕米预处理可发挥对缺氧/复氧损伤心肌细胞的保护作用。而自噬抑制剂3-MA 在 复 氧 时 使 用,使Beclin-1、LC-3 mRNA 表 达量下降,同时,提高了细胞的存活率,而维拉帕米使Bcl-2 mRNA 表达量增加,Beclin-1、LC-3 mRNA 表达量下降,自噬抑制剂3-MA 合用维拉帕米可使Bcl-2 mRNA 表达量增加,与单用维拉帕米差异无统计学意义,Beclin-1、LC-3 mRNA 表达量下降,差异有统计学意义。表明维拉帕米可能通过Bcl-2/Beclin-1通路抑制LC-3的表达,提高缺氧/复氧心肌细胞的存活率,从而保护心肌细胞。维拉帕米处理对缺氧/复氧心肌细胞有保护作用,推测Bcl-2/Beclin-1 通路在其保护机制中发挥重要作用。其具体机制有待进一步研究。
[1] Matsui Y,Takagi H,Qu X,et al.Distinct roles of autophagy in the heart during ischemia and reperfusion:Roles of AMP-activatde protein kinase and Beclin 1in mediating autophagy[J].Circ Res,2007,100(6):914-922.
[2] 何云凌,吴丽颖,朱玲玲,等.线粒体自噬在低氧适应中的作用[J].生物化学与生物物理进展,2012,39(3):217-223.
[3] Delong MJ.Apoptosis:A modulator of cellural homeostasis and disease states[J].Ann NY Acad Sic,1998,842:82-90.
[4] 潘志伟,王秋娟,柳仁民,等.淫羊藿苷预适应对乳鼠心肌细胞的保护作用[J].中国药科大学学报,2007,8(1):73-76.
[5] Ng G,Huang J.The significance of autophagy in cancer[J].Mol Carcinog,2005,43(4):183-187.
[6] Bao Xiaoxia,Xie Bushan.Nifedipine induced autophagy through Beclin1and mTOR pathway in endometrial carcinoma cells[J].Chin Med J,2012,125(17):3120-3126.
[7] 刘琴,李凌云,乔世刚,等.七氟烷预处理对缺氧/复氧损伤的H9c2心肌细胞LC3蛋白表达的影响[J].苏州大学学报,2011,31(1):39-42.
[8] Ferrari R,Agnoletti L,Comini L,et al.Oxidative stress during myocardial ischemia and heart failure[J].Eur Heart J,1998,19:B2-11.
[9] 肖健,何斌,朱晓燕,等.缺血再灌注损伤诱导心肌细胞自噬相关基因过表达[J].第二军医大学学报,2011,7(32):776-778.
[10] 马芹芹,刘立亚,黄秀兰.Beclin 1 与mTOR 对心肌缺血/再灌注损伤中自噬的交互调控机制[J].心脏杂志,2012,24(3):395-397.
[11] 郑付春,黄展勤,石刚刚.钙拮抗剂对缺氧/复氧心肌细胞早期生长反应基因的作用及抗损伤的研究[J].中国药理学通报,2011,27(6):777-781.
