他莫昔芬体外促进HepG2细胞脂肪变性观察*
2014-05-25姜佳丽张令强展玉涛
赵 斐,谢 萍,姜佳丽,张令强,安 威,展玉涛
·酒精性肝病·
他莫昔芬体外促进HepG2细胞脂肪变性观察*
赵 斐,谢 萍,姜佳丽,张令强,安 威,展玉涛
目的研究他莫昔芬(TAM)对体外培养的HepG2细胞脂肪变性以及脂类代谢调控关键因子表达的影响。方法应用油酸(50 μmol/L)处理HepG2细胞,诱导细胞脂肪变性体外模型,同时给予不同浓度的TAM(5~20 μmol/L)干预72 h;采用油红O染色和甘油三酯含量测定检测HepG2细胞内脂质聚集情况;应用蛋白印迹法检测固醇调节元件结合蛋白-1c(SREBP-1c)、脂肪酸合成酶(FAS)、硬脂酰辅酶A去饱和酶(SCD)、肉酯软脂酰基转移酶(CPT1)和微粒体甘油三酯转移蛋白(MTP)的表达;采用细胞活性检测试剂盒测定细胞活性。结果在干预72 h后,模型组细胞内甘油三酯含量为(16.53±0.17)mg/100 mg蛋白质,在5 μmol/L TAM处理细胞内甘油三酯含量为(17.77±0.05)mg/100mg蛋白质,与模型组无显著性差异,但在10 μmol/L和20 μmol/L TAM处理组较模型组分别增加了31%[(21.57±0.16)mg/100 mg蛋白质]和44%[(23.82±0.44)mg/100 mg蛋白质],(P<0.05);TAM上调细胞内SREBP-1c、FAS、SCD和MTP蛋白表达,但并不改变CPT1蛋白表达;TAM在5~20 μmol/L范围内不影响HepG2细胞活性。结论TAM可促进油酸诱导的HepG2细胞脂肪变性,其主要机制可能是通过上调SREBP-1c及其下游基因,如FAS和SCD的表达而增加了脂肪酸的合成。
HepG2细胞;他莫昔芬;脂肪变;甘油三酯;脂肪酸合成
乳腺癌是世界上女性最常见的恶性肿瘤[1],主要分为雌激素受体阳性(约占75%)和雌激素受体阴性乳腺癌两种类型[2]。他莫昔芬(tamoxifen,TAM)是治疗雌激素受体阳性乳腺癌的“金标准”药物[3],在临床上应用十分广泛。然而,长期使用TAM会产生一系列的副作用,其中引起非酒精性脂肪性肝病(NAFLD)最常见[4]。有资料显示,TAM治疗的女性乳腺癌患者有43%在治疗的前2年内出现脂肪肝或脂肪性肝炎,尤其是一些超重的女性,甚至会出现肝硬化[5]。因此,明确TAM促进NAFLD发生的机制,对于防治TAM引起的NAFLD具有重要意义。目前,一些针对TAM引起NAFLD机制的研究主要是在动物实验,而且结果不一。在本研究中,我们运用体外肝细胞脂肪变性模型直接探索了TAM对HepG2细胞脂肪变性的影响及其可能的机制。
1 材料与方法
1.1 细胞与试剂人肝癌细胞株HepG2细胞(北京地坛医院传染病学研究所惠赠);DMEM培养基和胎牛血清(Hyclone公司);0.25%胰酶(Gibco公司);TAM、油红O和二甲基亚砜(Sigma公司);甘油三酯检测试剂盒和蛋白定量检测试剂盒(Bioassay公司);细胞活性检测试剂盒(Cell Counting Kit-8,CCK-8,日本同仁化学研究所);抗固醇调节元件结合蛋白-1c(sterol regulatory element-binding protein-1c,SREBP-1c)抗体、抗硬脂酰辅酶A去饱和酶(stearoyl-CoA desaturase,SCD)抗体、抗肉酯软脂酰基转移酶(carnitine palmitoyltransferase 1,CPT1)抗体和抗微粒体甘油三酯转移蛋白(microsomal triglyceride transfer protein,MTP)抗体(Abcam公司);抗脂肪酸合成酶(fatty acid synthase,FAS)抗体和相关二抗(Santa Cruz公司);抗甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(MBL公司)。
1.2 细胞脂肪变性模型的建立和TAM干预实验取HepG2细胞,以含10%胎牛血清的DMEM培养基培养于37℃,5%CO2的细胞培养箱中。选择终浓度为50μM的油酸(oleic acid,OA)培养72 h,以诱导细胞脂肪变性。设模型组和TAM干预组。根据实验的需要,将细胞铺于不同规格的细胞培养板或培养瓶中,在接种细胞24 h后,将正常完全培养基更换为高脂培养基(OA=50 μM),同时分别加入终浓度为0、5、10和20 μmol/L的TAM,培养72 h,收集细胞。
1.3 细胞内脂滴形成的观察将细胞接种于6孔板内,同时放入小盖玻片,制作细胞爬片,按上述方法分组处理细胞72 h后,采用油红O染色,观察细胞内的脂滴形成情况。以PBS冲洗细胞3次,10%中性甲醛固定5 min,加油红O染液浸染15 min,60%异丙醇洗去多余染液,苏木素染核1min,蒸馏水洗去多余的染色液,甘油明胶封片。在显微镜下观察细胞内的脂滴情况,摄像。
1.4 细胞内甘油三酯质量分数测定将细胞培养于培养瓶中,按上述方法分组处理72h,收集细胞,用胰酶消化后离心,取细胞沉淀,PBS洗涤2~3次,加入等渗缓冲液400μL,超声破碎细胞,取破碎好的匀浆液进行测定。取10μL标准品和样品,分别放入96孔板,每组设3个平行孔,在各孔中加入100μL配制好的工作试剂,室温孵育30 min,于570 nm读取吸光度。根据标准曲线,计算每组甘油三酯质量分数,同时用蛋白质定量试剂盒测定各组细胞样品中蛋白质质量分数,对结果进行标准化(mg/100mg蛋白质)。
1.5 脂类代谢关键调节因子蛋白表达的检测采用免疫印迹法,收集细胞,加入适量的细胞裂解液及等量的2×Sample buffer混和,100℃沸水煮10 min,进行SDS-PAGE电泳。切下含目的条带的SDS变性胶,将蛋白转移到硝酸纤维素膜上,进行电转移,随后在含有5%脱脂牛奶的TBST缓冲液中封闭60 min。封闭后,加一抗孵育,4℃过夜,再用TBST缓冲液洗膜3次,每次10 min。然后加耦联HRP的二抗,室温孵育1 h,最后经TBST洗膜3次,加入底物化学发光试剂,于暗室中进行X光片曝光显影。
1.6 细胞活性检测以CCK-8法检测细胞活性,即将密度为1×105/mL细胞以100μL/孔接种于96孔板,每组设6个平行孔,按上述方法分组处理72 h,更换培养基为包含10μL CCK-8溶液的完全培养基,于37℃,5%CO2的细胞培养箱中孵育1 h,在450 nm读取吸光度。数据以A450(他莫昔芬干预组+模型组)-A450(空白)表示。
2 结果
2.1 TAM促进OA诱导的细胞内脂肪形成在光学显微镜下观察,可见HepG2细胞为不规则或卵圆形,胞浆内可见散在的红色脂滴,经不同浓度的TAM(0、5、10和20μmol/L)干预后,可见胞浆内红色脂滴数目增加,并且随药物浓度的增加呈现剂量依赖效应(图1~4)。
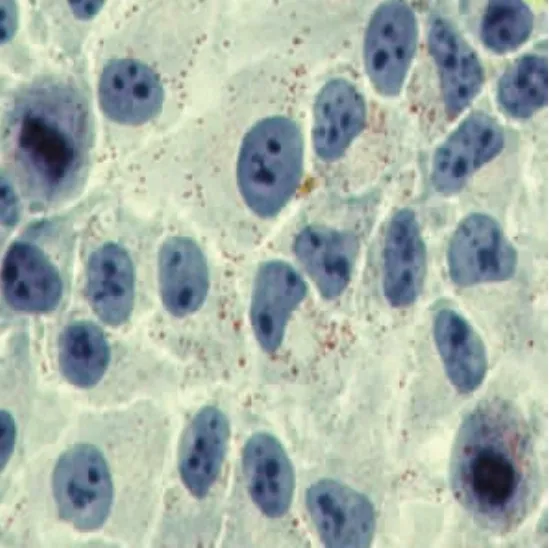
图1 模型组HepG2细胞内脂滴形成(油红O染色,400×)
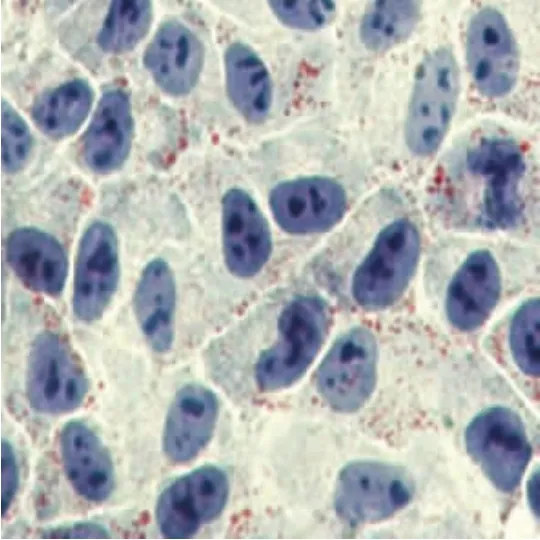
图2 5μM TAM干预72 h后HepG2细胞内脂滴形成(油红O染色,400×)

图3 10μM TAM干预72 h后HepG2细胞内脂滴形成(油红O染色,400×)

图4 20μM TAM干预72 h后HepG2细胞内脂滴形成(油红O染色,400×)
2.2 TAM增加细胞内甘油三酯质量分数在5μM TAM干预72 h后,HepG2细胞内甘油三酯质量分数(17.77±0.05)mg/100mg蛋白质较模型组(16.53±0.17)mg/100mg蛋白质略有增加,但差异无统计学意义(P>0.05)。在10μM~20μM TAM干预72 h后,甘油三酯质量分数较模型组分别增加了31%和44%[分别为(21.57±0.16)mg/100 mg蛋白质和(23.82±0.44)mg/ 100 mg蛋白质],与模型组比,差异有统计学意义(P<0.05)。
2.3 TAM对甘油三酯代谢相关分子蛋白表达的调节作用SREBP-1c是调控肝脏脂肪酸合成的重要转录因子,可促进一系列脂类合成相关基因的表达,包括FAS和SCD等。蛋白印迹检测结果显示(图5),TAM干预上调了SREBP-1c的表达,并且作用呈剂量依赖性。与此相一致的是,FAS和SCD蛋白表达增加也呈现相似的效应。同时,CPT1表达无明显变化,而MTP表达上调。

图5 不同浓度TAM干预后HepG2细胞SREBP-1c、FAS、SCD、CPT1和MTP蛋白表达
2.4 TAM对HepG2细胞活性的影响经5~20μM TAM干预后HepG2细胞活性与模型组相比差异无统计学意义(P>0.05),表明我们所使用浓度范围内的TAM干预对HepG2细胞的数量无明显影响,排除了各组甘油三酯质量分数的差异是由细胞数量不同所致的可能性。然而,我们还观察到更高浓度(大于20μM)的TAM可对HepG2细胞产生毒性作用,抑制其增殖(数据未列出)。
3 讨论
TAM是一种非类固醇类雌激素受体拮抗剂,作为乳腺癌内分泌治疗金标准的药物应用于临床已超过30年,但长期服用TAM也会产生一系列的毒副作用,包括低血糖症、高甘油三酯血症、血浆胆固醇水平改变以及一些肝脏疾病[4]。临床研究表明TAM治疗与NAFLD的发生有关[6],动物实验也进一步证实TAM可诱发NAFLD[7]。在本研究中,我们通过体外实验证实了TAM可促进细胞脂肪变性。
NAFLD以肝细胞内脂肪即甘油三酯积聚为主要特征,包括单纯性脂肪肝、脂肪性肝炎及其相关的肝硬化。关于NAFLD发病机制,目前国内外普遍认可的是Day和James提出的“二次打击”学说[8]。固醇调节元件结合蛋白属于核转录因子家族,有三个成员:即SREBP-1a、SREBP-1c和SREBP-2[9]。SREBP-1c是调控肝脏脂肪酸合成的主要亚型(90%)[10]。SREBP-1c可激活脂肪酸合成的关键酶基因,包括ATP柠檬酸裂解酶、乙酰辅酶A羧化酶、FAS、SCD及甘油-3-磷酸酰基转移酶等[11]。目前,关于TAM对动物肝脏SREBP-1c及其下游基因影响的研究,其结果不同。Lelliott等发现在TAM处理过的大鼠肝脏SREBP1 mRNA水平无变化,而FAS和SCD mRNA水平下降[7]。经TAM处理后FAS mRNA水平上升200%,但蛋白表达未改变,而SCD mRNA水平下降60%[5]。Gudbrandsen等认为TAM并不影响大鼠肝脏SCD活性及其mRNA水平,但TAM可以使FAS活性下降,并且下调FAS mRNA水平[12]。我们研究发现,TAM可以增加HepG2细胞SREBP-1c、FAS和SCD蛋白表达。我们推测,TAM可能是通过提高SREBP-1c转录活性,进一步上调其下游脂肪生成基因的表达,从而导致细胞内甘油三酯积聚。
TAM增加肝细胞内脂质积累与线粒体脂肪酸β氧化受阻有关吗?CPT1是线粒体脂肪酸β氧化的限速酶[13]。Cole等认为TAM对小鼠肝脏CPT1 mRNA水平无显著影响[5]。TAM不会改变肝脏β氧化降解物乙酰辅酶A和丙酰辅酶A水平[12]。在目前的体外研究中,我们也没有发现TAM对于HepG2细胞CPT1蛋白表达有影响。因此,TAM可能不是通过抑制线粒体脂肪酸β氧化加速肝细胞中甘油三酯积聚的。
有研究显示,TAM处理后肝脏甘油三酯水平升高并伴随着血清甘油三酯水平下降[12]。脂肪酸能够通过酯化作用转变成甘油三酯,以VIDL的形式分泌出细胞。载脂蛋白B100是VLDL最重要的蛋白组分。MTP是VLDL组装和分泌的关键因子,它可结合甘油三酯等多种脂质分子,并将这些脂质呈递给载脂蛋白B100[14]。在本研究中,我们发现TAM不会抑制HepG2细胞MTP表达。因此,我们认为TAM引起的HepG2细胞甘油三酯积聚可能与VLDL的组装和分泌无关。相反的是,我们观察到TAM可以增加HepG2细胞中MTP蛋白表达,可能是由于TAM引起甘油三酯积聚,通过反馈调节机制刺激了MTP的表达。
[1]Boyle P.Triple-negative breast cancer:epidemiological considerations and recommendations.Ann Oncol,2012,23(Suppl 6):vi7-vi12.
[2]Harrell JC,Dye WW,Harvell DM,et al.Estrogen insensitivity in a model of estrogen receptor positive breast cancer lymph node metastasis.Cancer Res,2007,67(21):10582-10591.
[3]Tomao F,Spinelli G,Vici P,et al.Current role and safety profile of aromatase inhibitors in early breast cancer.Expert Rev Anticancer Ther,2011,11(8):1253-1263.
[4]Lee MH,Kim JW,Kim JH,et al.Gene expression profiling of murine hepatic steatosis induced by tamoxifen.Toxicol Lett,2010,199(3):416-424.
[5]Cole LK,Jacobs RL,Vance DE.Tamoxifen induces triacylglycerol accumulation in the mouse liver by activation of fatty acidsynthesis.Hepatology,2010,52(4):1258-1265.
[6]Akhondi-Meybodi M,Mortazavy-Zadah MR,Hashemian Z,et al.Incidence and risk factors for non-alcoholic steatohepatitis in females treated with tamoxifen for breast cancer.Arab J Gastroenterol,2011,12(1):34-36.
[7]Lelliott CJ,López M,Curtis RK,et al.Transcirpt and metabolite analysisoftheeffectsoftamoxifeninratliverreveals inhibition of fatty acid synthesis in the presence of hepatic steatosis.FASEB J,2005,19(9):1108-1119.
[8]Tilg H,Moschen AR.Evolution of inflammation in nonalcoholic fattyliverdisease:themultipleparallelhitshypothesis. Hepatology,2010,52(5):1836-1846.
[9]张艳,郭传勇.非酒精性脂肪性肝病发病机制及其相关基因研究进展.实用肝脏病杂志,2013,16(4):375-377.
[10]Pettinelli P,Obregón AM,Videla LA.Molecular mechanisms of steatosis in nonalcoholic fatty liver disease.Nutr Hosp,2011,26(3):441-450.
[11]Strable MS,Ntambi JM.Genetic control of de novo lipogenesis:role in diet-induced obesity.Crit Rev Biochem Mol Biol,2010,45(3):199-214.
[12]Gudbrandsen OA,Rost TH,Berge RK.Causes and prevention of tamoxifen-induced accumulation of triacylglycerol in rat liver.J Lipid Res,2006,47(10):2223-2232.
[13]Serviddio G,Giudetti AM,Bellanti F,et al.Oxidation of hepatic carnitine palmitoyl transferase-I(CPT-I)impairs fatty acid beta-oxidation in rats fed a methionine-choline deficient diet. PLoS One,2011,6(9):e24084.
[14]OliveiraCP,StefanoJT,CavaleiroAM,etal.Associationof polymorphismsofglutamate-cysteinligaseandmicrosomal triglyceride transfer protein genes in non-alcoholic fatty liver disease.J Gastroenterol Hepatol,2010,25(2):357-361.
(收稿:2013-10-15)
(校对:陈从新)
Tamoxifenpromotes lipidaccumulationinHepG2 cells invitro
Zhao Fei,Xie Ping,Jiang Jiali,et al.
Department of Gastroenterology,Tongren Hospital,Capital Medical University,Beijing 100730,China
ObjectiveTo investigate the effect of tamoxifen(TAM)on steatosis in HepG2 cells in vitro and on the expression of key regulators involved in lipid metabolism in the cells.MethodsA cell model of steatosis was induced in HepG2 cells in vitro with oleic acid(OA)at 50 μmol/L;HepG2 cells were then subjected to different concentrations of TAM(5 to 20 μmol/L)at the presence of OA for 72 h;Intracellular lipid accumulation was assessed by oil red O staining and measurement of triglyceride;The expression of sterol regulatory elementbinding protein-1c(SREBP-1c),fatty acid synthase(FAS),steroyl-CoA desaturase(SCD),carnitine palmitoyltransferase 1(CPT1)and mitochondrial trifunctional protein(MTP)was determined by Western blot;Cell viability was detected by cell counting Kit-8 assay.ResultsAfter incubation for 72 h,the intracellular triglyceride in control group was(16.53±0.17)mg/100 mg protein,similar to that of cells treated with 5μmol/L TAM,however,the intracellular triglyceride was increased by 31%[(21.57±0.16)mg/100 mg protein]and 44%[(23.82±0.44)mg/100 mg protein]in cells treated with 10 μmol/L and 20 μmol/L of TAM,respectively(P<0.05);TAM treatment(5 to 10 μmol/L)significantly increased the expression of SREBP-1c,FAS,SCD and MTP without affecting the expression of carnitine palmitoyltransferase 1(CPT1)in HepG2 cells;TAM did not affect HepG2 viability.ConclusionsTAM promotes OA-induced cell steatosis,probably by up-regulation of SREBP-1c,FAS and SCD,thus increases fatty acid synthesis in the cells.
HepG 2 cells;Tamoxifen;Steatosis;Triglyceride;Fatty acid synthesis
10.3969/j.issn.1672-5069.2014.01.009
肝脏保护与再生调节北京市重点实验室课题(2013年资助)
100730北京市首都医科大学附属北京同仁医院消化科(赵斐,姜佳丽,展玉涛);军事医学科学院放射与辐射医学研究所(谢萍,张令强);首都医科大学基础医学院细胞生物学系(安威)
赵斐,女,26岁,硕士研究生。主要从事非酒精性脂肪性肝病的发病机制研究。E-mail:fayefly.future@163.com
展玉涛,E-mail:yutaozhan@263.net
