逆转录酶区A181T/V和A181T/V+N236T变异的乙型肝炎病毒感染者临床特征分析*
2014-05-25杨志国常静霞汪茂荣
李 平,杨志国,张 馨,常静霞,高 蕾,汪茂荣
·病毒性肝炎·
逆转录酶区A181T/V和A181T/V+N236T变异的乙型肝炎病毒感染者临床特征分析*
李 平,杨志国,张 馨,常静霞,高 蕾,汪茂荣
目的比较逆转录酶区A181T/V变异与A181T/V+N236T变异的乙型肝炎病毒感染者临床特征的异同。方法对55例发生rtA181T/V单独变异和34例发生rtA181T/V+rtN236T联合变异的乙型肝炎病毒感染者既往核苷(酸)类似物治疗情况进行回顾,对耐药时谷丙转氨酶、谷草转氨酶、HBV M、HBV DNA等指标进行检测,并根据耐药测序结果确定病毒的基因型。结果阿德福韦单药治疗患者发生A181T/V+N236T变异较A181T/V变异的比例高(57.6%对42.4%,P<0.05),而拉米夫定换用(或加用)阿德福韦治疗患者发生A181T/V变异较A181T/V+N236T变异的比例高(75.5%对24.5%,P<0.05);在89例患者中B基因型和C基因型分别是14例和75例,不同变异在B或C基因型中的分布无统计学差异;A181T/V变异与A181T/V+N236T变异相比,两组患者的年龄、性别构成、谷丙转氨酶、谷草转氨酶、HBV DNA、HBsAg定量、HBeAg状态等指标均无统计学差异。结论不同的核苷(酸)类似物治疗可导致A181T/V变异和A181T/V+N236T变异模式的差异,但这两种变异感染者临床指标无明显差异。
乙型肝炎;乙型肝炎病毒逆转录酶区;核苷类耐药;变异
核苷(酸)类似物【Nucleos(t)ide analogues,NAs】是目前治疗慢性乙型肝炎(Chronic hepatitis B,CHB)的重要药物,但随着治疗时间的延长,乙型肝炎病毒(Hepatitis B virus,HBV)可出现耐药变异,造成抗病毒治疗的失败,加剧病情的进展。HBV逆转录酶(Reverse transcriptase,RT)区A181是一个特殊的耐药变异位点,其变异后可引起患者对大部分NAs的治疗敏感性下降[1]。有文献认为,rtA181T/V变异常常与rtN236T变异同时存在[2]。为进一步探讨这两种变异的临床特征及与抗病毒治疗的关系,我们对55例发生rtA181T/V单独变异和34例rtA181T/V+rtN236T联合变异患者的治疗情况进行了回顾分析,现报道如下。
1 资料与方法
1.1 病例来源2010年1月~2012年5月我院收治的慢性乙型肝炎患者89例,男性82例,女性7例,平均年龄(41.1±10.6)岁。诊断符合《慢性乙型肝炎防治指南(2010年版)》[3]。纳入标准:接受NAs抗病毒治疗6 m以上,每3~6 m复查一次,出现病毒突破(HBV DNA大于500copies/mL),且耐药检测提示rtA181T/V或rtA181T/V+rtN236T变异。排除标准:合并丙型肝炎、药物性肝损伤和自身免疫性肝病等。
1.2 常规检测采用奥林巴斯AU5400生化分析仪及相关试剂检测血液生化指标;采用Roche公司的Elecsys 2010仪器和配套试剂检测HBV M;使用ABI 7300荧光定量PCR仪检测HBV DNA(上海科华生物工程股份有限公司)。
1.3 耐药位点检测对PCR产物进行直接测序法,按试剂盒说明提取血清病毒DNA,采用巢式PCR扩增RT区基因,扩增引物见表1。P1、P2扩增第一轮,P3、P4扩增第二轮。条件均为:95℃2 min后,95℃变性30 s,55℃退火30 s,72℃延伸1 min,30个循环后72℃延伸5 min。产物经电泳鉴定后由ABI 3730XL进行测序。结果经MEGA4比对后,参照文献[4]对其中相关耐药位点进行分析。
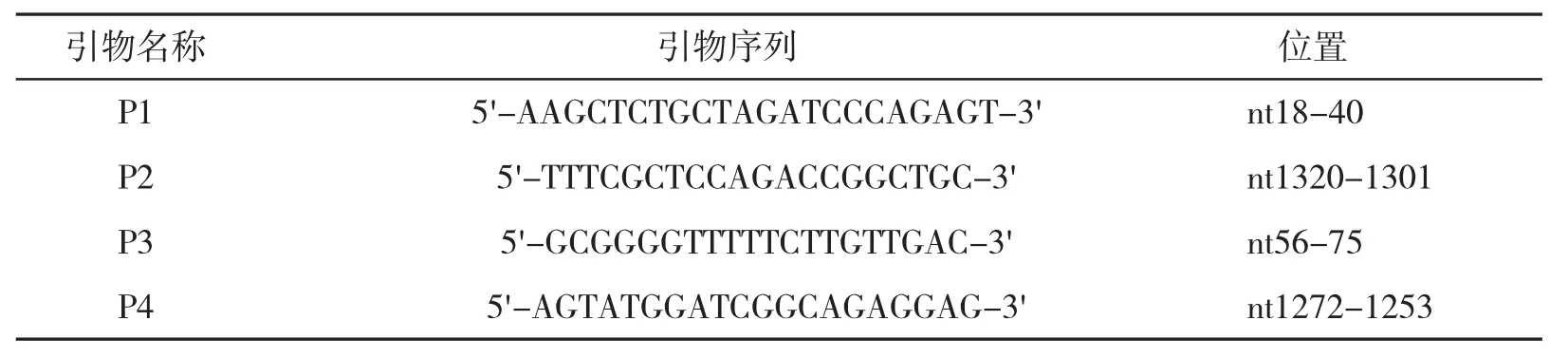
表1 巢式PCR引物
1.4 基因型分析由于HBV基因组重叠编码,HBV S区(nt155~835)包含于RT区域内[5],根据RT区测序结果在线分析HBV基因型(http://www.ncbi.nlm.nih. gov/projects/genotyping/formpage.cgi)。
1.5 统计学处理应用SPSS13.0统计软件进行分析。计数资料构成比采用R×C表的x2检验,计量资料采用独立样本t检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 既往用药情况在本组A181T/V和A181T/V+ N236T变异患者中,单用阿德福韦(adefovir,ADV)33例,拉米夫定(lamivudine,LAM)换用(或加用)ADV53例和替比夫定(telbivudine,LDT)换用ADV3例。比较后发现,ADV单药治疗组患者多发生A181T/V+N236T变异,而LAM换用(或加用)ADV治疗组患者多发生A181T/V变异(表2)。
表2 不同药物治疗患者发生病毒基因变异〔(±s),%〕情况

表2 不同药物治疗患者发生病毒基因变异〔(±s),%〕情况
与A181T/V组比,P<0.05
2.2 不同HBV变异患者感染病毒基因型分布在89例患者中,B基因型14例(15.7%),C基因型75例(84.3%),未见其他基因型。虽然C基因型中181T/V变异比例较高,但统计后未发现显著性差异(P=0.322),表3。

表3 不同HBV变异患者感染病毒基因型分布(%)
2.3不同变异患者临床特征比较在出现耐药变异时,不同变异组患者年龄、性别比、ALT、AST、HBV DNA、HBsAg、HBeAg状态等临床指标均无统计学显著性差异(P>0.05,表4)。
表4 A181T/V变异与A181T/V+N236T变异患者临床特征比较(±s)

表4 A181T/V变异与A181T/V+N236T变异患者临床特征比较(±s)
3 讨论
HBV RT区包括7个功能亚区,分别是G、F、A、B、C、D、E亚区。A181位于B亚区,而N236位于D亚区。2000年台湾学者最早在LAM耐药患者中发现了rtA181变异的存在[6],随后在ADV和LDT上市前临床研究中均发现可出现rtA181耐药变异[7,8]。目前认为rtA181变异对即将在国内上市的替诺福韦(tenofovir,TDF)药物敏感性也呈现一定程度的下降[9]。体外研究结果显示,rtA181T/V变异株对LAM的敏感性较野生株降低了2~11倍,对ADV的敏感性下降2~7倍,对TDF的药物敏感性仅下降1.2~3.2倍[1];而rtN236T变异株对ADV的敏感性较野生株降低了7倍。但是,当出现rtA181T/V+rtN236T联合变异时,可对ADV的敏感性下降18倍以上,而对TDF的敏感性下降10倍以上[10]。共享耐药模式(rtA181T/V)和双重耐药模式(rtA181T/V+rtN236T)使临床后续抗病毒治疗方案变得更加复杂和困难,并可增加发生终末期肝病的风险[11]。因此,本研究对相关变异患者的临床特征进行了比较分析,以期为病情分析和抗病毒治疗提供依据。
通过分析患者抗病毒用药史后发现,rtA181V/T变异多发生于LAM换用(或加用)ADV治疗的患者,而A181T/V+N236T多发生于ADV单药治疗的患者。国内一项比较ADV初治耐药与ADV挽救治疗耐药患者RT区特征的研究也有相同的结论[12],他们发现在ADV初治耐药患者中,rtA181V/T变异和rtA181V/ T+rtN236T变异的比例分别为36.99%和38.36%,而在ADV挽救治疗耐药患者中这两种变异比例分别为61.76%和8.82%。这种变异模式在不同用药史患者中的差异是否与NAs诱导的不同RT区空间构象改变有关,尚有待进一步验证。
HBV基因型反应病毒的异质性,其分布存在地域差异。我国以B型和C型为主。既往有研究认为在干扰素治疗的患者中,其疗效在A基因型优于D基因型,B基因型优于C基因型[13]。但这种治疗结果的差异在NAs治疗患者中未必存在。在我们研究的89例患者中,按照B、C基因型分组后发现,不同耐药模式与基因型之间并没有显著性差异。另两项研究也有相同的结论,即rtA181T/V变异分布与我国B、C基因型没有关系[14,15]。这种基因型差异影响临床表现主要由于干扰素和NAs不同抗病毒机理有关。干扰素主要通过激活免疫而清除病毒,NAs则直接抑制病毒复制。HBV基因型的差异可导致不同的病毒致病性和毒力有所不同。因此,通过免疫途径起作用的干扰素治疗可因基因型的差异产生不同的治疗反应和结局,而不通过免疫途径的NAs抗病毒治疗在不同基因型中则没有显著差异。
HBV发生耐药变异时,患者的临床表现往往轻重不一。导致这一现象是否与不同的病毒耐药模式有关?一项来自302医院的研究认为,HBsAg水平在rtN236T单独突变组与rtN236T+rtA181T联合突变组之间无统计学差异,但HBV DNA和ALT水平在rtN236T+rtA181T突变组中明显高于rtN236T单独突变组[16]。另一项来自上海瑞金医院的研究,比较了6种不同变异模式下患者HBV DNA和ALT水平,结果均没有统计学差异[17]。本研究发现不同变异患者年龄和性别分布、HBsAg定量、HBeAg状态等方面,同样没有表现出差异。我们认为:可能由于宿主体内的病毒群是混合存在的,即使存在不同的变异,但由于体内同时存在非变异毒株,最终临床指标反映了体内准种共同作用的表现。当然,由于病例数的限制,具体结论尚需进一步的大样本研究。
由于HBsAg ORF内的S基因区与RT区完全重叠,部分RT区变异可影响S区基因功能。体外实验结果证明rtA181T变异后可引起HBsAg基因第172位编码色氨酸(w)的密码子突变为终止密码子,即sW172stop变异,导致截短型的HBsAg[18]。动物实验和临床随访发现,这种截短型HBsAg具有潜在的致癌性[19~21]。在我们研究中,有1例耐药变异患者后期发生了原发性肝癌,是否与rtA181T耐药变异直接相关,亦有待进一步研究。
通过本研究我们认为:不同的NAs用药史可导致A181T/V变异与A181T/V+N236T变异模式的差异;临床上,rtA181T/V单独变异和rtA181T/V+rtN236T联合变异患者的临床特征相近。由于这两种变异的分子机制不同,具体“挽救”治疗可能需要区别对待。
[1]Villet S,Pichoud C,Billioud G,et al.Impact of hepatitis B virus rtA181V/T mutants on hepatitis B treatment failure.J Hepatol,2008,48(5):747-755.
[2]王春亚,钟彦伟,刘杰,等.HBV逆转录酶区M204位点单独突变患者与M204+A181T联合突变患者临床特征的比较.实用肝脏病杂志,2010,13(5):260-262.
[3]中华医学会肝病学分会和感染病学分会.慢性乙型肝炎防治指南(2010年版).实用肝脏病杂志,2011,14(2):81-89.
[4]Xu Z,Liu Y,Xu T,et al.Acute hepatitis B infection associated with drug-resistant hepatitis B virus.J Clin Virol,2010,48(4):270-274.
[5]骆抗先,陈金军,李平.乙型肝炎基础与临床.4版,北京:人民卫生出版社,2012:1-4.
[6]Yeh CT,Chien RN,Chu CM,et al.Clearance of the original hepatitis B virus YMDD-motif mutants with emergence of distinct lamivudine-resistant mutants during prolonged lamivudine therapy.Hepatology,2000,31(6):1318-1326.
[7]Hadziyannis SJ,Tassopoulos NC,Heathcote EJ,et al.Long-term therapy with adefovir dipivoxil for HBeAg-negative chronic hepatitis B.N Engl J Med,2005,352(26):2673-2681.
[8]Lai CL,Gane E,Liaw YF,et al.Telbivudine versus lamivudine in patients with chronic hepatitis B.N Engl J Med,2007,357(25):2576-2588.
[9]Zoulin F,Locarnini S.Hepatitis B virus resistance to nucleos-(t)ide analogues.Gastroenterology,2009,137(5):1593-608.
[10]QiX,XiongS,YangH,etal.Invitrosusceptibilityof adefovir-associated hepatitis B virus polymerase mutations to other antiviral agents.Antivir Ther,2007,12(3):355-362.
[11]耐药管理讨论会专家.核苷和核苷酸类药物治疗慢性乙型肝炎的耐药及其管理.实用肝脏病杂志,2013,16(1):1-8.
[12]邵幼林,张锁才,柳龙根,等.ADV初治耐药与LAM耐药者再耐药时HBV-RT区的变异特征.世界华人消化杂志,2012,20(20):879-1883.
[13]Liu CJ,Kao JH.Genetic variability of hepatitis B virus and response to antiviral therapy.Antivir Ther,2008,13(5):613-624.
[14]Li X D,Wang L,Liu Y,et al.Characterization of hepatitis B virus genotypes/subgenotypes in 1,301 patients with chronic hepatitis B in North China.ChinMedJ(Engl),2011,124(24):4178-4183.
[15]Zhong YW,Li J,Song HB,et al.Virologic and clinical characteristics of HBV genotypes/subgenotypes in 487 Chinese pediatric patients with CHB.BMC Infect Dis,2011,11:262-268.
[16]赵攀,徐东平,李晓东,等.乙型肝炎病毒逆转录酶区N236T单独突变与N236T+A181T联合突变患者临床特征的比较.第二军医大学学报,2010,31(8):834-836.
[17]邓俊,张东华,于德,等.核苷(酸)类耐药患者中乙型肝炎病毒逆转录酶区基因变异类型及其特点.中华肝脏病杂志,2009,17(5):342-345.
[18]Warner N,Locarnini S.The Antiviral drug selected hepatitis B virusrtA181T/sW172*mutanthasadominantnegative secretion defect and alters the typical profile of viral rebound. Hepatology,2008,48(1):88-98.
[19]Lai MW,Yeh CT.The oncogenic potential of hepatitis B virus rtA181T/surface truncation mutant.Antivir Ther,2008,13:875-879.
[20]Lai MW,Huang SF,Hsu CW,et al.Identification of nonsense mutations in hepatitis B virus S gene in patients with hepatocellular carcinoma developed after lamivudine therapy.Antivir Ther,2009,14(2):249-261.
[21]Yeh CT,Chen T,Hsu CW,et al.Emergence of the rtA181T/ sW172*mutant increased the risk of hepatoma occurrence in patients with lamivudine-resistant chronic hepatitis B.BMC Cancer,2011,11:398.
(收稿:2013-05-06)
(校对:陈从新)
Clinical characteristics of patients with A181T/V mutation or A181T/V+N236T mutation in hepatitis B virus reverse transcriptase region after nucleoside treatment
Li Ping,Yang Zhiguo,Zhang Xin,et al.
Center for Liver Disease Research,81st Hospital of PLA,Nanjing 210002,China
ObjectiveTo compare the clinical features between patients infected with hepatitis B virus(HBV)presenting A181T/V mutation or A181T/V+N236T mutation in HBV reverse transcriptase region after nucleoside treatment.MethodsFifty-five patients with rtA181T/V mutation and 34 patients with rtA181T/V+rtN236T mutation were enrolled in this study.Their administration of nucleoside analogues was reviewed;Serum ALT,AST,HBV M and HBV DNA were detected;HBV genotypes were determined by DNA sequencing.ResultsIn adefovir treatment group,the A181T/V+N236T mutation was more common than rtA181T/V mutation(57.6%vs.42.4%,P<0.05),while the occurrence of rtA181T/V mutation was higher than A181T/V+N236T mutation in patients receiving lamivudine treatment(75.5%vs.24.5%,P<0.05);In the total 89 patients in our series,there were 14 cases with genotypes B and 75 cases with genotype C of HBV infection,and there was no significant difference in the distribution of mutations between patients with either of the two genotype infection;There were no statistical differences as respect to age,gender,ALT,AST,HBV DNA,HBsAg titers and HBeAg status between the two groups of patients with different mutations.ConclusionsA given nucleoside analogue treatment leads to specific pattern of HBV reverse transcriptase region mutation;However,there is no special clinical significance between different mutations.
Hepatitis B;Nucleoside analogues;Reverse transcriptase region;Mutation
10.3969/j.issn.1672-5069.2014.01.011
国家艾滋病和病毒性肝炎等重大传染病防治专项(2008ZX10002-004)
210002南京市解放军第81医院肝病研究所
李平,男,33岁,博士研究生,主治医师。主要从事肝病和传染病的基础和临床工作。E-mail:leep2002@163.com
