三七渣发酵生产蛋白饲料的菌体生长动力学
2014-05-25谭显东段娅宁王君君羊依金
谭显东 胡 伟 段娅宁 王君君 羊依金
(成都信息工程学院资源环境学院,成都 610225)
通过固态发酵技术将中药渣转变为蛋白饲料,可以实现中药渣的完全利用,这为中药渣的资源化开辟了一条新的道路[1]。由于进行固态发酵过程参数的测量十分困难,已有的研究工作主要围绕各种药渣发酵工艺条件的优化展开[2~6],对相关体系发酵动力学的研究少见报道。而发酵动力学是生化反应工程的基础内容之一,以研究发酵过程的反应速率和环境因素对速率的影响为主要内容。通过发酵动力学的研究,可进一步了解微生物的生理特征,菌体生长和产物形成的合适条件,以及各种发酵参数之间的关系。固态发酵过程数学模型既可以用于指导生物反应器的放大设计,也可以用于对整个发酵过程的调控,是发酵过程优化研究的核心内容。
微生物是发酵培养过程的主体,固态发酵过程数学模型的开发依赖于微生物生长动力学过程的准确模拟,也直接影响着对固态发酵过程的精确调控。因此,开展了三七渣固态发酵生产蛋白饲料的菌体生长动力学研究。
1 材料和方法
1.1 材料与仪器
产朊假丝酵母(Candida utilis 2.281):四川大学建筑与环境学院;黑曲霉(Aspergillus niger sp.):山东农业大学生命科学学院;三七渣(其中粗蛋白、淀粉、真蛋白的质量分数分别为12.28%、33.13%、9.97%):四川省某中成药厂;葡萄糖、硫酸铵、乙酸、乙酸钠、乙醇、琼脂:成都市科龙化工试剂厂。
QYC-211型恒温振荡器:上海福玛实验设备有限公司;PYX-280M-C型电热恒温培养箱:广东韶关科力实验仪器有限公司;SAL-T11型Labswiftaw便携式水分活度测定仪:瑞士NOVASINA公司;UV-2550型紫外可见光光度计:SHIMADZU公司;KDN-08C型定氮仪:上海华睿仪器有限公司;7200型分光光度计:尤尼柯(上海)仪器有限公司。
1.2 培养基
PDA培养基:马铃薯浸取液1.0 L,葡萄糖20.0 g,琼脂15.0 g,pH 自然,121 ℃ 灭菌 20 min,用于黑曲霉的培养。
土豆汁液体培养基:马铃薯浸取液1.0 L,葡萄糖20.0 g,pH 自然,121 ℃灭菌 20 min,用于产朊假丝酵母的培养。
固态发酵培养基:在10.0 g经过预处理的三七渣中加入0.50 g硫酸铵,培养基含水量70%。于121℃灭菌30 min,用于菌体生长动力学试验。
1.3 试验方法
1.3.1 三七渣的预处理
三七渣湿物料经自然晾晒风干后于60℃干燥72 h、粉碎、过60目筛后置于干燥器中备用。
1.3.2 种子液的制备
黑曲霉采用PDA平板培养基在30℃下于电热恒温培养箱内培养3.5 d后刮下,将其制成浓度为2×107个/mL的孢子悬液;产朊假丝酵母采用土豆汁液体培养基在30℃下于电热恒温培养箱内培养18 h,制成浓度为2×107个/mL的菌悬液。
1.3.3 菌体生长动力学试验
取126个容量为250 mL的锥形瓶,每个锥形瓶中装入含10.0 g干三七渣的固态发酵培养基,将其在121℃灭菌30 min,冷却后同步接入1.0 mL黑曲霉孢子悬液和1.0 mL产朊假丝酵母菌悬液,然后在30℃条件下进行恒温培养,培养时间为10 d。试验开始后,每隔12 h(含0时刻)取出6个锥形瓶进行相关参数的分析测试:从其中3个锥形瓶中分别取出1.00 g发酵培养物湿物料作为平行样用于酶活的测试,然后将这3个锥形品中剩余的发酵培养物在80℃条件下烘干至恒重后作为平行样用于提取核酸,并测试核酸提取液的吸光度;另外3个锥形瓶中的发酵培养物在80℃条件下烘干至恒重进行称量。
所有试验数据均为3个平行样的平均值。
1.3.4 分析方法
1.3.4.1 真蛋白的测定
发酵培养物需要在80℃条件下烘48 h,再磨碎后取样,然后先将样品进行醇洗预处理去除其中的无机氮[7],再采用凯氏定氮法测定[8]。
1.3.4.2 粗酶液的提取及酶活的测定
准确称取1.00 g发酵培养物(湿基),将其溶于pH=4.6的50 mL 0.2 mol/L乙酸-乙酸钠缓冲液中,在40℃恒温空气浴中振荡浸提1 h,然后经4层纱布过滤后,将滤液在5 000 r/min条件下离心10 min,取上清液制成粗酶液,置于冰箱中待用。
FPA酶活参照文献[9]、淀粉酶活参照文献[10]提供的方法进行测定。
1.3.4.3 水分活度测定
采用Labswift-aw便携式水分活度测定仪。
1.3.4.4 水分含量测定
将发酵后的培养物连同锥形瓶一起称重,减去锥形瓶自身的质量后可得到发酵培养物的湿重W1,再将发酵后的培养物连同锥形瓶一起放入80℃的烘箱中烘干至恒重,将其置于干燥器中冷却至室温后再称重后可以计算得到发酵培养物的干重W2。水含量可以通过下列公式计算:
1.3.4.5 菌体的生长情况的测定
参照文献[11],通过测定发酵培养物核酸提取液在260 nm处的OD值来间接反映菌体的生长情况。
1.4 建立数学模型的方法
由于对数模型的数学表达形式相对简单:只需要用一个方程就能够近似表示包括适应期、对数生长期和稳定期在内的生长曲线,因此在固态发酵动力学研究中得到了广泛的应用[12]。在本研究中采用丝状真菌和酵母菌进行混菌发酵,由于菌丝体会渗透到固态基质之中,与基质紧密的缠结在一起,再加上微生物代谢分泌的各种水解酶类也是目标产物,因此很难进行菌体的直接测量。相关研究[13]发现发酵过程中干物质减重率和菌体细胞的浓度存在线性关系,这样就可以用宏观的干物质减重率来间接地描述菌体的生长,用于指导过程设计和放大[14-15]。干物质减重率X(%)定义如下:

式中:m0为t=0时发酵底物的干基质量/g;mt为t时刻发酵培养物的干基质量/g。
相应的菌体生长动力学方程数学表达式如下:积分后可得


式中:X为t时刻干物质减重率/%;Xm为最大干物质减重率/%;X0为t=0时干物质减重率/%;μ为比生长速率常数/h-1;t为发酵时间/h。
本次研究采用Origin 8.0软件内置的Slogistic3标准曲线模型对发酵过程中X-t的关系进行非线性拟合,建立了菌体生长动力学模型。
2 结果与讨论
2.1 三七渣发酵过程动态分析
2.1.1 真蛋白含量及产率系数的动态变化
发酵培养物真蛋白含量及产率系数的动态变化如图1所示。
由图1可以看出,发酵培养物的真蛋白含量随发酵时间的延长不断增长,达到峰值后,又逐渐下降,最后趋于稳定。在采用采用黑曲霉固态发酵米糠[16]、好食链孢霉(Neurospora sitophila)发酵麸皮[17]以及采用青霉(Penicillium)、根霉(Rhizopus)、木霉(Trichoderma spp.)发酵蔓越莓废渣[18]的研究中发酵培养物中蛋白含量变化趋势与本次研究相似。由图1还可以看出,真蛋白产率系数(指投入单位质量的发酵底物经过一段时间的发酵后所能收获的真蛋白质量)随时间的变化趋势则有所不同,在0~36 h期间,真蛋白产率系数逐渐增大,特别是在12~36 h期间,真蛋白产率系数的增加速度是整个发酵周期中最快的,这一阶段对真蛋白净增长贡献最大;在随后的108 h(第36~144 h)期间,真蛋白产率系数在0.132~0.138 g真蛋白/g干三七渣之间波动,基本维持稳定,这一阶段对真蛋白净增长几乎没有贡献,但是在这一阶段,微生物通过呼吸作用产生了“浓缩效应”,对发酵培养物真蛋白含量的提高起到了重要作用。在144~240 h期间,真蛋白产率系数不断下降,特别是204 h以后,真蛋白产率系数在数值上已经低于发酵原料三七渣自身的真蛋白含量(0.099 7 g真蛋白/g干三七渣)。产生这种现象的原因在于:在总氮平衡的发酵体系中,分解作用会减少系统中蛋白质总量[19],需要通过对发酵周期的选择来控制这种负效应。

图1 真蛋白含量和产率系数的动态变化
2.1.2 发酵培养物酶活的动态变化
发酵培养物FPA酶活和淀粉酶活的动态变化如图2所示。
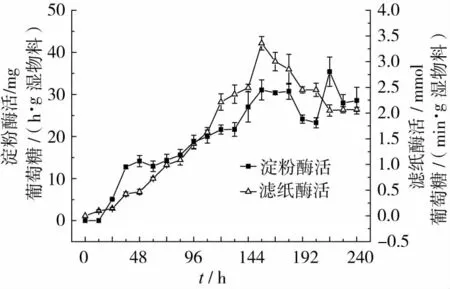
图2 酶活的动态变化
由图2可以看出,FPA酶活与淀粉酶活都先随着发酵时间的延长逐渐增大,在发酵156 h后达到峰值,然后FPA酶活逐渐下降,淀粉酶活稳定了24 h后也开始下降。酶活力的大小反映了体系中酶蛋白浓度的高低和对相应底物的催化水解能力。本研究中酶活达到峰值的时间与发酵培养物中真蛋白含量以及生物量达到峰值的时间基本一致。在采用生木薯渣培育根霉时,发酵初期,α-淀粉酶活与葡萄糖淀粉酶活也都呈现不断上升的趋势[20]。采用黑曲霉发酵小麦麸皮、米糠、落花生草料以及锯木屑时,CMC酶活在发酵24 h后达到最高,随后逐渐下降;而FPA酶活却在第3天才达到峰值,然后逐渐下降[16]。
2.1.3 干重的动态变化
发酵培养物干重的动态变化如图3所示。
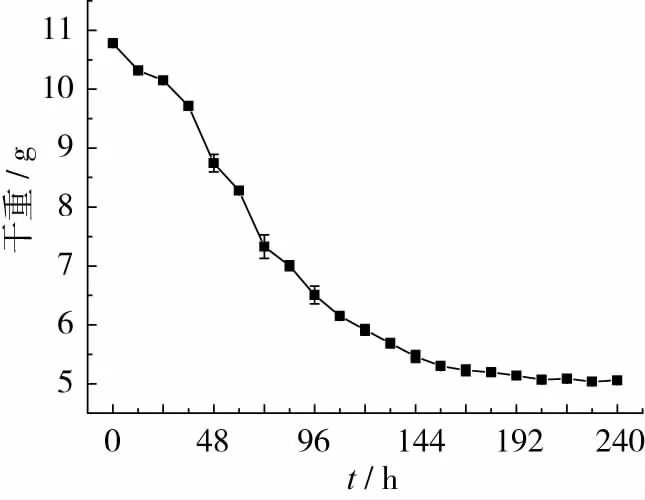
图3 发酵培养物干重的动态变化
由图3可以看出,发酵培养物干重随着发酵时间的延长而逐渐降低,到发酵末期基本保持稳定。在发酵24~72 h期间,发酵培养物干重的降速最大,72~168 h期间降速有所减缓,168~240 h期间基本维持不变。在这3个阶段,发酵培养物干重的变化速率分别为 1.41、0.525、2.36 ×10-3g/d,发酵结束时产品收率为50.5%。而在采用黑曲霉发酵蔬菜废弃物9 d后,发酵培养物仅减重4%[21]。发酵培养物减重的速率和比例与基质中碳源是否容易被利用直接相关。
2.1.4 OD260的动态变化
参照文献[11]所描述的方法提取发酵培养物中的核酸,将提取液稀释5倍后测量其吸光度,间接表示发酵过程中菌体生长情况,结果如图4所示。
由图4可以看出,在0~132 h期间,OD260值逐渐增长;132~168 h期间,OD260值基本保持稳定;168 h后OD260值有所下降。这与微生物生长曲线的变化趋势基本一致。在采用黑曲霉固态发酵长豆角荚[22]和小麦麸皮[23],采用产朊假丝酵母发酵苹果渣[24]和米糠[25]的研究中发现菌体生长的动态变化趋势也与此相似。

图4 OD260的动态变化
2.1.5 水含量和水活度的动态变化
发酵过程中水含量和水活度随时间的变化如图5所示。

图5 水含量和水活度的动态变化
由图5可以看出,在发酵12~84 h期间,水活度轻微下降,可能是由于在此期间微生物新陈代谢非常活跃,在短期内产生了大量的代谢热,促进了水分的蒸发,使得体系的含盐量相对增加所造成。由图5还可以看出,在发酵过程中发酵培养物的水含量逐渐增加,这与采用黑曲霉发酵炒制过的木薯渣[26-28]和蔬菜废弃物[29]时发酵培养物水含量的动态变化趋势相似。但是,在黑曲霉固态发酵小麦麸皮[23]过程中却发现培养物水含量没有显著变化。固态发酵过程中发酵培养物水含量的变化应归因于菌体生长、孢子形成和萌发、产物形成、蒸发作用对水的消耗和生成作用[29]。由于影响因素复杂,所以在不同发酵体系中往往呈现出不同的结果。
2.2 菌体生长动力学模型
发酵培养物的干物质减重率随时间的动态变化如图6所示。采用Origin8.0软件按照式(2)所示的对数模型对图6中的数据进行非线性拟合,拟合曲线和相关统计参数分别见图6和表1。
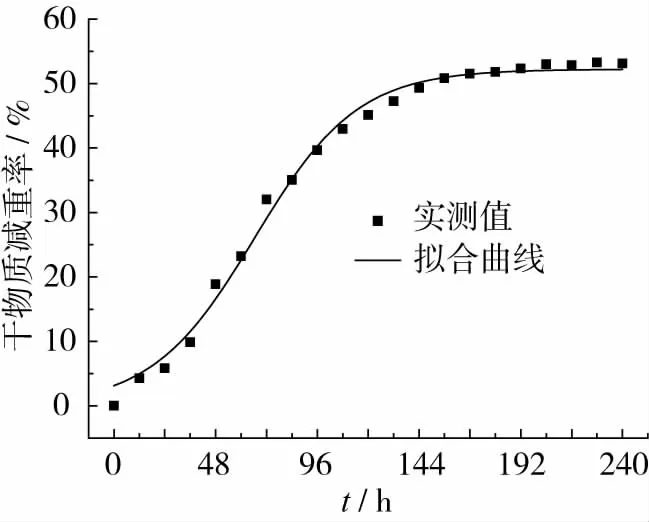
图6 菌体生长拟合曲线

表1 菌体生长动力学模型参数表
由图6和表1可以看出,拟合曲线的相关性很好,符合统计检验的要求。根据上述结果,可以得到黑曲霉/产朊假丝酵母固态发酵三七渣生产蛋白饲料过程中的菌体生长动力学方程如下:

或
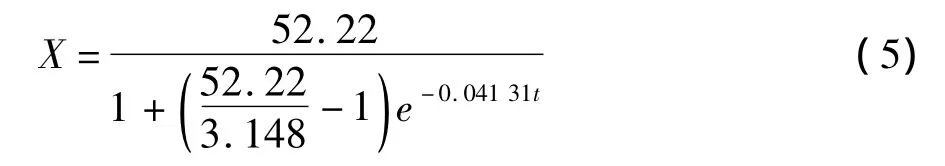
利用Origin8.0软件对图4中的拟合曲线进行数值微分,可以获得菌体生长速率随时间变化的曲线,结果如图7所示。

图7 菌体生长速率的动态变化
由图7可知,在发酵66 h后菌体生长速率达到最大值。
3 结论
3.1 发酵培养物真蛋白含量、酶活、核酸提取液OD260的变化趋势基本一致:它们先随发酵时间的延长而逐渐增大,然后又逐渐降低并趋于稳定;发酵培养物水含量变化较大,而水活度变化较小。
3.2 以干物质减重率作为表达菌体浓度的间接参数,菌体生长动力学适合采用对数模型进行描述,最大干物质减重率为52.22%,比生长速率常数μ=0.041 31 h-1。菌体生长速率在发酵66 h后达到最大值。
[1]谭显东,王向东,黄健盛,等.中药渣资源化技术研究进展[J].中成药,2010,32(5):847 -849
[2]谭显东,王向东,杨平,等.康宁木酶固态发酵中药渣制备蛋白饲料[J].四川大学学报:工程科学版,2008(4):71-76
[3]刘凤梅,谭显东,羊依金,等.三七渣固态发酵生产蛋白饲料[J].中国酿造,2011(2):67-70
[4]秦岭,王向东,潘朝智,等.多菌种混合发酵生脉饮药渣生产蛋白饲料工艺条件优化[J].食品与生物技术学报,2008(4):122-128
[5]王兵,王向东,秦岭,等.中药渣固态发酵生产蛋白饲料[J].食品与生物技术学报,2007(4):77-82
[6]段娅宁,谭显东,羊依金,等.用于蛋白富集的三七渣培养基制备条件优化[J].中国饲料,2012(7):40-42
[7]胡艳丽,王克然.饲料中真蛋白的测定[J].河南畜牧兽医,2007,28(10):31 -32
[8]张丽英.饲料分析及饲料质量检测技术[M].北京:中国农业大学出版社,2007:52-61
[9]陈洪章.纤维素生物技术[M].北京:化学工业出版社,2011:261-265
[10]陈毓荃.生物化学实验方法和技术[M].北京:科学出版社,2002:83-86
[11]魏培莲,岑沛霖,盛春琦.3种固态发酵生物量测定方法的比较[J].食品与生物技术学报,2006,25(1):60 -64,69
[12]Mitchell D A,Vonm O F,Krieger N,et al.A review of recent developments in modeling of microbial growth kinetics and intraparticle phenomena in solid - state fermentation[J].Biochemical Engineering Journal,2004,17:15 -26
[13]Mitchell D A,Greenfield P F,Doelle H W.An empirical model of growth of Rhizopus oligosporus in solid-state fermentation[J].Journal of Fermentation and Bioengineering,1991,72:224 -226
[14]Wang R,Shalyda M D,Godoya L C,et al.Bioconversion of rapeseed meal for the production of a generic microbial feedstock[J].Enzyme and Microbial Technology,2010,47:77 -83
[15]Weng X Y,Sun J Y.Kinetics of biodegradation of free gossypol by Candida tropicalis in solid - state fermentation[J].Biochemical Engineering Journal,2006,32(3):226 -232
[16]Chandra M S,Viswanath B,Reddy B R.Cellulolytic enzymes on lignocellulosic substrates in solid state fermentation by Aspergillus niger[J].Indian Journal of Microbiology,2007,47(10):323-328
[17]Shojaosadati S A,Faraidouni R,Madadi- Nouei A,et al.Protein enrichment of lignocellulosic substrates by solid state fermentation using Neurospora sitophila[J].Resources,Conservation and Recycling,1999,27:73 - 87
[18]Zheng Z X,Shetty K.Cranberry processing waste for solid state fungal inoculant production[J].Process Biochemistry,1998,33(3):323 -329
[19]白玉明,褚西宁,张红,等.单细胞蛋白固态发酵系统的总氮平衡与功效评价[J].山西大学学报:自然科学版,1998,21(1):72 -76
[20]Soccol C R,Marin B,Raimbault M,et al.Breeding and growth of Rhizopus in raw cassava by solid state fermentation[J].Applied Microbiology and Biotechnology,1994,41:330-336
[21]Rajesh N,Joseph I,Paul Raj R.Value addition of vegetable wastes by solid-state fermentation using Aspergillus niger for use in aquafeed industry[J].Waste Management,2010,30(11):2223-2227
[22]Smail T,Salhi O,Knapp J S.Solid - state fermentation of carob pods by Aspergillus niger for protein production:effect of particle size[J].World Journal of Microbiology & Biotechnology,1995,11:171 -173
[23]Hamidi- Esfahani Z,Shojaosadati S A,Rinzema A.Modelling of simultaneous effect of moisture and temperature on A.niger growth in solid - state fermentation[J].Biochemical Engineering Journal,2004,21:265 -272
[25]Rajoka M I,Tariq Kiani M A,Khan S,et al.Production of single cell Protein from rice Polishing using Candida utilis[J].World Journal of Microbiology & Biotechoology,2004,20(3):297-301
[26]Oriol E,Raimbault M,Roussos S,et al.Water and water activity in the solid state fermentation of cassava starch by Aspergillus niger[J].Appl Microbiol Biotechnol,1988,27:498-503
[27]Narahara H,Koyama Y,Yoshida T,et al.Growth and enzyme production in a solid-state culture of Aspergillus oryzae[J].J Ferment Technol,1982,69:311 -319
[28]Oriol E,Schettino B,Viniegra - Gonzales G,et al.Solid -state culture of Aspergillus niger on support[J].Journal ofFermentation Technology,1988,66(1):57 -62
[29]Foong C W,Janaun J,Krishnaiah K,et al.Effect of superficial air velocity on solid state fermentation of palm kernel cake in a lab scale fermenter using locally isolated fungal strain[J].Industrial Crops and Products,2009,30:114 -118.
